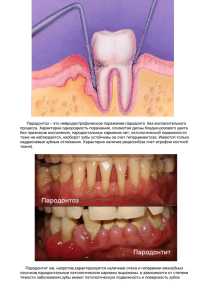
Клиническое и диагностическое значение оценки
advertisement

ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «КАЗАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ На правах рукописи Василевская Елена Михайловна Клиническое и диагностическое значение оценки стоматологического статуса у пациентов после коронарного шунтирования Специальность 14.01.14 – Стоматология ДИССЕРТАЦИЯ на соискание ученой степени кандидата медицинских наук Научный руководитель: доктор медицинских наук, доцент С.Л. Блашкова Научный консультант: доктор медицинских наук, профессор А.С. Галявич Казань - 2015 2 СОДЕРЖАНИЕ ВВЕДЕНИЕ……………………………………………………………………………4 ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ 1.1.Этиология и патогенез пародонтита……………………………………………..11 1.2.Взаимосвязь заболеваний пародонта с сердечно-сосудистыми заболеваниями…………………………………………………………………………18 1.3. Профилактика и лечение заболеваний пародонта у пациентов с сердечнососудистыми заболеваниями…………………………………………………………26 ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ 2.1 Объем и объекты исследования ………………………………………………...35 2.2 Клинические методы исследования……………………………………………..37 2.3 Методы иммунологических исследований …………………………………….42 2.4 Определения С – реактивного высокочувствительного белка ……………..…49 2.5 Метод исследования микробиологического статуса ………………………….54 2.6 Методы исследования биохимических показателей крови……………………50 2.7 Алгоритм комплексной профилактики заболеваний пародонта у пациентов с ИБС ……………………………………………………………………………….52 2.8 Методы статистической обработки результатов исследования………………54 РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ ГЛАВА 3. Результаты клинических исследований…………………………………58 3.1 Общая характеристика и анамнестические данные пациентов с ишемической болезнью сердца………………………………............................................................58 3.2 Клиническая характеристика хронического генерализованного пародонтита у обследованных больных ……………………….................................62 ГЛАВА 4. РЕЗУЛЬТАТЫ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ……………….76 4.1 Оценка микробного пейзажа ротовой полости у пациентов на разных этапах стационарного лечения пациентов кардиохирургического профиля в зависимости от проводимой профилактики заболеваний пародонта…………………………….76 4.2 Оценка иммунологических показателей у исследуемых на разных этапах стационарного лечения в зависимости от проведения профилактики…………….86 3 4.3 Оценка клеточного состава крови у исследуемых на разных этапах стационарного лечения в зависимости от проведения профилактики…………….92 4.4 Построение прогностической модели риска развития воспалительного процесса в тканях пародонта у пациентов с ИБС перед АКШ……………………………………………………………………………………96 ЗАКЛЮЧЕНИЕ………………………………………………………………………..98 ВЫВОДЫ…………………………………………………………………………….112 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ…………………………………………….114 СПИСОК СОКРАЩЕНИЙ………………………………………………………….116 СПИСОКЛИТЕРАТУРЫ……………………………………………………………117 СПИСОК ИЛЛЮСТРИРОВАННОГО МАТЕРИАЛА……………………………142 ПРИЛОЖЕНИЕ 1 Информация для пациента с формой инфомированного согласия на участие в клиническом исследовании………………………………..145 ПРИЛОЖЕНИЕ 2. Индивидуальная регистрационная карта пациента………….149 4 ВВЕДЕНИЕ Актуальность проблемы. По данным эпидемиологических исследований, воспалительные заболевания пародонта встречаются от 60 до 98% населения России, что говорит о высокой распространенности данной патологии [44, 63]. При проведении стоматологических осмотров у больше половины обследованных (57%) обнаруживаются сопутствующие заболевания, которые снижают продолжительность и качество жизни [61, 84]. Интерес многих авторов к проблеме и роли стоматологического здоровья в обеспечении качества жизни населения людей неизменно растет. Медицинское понятие стоматологического здоровья включает в себя совокупность эстетических, клинических, морфологических и функциональных критериев зубочелюстно-лицевой системы, обеспечивающих психологическое, эмоциональное, социальное и физическое благополучие человека [74]. В свою очередь стоматологическое здоровье зависит от общего состояния организма, поведения и привычек человека [107]. В результате многочисленных исследований было доказано, что, состояние органов полости рта является информативным показателем, динамически отражающим общее состояние организма в целом [4]. В последние годы было отмечено, что проблема ишемическая болезнь сердца (ИБС) занимает одно из ведущих мест среди медицинских проблем XXI века, может стать основной причиной смертности, а также временной и стойкой утратой трудоспособности населения в развитых странах мира. ИБС объединяет группу заболеваний, в основе развития которых лежит атеросклеротическое поражение коронарных сосудов. В настоящее время все большее внимание уделяется состоянию здоровья полости рта у пациентов с сердечно-сосудистыми заболеваниями [142, 179], в частности, ИБС. По данным ряда авторов, пародонтит является фактором риска развития сердечно-сосудистой патологии [163, 178]. 5 На сегодняшний день хронический генерализованный пародонтит (ХГП) рассматривают как многофакторное заболевание, которое состоит из разнообразных по характеру звеньев, таких как микробный зубной налет и продукты его жизнедеятельности, состояние полости рта, способствующие образованию зубной бляшки и/или влияющих на пародонтопатогенный потенциал микрофлоры, и общих (системных) факторов, обеспечивающих гомеостаз пародонта [18]. Большое значение на сегодняшний день придается роли иммунной системы в развитии и течении хронического генерализованного пародонтита [99]. Дисбаланс, происходящий в иммунной системе у пациентов с ХГП, является следствием генетической предрасположенности, или он развивается на фоне общесоматической патологии внутренних органов, эндокринных нарушений, хронических вирусных, бактериальных и грибковых инфекций [25,131,160,175,180]. В результате утяжеляется патологический процесса в тканях пародонта и, соответственно, ухудшается гигиеническое состояние полости рта [106]. Немаловажным является тот факт, что хронические инфекционно- воспалительные заболевания полости рта могут быть одной из причин риска формирования системного воспалительного ответа, лежащего в основе развития, в том числе, и атеросклероза сосудов [37]. Данная теория объясняется положением «активация эндотелия сосудов» [142]. Циркулирующие продукты жизнедеятельности бактерий, цитокины и хемокины изменяют регуляцию поверхностных рецепторов клеток эндотелиальной выстилки и приводят к выраженной адгезии молекул. В результате моноциты периферической крови задерживаются и в дальнейшем адгезируются к эндотелию сосудов, мигрируют в субэндотелиальное пространство и становятся тканевыми макрофагами. Антитела, вырабатываемые организмом-хозяином и направленные против специфичных белков бактерий, частично выступают в качестве аутоантител и вызывают апоптозное разрушение эндотелиальных клеток сосудов [78]. 6 Было отмечено, что препараты, назначаемые пациентам, имеющие в анамнезе ИБС, влияют на состояние полости рта, появление запаха изо рта, снижение слюноотделения, что способствует ускоренному образованию зубного налета и может явиться причиной ухудшения прогноза стоматологических заболеваний и способствовать прогрессированию воспалительных процессов в тканях пародонта [42]. Согласно точке зрения ряда авторов, на характер течения обострений заболеваний пародонта и эффективность его лечения влияет своевременная ранняя диагностика и профилактика [21,76]. При этом необходимо соблюдать принцип индивидуального подхода к каждому пациенту с учетом данных общего и соматического статуса. Следовательно, проведение лечебно-профилактических мероприятий должно быть направлено нормализацию гигиенического состояния полости рта, коррекцию метаболических, микроциркуляторных нарушений в тканях пародонта что способствует ликвидации воспалительных изменений в тканях пародонта [94]. Несмотря на значительные успехи в изучении воспалительных процессов, происходящих в тканях пародонта на фоне ИБС, остается актуальной проблема совершенствования организации лечебно-профилактической помощи больным с ХГП на фоне ИБС перед аортокоронарным шунтированием (АКШ), выявления факторов риска, ранних признаков заболеваний пародонта, разработки методов ранней диагностики и профилактики обострений заболеваний пародонта. Целью настоящего исследования явилась повышение эффективности диагностики и профилактики заболеваний пародонта у пациентов с ИБС после коронарного шунтирования. Для достижения указанной цели были поставлены следующие задачи: 1. Изучить стоматологический статус и выявить факторы риска возникновения заболеваний пародонта у пациентов с ИБС. 2. Определить характер микрофлоры полости рта у пациентов с ИБС методом масс-спектрометрии на приборе MALDI Biotyper. 3. Изучить иммунологические показатели у пациентов с ХГП на фоне ИБС. 7 4. Разработать и внедрить алгоритм проведения лечебно–профилактических мероприятий заболеваний пародонта и предупреждения развития обострений у пациентов с ИБС на этапе подготовке к операции АКШ и оценить полученные результаты. 5. Создать прогностическую модель риска развития воспалительного процесса в тканях пародонта у пациентов с ИБС на этапе подготовке к аортокоронарному шунтированию. Научная новизна исследования. В работе получены новые сведения о распространенности хронических воспалительных заболеваний пародонта у пациентов с ИБС; при этом выявлено преобладание генерализованной формы пародонтита. Впервые разработана прогностическая модель с использованием метода бинарной логистической регрессии, позволяющая определять возможный риск возникновения заболеваний пародонта, у пациентов с ИБС, готовящихся к операции АКШ, в зависимости от выраженности факторов риска (возраст, наличие артериальной гипертонии и перенесенные ранее острые ишемические заболевания). Проведен сравнительный анализ количественного и качественного состава микроорганизмов полости рта у лиц с ИБС до и после АКШ, находящихся на стационарном лечении методом масс-спектрометрии на приборе MALDI Biotyper. Установлено, что у пациентов с интактным пародонтом после проведения АКШ, а также с хроническим генерализованным пародонтитом происходит иммунный дисбаланс, который влияет на характер воспаления в тканях пародонта и на состояние организма в целом. Впервые были предложен, апробирован и внедрен алгоритм лечебнопрофилактических мероприятий у пациентов с ИБС перед АКШ. Разработан алгоритм тактики и сроков ведения данной группы пациентов. Представлено патогенетически обоснованное применение препаратов, оказывающих антимикробное и противовоспалительное действие, на состояние 8 тканей пародонта, гигиенический статус полости рта и на показатели общего и местного иммунитета больных с ИБС при АКШ. Теоретическая и практическая значимость исследования заключается в том, что для выявления воспалительного процесса в тканях пародонта, выбора лечебно-профилактических препаратов и контроля их эффективности необходимо дополнять клиническую диагностику хронического генерализованного пародонтита у пациентов с ИБС результатами исследования показателей общего и местного иммунного статуса, а именно: уровнем IgM, IgG, IgA, В-лимфоцитов (CD19+) в плазме крови, sIgA в смешанной слюне, а также микробиологического исследования. Результаты проведенных исследований о распространенности воспалительных заболеваний пародонта и наличие в анамнезе ИБС позволяют рекомендовать выделять пациентов с хроническим генерализованным пародонтитом в группу риска при проведении лечебно-профилактических мероприятий. Для оценки предрасположенности к развитию заболеваний пародонта и обострений целесообразно применять прогностическую модель риска в клинической практике на основе определения факторов риска воспалительных заболеваний пародонта у мужчин с ИБС, находящихся на этапе подготовки к АКШ (возраст, курение, артериальная гипертония, острые ишемические заболевания). Разработанный алгоритм комплексной профилактики, направленный на снижение риска развития осложнений в послеоперационном периоде, внедрен в практику как врачей стоматологов, так и врачей кардиологов. Проведение лечебно-профилактических мероприятий у пациентов, готовившихся к АКШ, с первого дня поступления в стационар приводят к благоприятным изменениям микробиологического статуса полости рта, факторов местного и системного иммунитета и улучшению общего состояния после операции. 9 Результаты диссертационного исследования внедрены в практическую работу государственных и частных стоматологических поликлиник: Стоматологической поликлиники КГМУ, ГАУЗ МКДЦ, ООО «Алгадент», ООО «Стоматологический центр Зодиак», ООО «Палитра», ГАУЗ «Городская клиническая больница №18», АУЗ «Республиканская стоматологическая поликлиника» - г. Уфа, БУЗ УР «ДКСП№2 МЗ РТ» - г. Ижевск. Материалы диссертации используются в учебном процессе на кафедре терапевтической стоматологии ГБОУ ВПО Казанский ГМУ Минздрава России, кафедре терапевтической, детской стоматологии и ортодонтии ГБОУ ДПО «Казанская государственная медицинская академия» Минздрава России, кафедре терапевтической стоматологии с курсом ИПО ГБОУ ВПО БГМУ Минздрава России. Положения, выносимые на защиту 1. Высокий процент распространенности воспалительных заболеваний тканей пародонта у пациентов с ИБС и тенденция к усугублению тяжести данной патологии в послеоперационном периоде, обуславливает актуальность проведения лечебно-профилактических мероприятий. 2. У пациентов с выявленными воспалительными заболеваниями пародонта отмечаются различные изменения показателей клинического, микробиологического и иммунологического статуса. 3. Разработанная лечебно–профилактическая программа для лиц с заболеваниями пародонта на фоне ИБС, готовящихся к АКШ, снижает риск возникновения послеоперационных осложнений и улучшает результаты общей реабилитации. Апробация работы Материалы исследований и основные положения диссертации были доложены и обсуждены на: Всероссийской научно-практической конференции «Актуальные вопросы стоматологии», посвященной 85-летию со дня рождения профессора Г.Д. Овруцкого (Казань, 2013), посвященной 90-летию профессора 10 Леонида Менделеевича Демнера и 85-летию доцента Сании Абдрахмановны Дубивко (Казань, 2013), , Всероссийской научно-практической конференции «Профессорские чтения имени Г.Д. Овруцкого» (Казань, 2014), VI Научнопрактической конференции «Здоровье человека в XXI веке», посвященная 200летию Казанского государственного медицинского университета (Казань, 2014), ХVII межрегиональной научно-практической конференции, посвященной памяти заведующего кафедрой хирургической стоматологии и челюстно-лицевой хирургии ГБОУ ВПО «Ижевская государственная медицинская академия» Минздрава России профессора Евгения Иосифовича Дерябина, Всероссийской межвузовской применения научно-практической 3d-технологий в конференции современной «актуальные стоматологической вопросы практике», посвященная 80-летию заслуженного стоматолога РФ, доктора медицинских наук, профессора Миргазизова практической Марселя Закеевича, Всероссийской научно- конференции «Профессорские чтения имени Г.Д. Овруцкого» (Казань, 2015), VII-й Российской научно-практической конференции «Здоровье человека в XXI веке» ( Казань, 2015). По теме диссертации опубликовано 13 научных работ, в том числе 4 работы в печатных изданиях, рекомендованных ВАК Министерства образования и науки. Общий объем публикаций 6.75 у.п.л. в том числе авторский вклад 72 %. Структура и объем диссертации Текст изложен на 155 страницах машинописного текста и иллюстрирован 27 таблицами, 13 рисунками. Диссертация состоит из введения, обзора литературы, двух глав собственных исследований, главы обсуждения результатов и списка литературы, включающего 228 источников, в том числе 107 отечественных. 11 Глава 1. Аналитический обзор литературы 1.1. Этиология и патогенез пародонтита Проблема заболеваний пародонта до настоящего времени остается в центре внимания многочисленных исследований и является актуальной в стоматологии в связи с широкой распространенностью и недостаточной эффективностью проводимого лечения. По статистике ВОЗ (2010), частота поражения пародонта в разных странах мира составляет от 80до 100 %. Представляя собой важную медико-социальную проблему, распространенность хронических воспалительных заболеваний пародонта неуклонно растет не только среди лиц пожилого, но и молодого возраста [1,13, 16, 37, 46, 77, 88, 96, 105, 137, 139, 164, 184, 202, 210]. Несмотря на многочисленные исследования, представления об этиологии и патогенезе воспалительных заболеваний пародонта остаются во многом спорными и неясными. Роль определенных этиологических факторов в развитии заболеваний пародонта практически установлена, однако в отношении патогенеза до настоящего времени существуют противоречивые мнения [45, 105, 200,203]. Воспалительные заболевания пародонта имеют сложную мультифакторную основу [82]. По мнению многих исследователей, ключевую роль в этиопатогенезе заболеваний пародонта играет микробный фактор [5, 32, 96, 120, 158, 228], нарушение микроциркуляции в тканях пародонта [54, 130], интенсификация перекисного окисления липидов [87], генетическая предрасположенность [73,82, 117, 165, 206]. Современный уровень знаний патогенеза пародонтита определяет воспалительную концепцию в качестве основной как результата взаимодействия «микроорганизм-хозяин» [28, 33]. Согласно данным представлениям, такие защитные реакции организма, как фагоцитоз, иммуногенез, направленные на нейтрализацию микробного агента, сами становятся патологическими механизмами деструкции тканей пародонта [29]. Многие микробные продукты (экзо- и эндотоксины) идентифицированы как активаторы опосредованного пути 12 воздействия на макроорганизм. В литературе последних лет таким веществам микробной природы присвоено звание «модулины» [89]. Общепризнано, что ведущую роль в формировании воспалительного процесса в тканях пародонта играет анаэробная флора, а именно эндотоксины пародонтопатогенных микроорганизмов [92, 140, 214]. На современном этапе развития стоматологии получены данные о роли анаэробной и смешанной бактериальной флоры в развитии заболеваний пародонта. Они позволили выделить группу так называемых пародонтопатогенных бактерий, которые продуцируют некротизирующие ферменты (коллагеназу, эластазу, фибринолизин, гиалуронидазу и др.), экзотоксины, приводящие к нарушению целостности эпителиальных тканей, что играет основополагающую роль в генезе пародонтита [14, 170]. Представители пародонтопатогенных бактерий объединены в так называемый «красный комплекс», который включает в себя Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis, Tannerella forsythia, Treponema denticula [20, 105, 111, 118, 182]. По мнению J. Slots (2004, 2013) – одного из ведущих специалистов в области изучения проблемы воспалительных заболеваний пародонта, в патогенезе, по крайней мере, нескольких заболеваний участвует Herpes viruses, который может нарушать иммунный контроль за количественным и качественным составом резидентных микроорганизмов и участвовать в нескольких звеньях патогенеза воспалительных заболеваний пародонта: активации персистирующих вирусов, активации пародонтопатогенной микрофлоры, развитии иммунных реакций организма-хозяина [203]. В последние годы присутствие Helicobacter pylori в полости рта стали учитывать, как фактор, оказывающий влияние на развитие и течение стоматологических заболеваний [113]. Однако до сих пор в достаточной мере не установлена роль Helicobacter pylori в этиологии воспалительных процессов в пародонте, при этом персистирование Helicobacter pylori в зубо-десневом кармане составляет 16—25%, это, как правило, патогенные штаммы, сохраняющиеся после эрадикационной терапии [81]. 13 В научной литературе опубликованы доказательства того, что микроорганизмы зубного налета являются этиологическим пусковым фактором развития воспаления десны [34, 146, 202, 201]. Вместе с тем, по вопросу о роли микрофлоры зубного налета в воспалении пародонта среди специалистов единого мнения нет. Отдельные авторы считают, что некоторые микроорганизмы «зубного налета» обладают выраженной патогенностью в отношении тканей пародонта [86]. Другие полагают, что у лиц с интактным пародонтом влияния одной лишь кумуляции «зубного налета» для воспаления пародонта оказывается недостаточно [90, 197]. При заболеваниях пародонта многие потенциально патогенные микробы постоянно обнаруживаются как на здоровых, так и на пораженных участках. В большинстве случаев микрофлора зубной бляшки не способна проникать в эпителий десны и подлежащую соединительную ткань [39]. В то же время «внутриклеточные» бактерии (персистирующие в цитоплазме клеток организмахозяина микробные клетки) служат источником поддержания хронических вялотекущих воспалительных заболеваний пародонтита. Л.М. Цепов (2007) ссылается на доклад научной группы ВОЗ (Женева, 1994), в котором указывалось, что «причиной гингивитов, по-видимому, является неспецифическая бактериальная флора зубного налета», которая со временем может измениться от преимущественно грамположительной до грамотрицательной. По данным И.М. Шишкиной (2007), у людей со здоровым пародонтом частота встречаемости основных пародонтопатогенов не превышает 6,6%. В настоящее время в качестве ключевого условия для развития патологического процесса в полости рта рассматривают дисбиоз, а пародонтит многие считают микст-инфекцией, при которой «сопутствующая микрофлора» в виде ассоциации вирусно-микробных инфекций зачастую играет ведущую роль в прогрессировании патологического процесса и рефракторности к терапии [72,125]. Анализ научных данных позволил А.И. Грудянову (2009) сделать вывод об инфекционно-аллергической природе воспалительных заболеваний пародонта с 14 механизмом реализации через ассоциации пародонтопатогенной микрофлоры пародонтального комплекса. В последние годы накоплен значительный объем экспериментальных данных, позволяющих по-новому взглянуть на роль факторов врожденного и приобретенного иммунитета в развитии ответа организма человека на пародонтальную пленку как в норме, так и при патологических процессах [8, 24, 55, 58, 66, 117, 128, 150, 181, 186, 209, 223]. Имеется достаточно сведений о том, что хронический пародонтит протекает на фоне измененного иммунного статуса организма [153]. Известно, что у больных с хроническим генерализованным пародонтитом (ХГП) в тканях пародонта увеличивается численность нейтрофильных лейкоцитов, что обычно не характерно для хронического течения воспалительного процесса [124]. Несмотря на повышенное число нейтрофилов в зоне поражения при ХГП, их функциональная активность относительно невелика [138]. Согласно данным К.В. Шмагель с соавт. (2003), пародонтит чаще всего протекает на фоне снижения бактерицидного потенциала нейтрофильных лейкоцитов, поликлональной активации В-лимфоцитов, высокого уровня антибактериальных антител и нарушения функции Т-лимфоцитов. D.A. Scott и J. Krauss (2012) считают, что нейтрофилы являются ключевым защитным типом клеток в тканях пародонта. Между тем, многие стороны взаимодействия бактериальных агентов с факторами неспецифической резистентности и иммунитета остаются нераскрытыми, что требует дальнейшего изучения иммунологических аспектов возникновения и развития пародонтита. Нейтрофилы и макрофаги являются наиболее значимыми источниками медиатров воспаления [195], однако весьма существенную роль отводят цитокинам и хемокинам, которые продуцируются активированными Т- и Влимфоцитами, инфильтрованными в воспаленные ткани пародонта [45, 135, 216]. Так, одни исследователи обнаружили увеличение содержания Т-лимфоцитов в периферической крови [157], другие авторы считают характерным для пародонтита снижение их количества [141,208]. T. Nagasawa et al. (1995) описали 15 снижение содержание цитотоксических лимфоцитов при пародонтите, а G. Aren et al. (2003) сообщали о небольшом повышении содержания CD8+-клеток. В то же время M. D. Petit et al. (2001) не обнаружили значительных изменений в содержании Т-лимфоцитов (СD3+ - клетки), хелперных лимфоцитов (СD4+ клетки) и цитотоксических лимфоцитов (СD8+ - клетки) при обследовании пациентов с острым и хроническим пародонтитом. В целом большинство исследователей сходятся во мнении, что для пародонтита характерно увеличение содержания B-лимфоцитов в периферической крови [19, 148, 168, 196]. Исследование активационных маркеров у больных пародонтитом показало, что в периферической крови у них значительно увеличено количество лимфоцитов, экспрессирующих молекулы межклеточной адгезии ICAM-1 (CD54) [151,188], маркерные рецепторы активации B-лимфоцитов (CD23) [205], рецепторы к IL-2 (CD25) [188] и рецепторы поздней активации лимфоцитов (HLA-DR). Существует общее мнение, что центральное место в иммунорегуляции заболеваний пародонта занимает контроль над балансом клеток Th1 и Th2 [187]. В воспаленной десне четкое разделение Th1 и Th2 по профилю продуцируемых ими цитокинов представляет значительные трудности, однако получены сведения о том, что в инфильтратах при гингивите обычно преобладают Th1, а доля Th2 возрастает при выраженном обострении воспалительного процесса [151]. В настоящее время адаптивный иммунный ответ характеризуется четырьмя хорошо изученными направлениями дифференцировки Т-лимфоцитов: Th1, Th2, Th17, Th-reg-иммунологическая толерантность, исходя из наличия у каждого из них известного транскрипционного фактора [56]. Важно обратить внимание, что пародонтит сегодня рассматривается с позиции формирования Th17 адаптивного иммунного ответа как реакции иммунной системы на Porphyromonas gingivalis [183]. В патогенезе воспаления и резорбции кости при генерализованном пародонтите определенную роль играет также повышение продукции IL-6 и IL-8 [210], а к развитию аутоиммунных нарушений ведет хроническое угнетение 16 продукции IL-2 и IL-2R [193]. Рядом исследователей установлено, что IL-4 является противовоспалительным цитокином, который сдерживает деструктивновоспалительный процесс в пародонте. По мнению одних авторов [134, 152], содержание IL-4 в десневой жидкости, слюне и зубной бляшке у больных генерализованным пародонтитом снижается, в других же исследованиях приводятся данные о повышении концентрации IL-4 в десневой крови [68]. Лишь одиночные публикации посвящены роли IL-12 в патогенезе генерализованного пародонтита, тогда опосредованного как он иммунного является ответа ключевым и в усилении инициации клеточно- эффективной противоинфекционной защиты [190]. В меньшей мере изучена роль провоспалительного цитокина интерферона-γ (ИНФ-γ), уровень которого изменяется при хроническом воспалении. Существует мнение [220], что экспрессия его значительно выше в тканях больных с воспалительными процессами в пародонте, чем в тканях здоровых людей. Согласно данным других авторов [5], в сыворотке крови десен резко угнетена как α-, так и γ-ИНФ-продукция, что сопровождается вторичным иммунодефицитом по Т-хелперному и Т-супрессорному типу, особенно при активном течении пародонтита. В исследовании В.Н. Царева с соавт. (2012) в участках с признаками пародонтита общая концентрация цитокинов увеличивалась в результате повышения продукции ИЛ-1ß, ИЛ-6, ФНО-α, ИЛ-17А и незначительно повышения ИФН-γ, за исключением ИЛ-4 и ИЛ-8. Из полученных авторами данных следует, что изменения суммарного содержания и уровня каждого из определяемого ими цитокинов в десневой жидкости больных пародонтитом связаны, прежде всего, с нарушением функциональной активности местной иммунной системы зубодесневого прикрепления. Эти результаты согласуются с данными других авторов, так, P. M. Duarte et al. (2009) высказывают мнение, что экспрессия факторов воспаления и остеокластогенеза может играть важную роль в развитии заболеваний пародонта и влиять на степень их тяжести. 17 В патогенез острого гингивита и хронического пародонтита вносят вклад изменения состава десневой жидкости [101]. Установлено, что результаты исследования цитокинов в десневой жидкости позволяют оценить активность процессов местного воспаления и иммунных механизмов защиты, уточнить характер и степень поражения тканей пародонта [163]. Н.Н. Цыбиков с соват. (2012) выявили, что десневая жидкость, содержащая иммуноглобулины, цитокины, прокоагулянты и ингибиторы фибринолиза, у здоровых лиц способна усиливать фагоцитарную активность интактных периферических нейтрофилов. При хроническом пародонтите выявляются признаки снижения местной резистентности и повышение тромбогенного потенциала. В то же время данные литературы о сдвигах состава десневой жидкости при этих видах патологии противоречивы [133, 167]. Кроме того, некоторые компоненты десневой жидкости, способные модифицировать течение воспаления, до сих пор остаются неизвестными. В последние годы возник интерес к изучению генетических факторов риска развития воспалительных заболеваний пародонта [206]. Так, ряд исследователей обнаружили ген ICAM-1 в тканях пародонта, как здоровых, так и вовлеченных в процесс воспаления [176, 192]. Более того, была определена важная роль данного протеина в патогенезе пародонтита в качестве одного из участников неспецифического иммунного ответа: миграция лейкоцитов в воспаленные ткани пародонта происходит благодаря экспрессии ICAM-1 на поверхности эндотелиальных клеток кровеносных сосудов [163]. Результаты исследования G. Ayazi et al. (2013) показывают положительную связь между полиморфизмом гена IL-1β и риском развития пародонтита. В то же время в литературе имеются сведения, не подтверждающие данную взаимосвязь. Так, в исследовании В.А. Почтаренко с соавт. (2005) никакой связи между генетическим статусом пациента (по гену ICAM-1 в -241G/A и -469Т/С) и развитием пародонтита не выявлено. Исследование A.R. Ebadian et al. (2013) также не подтвердило роль полиморфизмов гена ФНО-α -308 и ИЛ-1β +3954 в развитии данной патологии. 18 В ряде исследований отечественных и зарубежных авторов установлены взаимосвязи между генетическим полиморфизмом популяции, наличием колонизации пародонтопатогенными видами микробов и реакцией цитокинового звена иммунитета [83,110]. Высокая концентрация противовоспалительного цитокина ИЛ-4 приводит к ингибированию активации макрофагов и переключению иммунного ответа с Th1 на Th2-тип реагирования, для которого характерна стимуляция поликлональной активации В-лимфоцитов [110, 119]. А.В. Сафонова (2012) определила генетические предикторы воспалительно- деструктивных заболеваний пародонта – полиморфные аллели генов 1b-1a, 1b-1p, 1b-6 и лактазы. Также установлено, что у лиц гомозитных по аллелю А гена 1b18(-607) и носителей аллеля С гена 1b-10(-592) происходит более интенсивное образование зубного налета, что отражается на более высоком значении индекса ОН1-5 [83]. Вместе с тем, как показывает анализ литературы, данных о роли генетических факторов в этиологии воспалительных заболеваний пародонта в мировой литературе, особенно отечественной крайне мало. Дальнейшее изучение иммунологических параметров врожденного и адаптивного иммунитета совместно с генетической опосредованностью к распознаванию микробного фактора и возможности его элиминации в качестве патогенетического звена инфекционно-воспалительных заболеваний может открыть новые представления о механизмах возникновения пародонтита. Таким образом, широкая распространенность болезней пародонта, неуклонно прогрессирующее течение процесса, а главное недостаточная эффективность терапии обусловливают проблему изучения этиологии и патогенеза пародонтита как крайне важную и значимую в медицине. 1.2. Взаимосвязь заболеваний пародонта с сердечно-сосудистыми заболеваниями Взаимосвязь патологических процессов, развивающихся в различных системах организма, остается одной из наиболее сложных и до конца не разрешенных проблем клинической медицины [51, 57, 68]. Коморбидным 19 состояниям свойственно взаимоотягощающее течение за счет наличия тесной функциональной связи между пораженными органами [9, 100]. Большинство исследователей признают тесную патогенетическую связь между воспалительными заболеваниями пародонта и соматической патологией. Сердечно-сосудистые заболевания, сахарный диабет, остеопороз, язвенная болезнь желудка дыхательных и путей двенадцатиперстной достоверно кишки, сочетаются с заболевания поражением верхних тканей пародонтального комплекса [3, 26, 144, 159, 179, 207, 217]. Ведущими факторами данной синтопии являются нарушения микробиоценоза, иммунологические и нейрорегуляторные нарушения, изменения метаболизма соединительной ткани, гемодинамики и минерального обмена, дефицит витаминов [12, 62, 145]. Сейчас основная задача для исследователей – выяснить, что вызывает одновременное возникновение заболеваний в макроорганизме и полости рта: это совпадение факторов риска или истинная причинно-следственная связь? [103, 199]. В настоящее время дискутабельным остается вопрос относительно степени взаимовлияния воспалительных заболеваний пародонта и заболеваний сердечнососудистой системы [162]. Между тем, в общей структуре сопутствующей внутренней патологии при генерализованном пародонтите заболевания сердечнососудистой системы занимают до 68% в зависимости от вида патологии: гипертоническая болезнь – 26%, ишемическая болезнь сердца (ИБС) – 10,5%, нейроциркуляторные расстройства – 68% [13, 27]. Мета-анализ исследований, изучающих взаимосвязь заболеваний пародонта с сердечно-сосудистыми заболеваниями, с очевидной ясностью демонстрирует тесную связь пародонтита с развитием ИБС и инсульта: соотношение рисков этих угрожающих жизни заболеваний у людей с пародонтитом является довольно высоким – 1,2—2,85 [36]. Важность рассматриваемой проблемы обусловлена тем, что заболевания сердечно-сосудистой системы, занимают II место в структуре заболеваемости, I место – инвалидности и смертности среди неинфекционных заболеваний (WHO, 2011). Инфицированный пародонтит повышает риск возникновения общих патологических состояний путем участия либо в патогенезе болезни, либо являясь 20 постоянным источником патогенной микрофлоры [98]. Имеется подтверждение, что воспалительные поражения тканей пародонта являются независимыми факторами риска развития ИБС [9]. Лица с тяжелым течением пародонтита имеют повышенный риск развития сердечно-сосудистых заболеваний наряду с пациентами, имеющими традиционные факторы риска, такие как пожилой возраст, мужской пол, сахарный диабет, курение и отягощенная наследственность [103]. Многочисленные исследования и данные ретроспективных наблюдений, полученных в последние биологический механизм десятилетия, развития позволили пародонтита предположить и общий сердечно-сосудистых заболеваний. В имеющихся работах продемонстрированы корреляции между плохим состоянием полости рта и риском развития инфаркта миокарда и мозгового инсульта [154, 177,178, 224]. F. De Stefano et al. (1993) отметили, что увеличение случаев смертности от сердечной недостаточности наблюдалось по мере увеличения распространенности тяжелых форм пародонтита. Пациенты с увеличением резорбции альвеолярной кости на 20% имели увеличение интенсивности хронических сердечных заболеваний на 40% (инфаркт миокарда, стенокардии). Ряд зарубежных авторов видит сходство патогенетических механизмов развития пародонтита и заболеваний сердечно-сосудистой системы в способности микроорганизмов и их эндотоксинов вызывать воспалительные реакции, гемодинамические нарушения и метаболические поражения тканей [129, 159, 179]. В атеросклеротических бляшках коронарных артерий в 83,9% случаев обнаруживаются исследования C. пародонтопатогенные Ballantyne et микроорганизмы [85]. Результаты al. (2005) позволяют предполагать, что атеросклеротические изменения сосудов имеют определенное патогенетическое значение в развитии пародонтита и наоборот. Это коррелирует с данными M. Desvarieux et al. (2004), согласно которым атеросклеротические изменения коронарных сосудов отягощают течение хронического генерализованного пародонтита, а он, в свою очередь, усугубляет тяжесть поражения сердечно- 21 сосудистой системы. Другие исследователи [171], напротив, считают заболевания пародонта всего лишь сопутствующей патологией и полагают, что причиннозависимые связи этих заболеваний следует еще доказать. В исследовании Ю.Ю. Иващенко с соавт. (2013) при проведении многомерной логистической регрессии обнаружена отчетливая взаимосвязь (р=0,04) между генерализованным перенесенным пародонтитом инфарктом – миокарда очагом и одонтогенной хроническим инфекции, оказывающим, по данным авторов, наиболее значимое и независимое влияние на тяжесть течения коронарного атеросклероза по сравнению с кариесом и зубочелюстными аномалиями. Не исключается и обратная зависимость, заключающаяся в нарастании тяжести пародонтита у больных ИБС на фоне прогрессирования атеросклеротического процесса и соответствующих циркуляторных нарушений [53, 212]. С учетом данных литературы о значимости системных воспалительных процессов в инициации и прогрессировании атеросклероза и его осложнений [177]. Ю.Ю. Иващенко с соавт. (2013) удалось оценить вклад воспалительного компонента в тяжесть течения ИБС. Оказалось, что хронический генерализованный пародонтит ассоциируется с маркерами неблагоприятного течения острого инфаркта миокарда: повышением концентраций фибриногена в сыворотке крови до 480,6±81,34 мг% и увеличением дисперсии интервала QT до 76,7 мс. Кроме того, наличие тяжелых воспалительнодеструктивных изменений в тканях пародонта ассоциировалось у больных ИБС и фибрилляцией предсердий с низким содержанием лейкоцитов в периферической крови (5,3±1,210³/мл при пародонтите тяжелой степени и 6,6 ±2.110³/мл при пародонтите легкой и средней степени тяжести), а также повышенными концентрациями IgG к Chlamydia pneumonia, что может быть следствием дисбаланса в иммунной системе у пациентов. Воспаление в тканях пародонта поддерживается микрофлорой зубной биопленки [169]. В ней О.А. Зориной (2011) по мере развития пародонтита выявлено увеличение количества Р. Gingivalis, P. Intermedia и T. forsythensis более чем в 100 раз. Пародонтопатогенная микрофлора (P. gingivalis, B. Forsythus, P. 22 Intermedia и др.) является источником эндотоксинов, которые, кроме непосредственного повреждающего действия на ткани пародонта, попадая в кровь, стимулируют повышенное производство печенью С-реактивных белков, являющихся факторами риска при сердечно-сосудистых заболеваниях [12, 116, 219]. Установлено, что степень выраженности патологических сдвигов более значима у больных с ишемической болезнью сердца, гипертонической болезнью, при вегетососудистых дистониях и дисметаболических ангиопатиях [163]. В исследовании А.В. Цимбалистова и соавт. (2011) структурно- функциональные изменения в тканях пародонта по мере прогрессирования патологии сердечно-сосудистой системы имели более выраженную воспалительную направленность и активное течение. Причем в большинстве случаев воспалительные проявления были вызваны сочетанием нескольких пародонтопатогенов в комбинации с Chlamydia trachomatis. Авторами была определена роль смешанной инфекции в этиологии хронического генерализованного пародонтита. У всех пациентов с сочетанной патологией сердечно-сосудистой системы имелась средняя или тяжелая степень поражения тканей пародонта. При этом ИБС, осложненная стенокардией напряжения II, III, IV функционального класса, и хроническая сердечная недостаточность ассоциировались с наиболее выраженным повреждением тканей пародонта, что проявилось в большем числе случаев тяжелой степени хронического генерализованного пародонтита. В других исследованиях, атривентрикулярных клапанов в материале, сердца, выделенном из биоптатов идентифицировали ДНК пародонтопатогенных бактерий B. Forsythus, A. actinomycetemcomitans, T. denticola, P. intermedia [93, 109]. При анализе стоматологического статуса больных атеросклерозом, острым инфарктом миокарда и инсультом оказалось, что распространенность и среднее число очагов одонтогенной инфекции у них выше, чем у здоровых людей того же возраста и пола [100]. Воспалительный процесс при пародонтите сопровождается развитием аутоиммунных реакций. При этом увеличивается концентрация специфических 23 IgA антител к пародонтопатогенным микроорганизмам, что может повышать риск аутоиммунных реакций по отношению к эндотелию сосудов [13]. Так, у некоторых пациентов с пародонтитом выявляются перекрестные иммунные реакции по отношению к антибактериальным антигенам, включая пародонтопатогены, и к клеткам артериальной стенки. При этом было показано, что все исследованные образцы тканей артерий вступали в перекрестные реакции с антигенами P. gingivalis. В работах H.K. Kuramitsu et al. (2001) доказано, что P. gingivalis имеет способность стимулировать оксидизацию «плохих» липидов, которые участвуют в формировании бляшек на стенках артерий. С антигенами Fusobacterium nucleatum перекрестные реакции наблюдались в 84% случаев, с Tannerella forsythia – в 48%, с C. pneumoniae – в 28%, с H. pylori – в 4%, с Haemophilus influenzae – в 4% случаев [143]. Патогенетические параллели сердечно-сосудистой патологии и пародонтита чаще преобладали при персистенции таких пародонтопатогенных микроорганизмов, как P. gingivalis, F.nucleatum и T. forsythia. По мнению K.J. Mattila et al. (2005), подобные перекрестные реакции, по-видимому, и являются механизмом, опосредующим взаимосвязь между пародонтальной инфекцией и развитием сосудистой патологии, в частности, атеросклероза. Существует также мнение, что возможная причина персистенции внутриклеточной и пародонтопатогенной персистирующей микрофлоры – это иммунодефицит, обусловленный разными причинами [166, 201]. В таком случае нарушение иммунных механизмов может косвенно влиять и на развитие и течение сердечно-сосудистой патологии [191, 194]. Высокий уровень провоспалительных цитокинов в крови также играет немаловажную роль. Эпителий десны в ответ на инвазию микрофлоры зубной бляшки выделяет медиаторы воспалительного процесса – интерлейкины (IL-1β, IL-6, IL-8), простагландины Е2, фактор некроза опухоли-альфа (TNF-α), которые свойственны как хроническому пародонтиту, так и сердечно-сосудистым заболеваниям [127, 149]. Выявлена связь IL-1β с увеличением риска возникновения пародонтита тяжелой степени и развитием атеросклеротических бляшек внутри сосудов. Уровень IL-6 также очень высок при хроническом 24 пародонтите, что приводит к стимулированию синтеза в печени фибриногена, который участвует в образовании тромба в кровеносных сосудах, заканчивающихся инфарктом миокарда и инсультом. TNF-α увеличивает синтез триглицеридов в печени, что приводит к понижению уровня липопротеинов высокой плотности, что в свою очередь напрямую связано с коронарными заболеваниями сердца [115, 144, 178, 179]. Y. Qi et al. (2013) считают, что IL23/IL-17 может играть важную роль в развитии патологий пародонтита и ИБС. Как подтверждают исследования, в атеросклеротических бляшках и некротизированных тканях миокарда при инфаркте выявлены ДНК вирусов семейства Herpesviridae, C. Pneumonie и др. [173, 189]. Между тем, в исследовании В.Н. Царева с соавт. (2010) только у одного больного с повторной операцией по поводу фистулы аортального клапана был выделен генетический материал Epstein—Barr virus и Herpes simplex virus; во всех остальных биоптатах не были выявлены ни вирусы, ни C. Pneumonie. В то же время в области пародонтальных карманов у 4 человек (27%) была выделена ДНК Epstein—Barr virus, у 3 (20%) – Human cytomegalovirus, еще у 4 пациентов (27%) – ДНК Herpes simplex virus. У 6 из 8 больных (75%) с A. actinomycetemcomitans бактериальная ДНК была выявлена в тканях клапанов, но не в содержимом пародонтальных карманов, а у 2 (25%) – и в тканях клапанного аппарата, и в пародонтальных карманах. Некоторые авторы считают, что способность этих бактерий проникать в эндотелиальные и гладкомышечные клетки коронарных артерий является связующим фактором между заболеваниями пародонта и коронарных артерий [227]. P. gingivalis выявляли в атеросклеротических бляшках сонной и каротидной артерий [91, 198]. Эти данные позволяют предположить, что P. gingivalis в атеросклеротических бляшках могут способствовать разрыву фиброзных мембран, что может быть связано с локальной индукцией P. gingivalis воспалительных цитокинов и стимуляцией протеиназ [94]. В результате проведенного В.Н. Царевым с соавт. (2010) исследования было показано, что в тканях атривентрикулярных клапанов сердца у больных с 25 активным инфекционным эндокардитом, выделенных непосредственно во время операции, выявлены ДНК четырех наиболее вирулентных видов пародонтопатогенов: A. actinomycetemcomitans, P. intermedia, B. forsythus, T. denticola, но не P. gingivalis. Однако до сих пор нет четкого представления о взаимосвязи микрофлоры полости рта с инфекцией, провоцирующей поражение клапанного аппарата сердца [172]. Наряду с исследованиями, в которых подтверждается взаимосвязь воспалительных заболеваний пародонта и ишемической болезни сердца (ИБС), атеросклероза, инсульта и других заболеваний сердечно-сосудистой системы, есть работы, в которых подвергается сомнению роль пародонтопатогенной микрофлоры в развитии патологии сердечно-сосудистой и нервной систем [108,109,126,132,144,155]. В частности, «дискутабельным и этически проблематичным» этот вопрос был назван H.P. Muller (2002). Бурные дискуссии вызвали результаты исследования A.J. Grau (2005), которыми ученый пытался подтвердить, что хронические инфекции (пародонтопатогены, C. pneumoniae и H. pylori) повышают риск развития стенокардии. А острый инфекционный процесс может являться непосредственным пусковым механизмом приступа этого заболевания. К выводу о недостаточности проведенных исследований для точного ответа на спорные вопросы пришли также F. Franceschi et al., (2005), проанализировав фундаментальную литературу, в которой приводятся сведения о взаимосвязи хронических персистирующих инфекций и ИБС. Сложность установления причинно-следственной связи между сердечнососудистыми заболеваниями и пародонтитом заключается в том, что эти заболевания имеют ряд общих аспектов. С эпидемиологической точки зрения оба заболевания являются относительно превалирующими, что затрудняет определение статистической зависимости. У данных заболеваний также есть ряд общих факторов риска, к которым относится курение, наследственность, стресс, социально-экономическое положение и старение. Матричные металлопротеазы (ММП) играют значимую роль не только в разрушении ткани пародонта, но и в развитии сердечно-сосудистых заболеваний, вызывая опасные изменения 26 миокарда. Предполагается, что подавление ММП не только предотвращает потерю периодонтального прикрепления, но и сдерживает развитие сердечных заболеваний [80]. Таким образом, анализ литературных источников подтверждает, что развитие и прогрессирование сердечно-сосудистых заболеваний связаны с хроническим воспалением тканей пародонта независимо от общих факторов риска, и в то же время современные исследования пока не представили статистически достоверных доказательств причинно-следственной связи между данными видами патологии. Для того, чтобы лучше разобраться в сложных механизмах взаимодействий между патологией пародонта и сердечно-сосудистой системы, необходимы дополнительные долгосрочные исследования. 1.3. Профилактика и лечение заболеваний пародонта у пациентов с сердечно-сосудистыми заболеваниями На сегодняшний день пока нет неоспоримых доказательств, что своевременное лечение пародонтита позволит снизить риск сердечно-сосудистых заболеваний. Но специалисты Американской академии периодонтологии (American Academy of Periodontology, AAP) уверены в том, что терапия заболеваний пародонта положительно повлияет на стоматологический статус пациента, уменьшит риск системного воспаления и тем самым окажет благотворное влияние на состояние сердца и сосудов [213]. Лица с верифицированным диагнозом пародонтита обязательно должны находиться под наблюдением врача общей практики и/или кардиолога. К сожалению, мониторинг больных с риском кардиологических осложнений в стоматологической практике не применяется, хотя важность последнего, по мнению многих оптимизировать специалистов, существующие весьма значительна стандарты терапии, [2]. Необходимо разработать новые высокотехнологичные методы лечения больных, учитывая связь пародонтита с сердечно-сосудистыми заболеваниями. 27 Известно, что лечение воспалительных заболеваний пародонта должно быть комплексным, этиопатогенетическим, последовательным [47, индивидуализированным Стоматологические 55]. и лечебно-профилактические мероприятия позволяют улучшить общее состояние полости рта, снизить риск хронического орального сепсиса и системную воспалительную нагрузку, улучшить общее здоровье, что в итоге способствует снижению риска развития сердечно-сосудистых заболеваний [37, 114]. Тактика лечения и профилактики пародонтита должна быть сфокусирована на поддержании здорового состояния ротовой полости и уменьшения массы бактериального биофильма [204]. Для этого необходимо устранение скопления бактериального налета, очагов инфекции в апикальном и маргинальном периодонте и систематические лечебно- профилактические мероприятия [102]. При лечении пациентов с инфекционно-воспалительными заболеваниями пародонта принято проводить стандартный алгоритм действий, эффективность которого доказана клиническими исследованиями [6, 35]. Этот алгоритм включает такие мероприятия, как мотивация пациента к предстоящему лечению, коррекция индивидуальной включающий гигиены медикаментозное полости лечение, рта, хирургический нормализацию окклюзии. этап, После тщательной механической обработки поверхности корня, которая в большинстве случаев улучшает клиническую картину, часто требуется местное или системное противомикробное воздействие [20, 105]. Отечественной медициной достигнуты определенные успехи в разработке принципов комплексной терапии пародонтита. Предлагается использование антибактериальных препаратов, иммуномодулирующих средств, общей дезинтоксикационной и витаминотерапии, а также локальное применение антисептических веществ, назначение различных физиотерапевтических процедур [6, 12, 15,16, 22, 35, 38]. Так, для антисептической обработки пародонтальных карманов и раневых поверхностей российские стоматологи наиболее часто используют 0,05% и 0,2% растворы хлоргексидина биглюконата, 3% раствор перекиси водорода [6, 35]. Зарубежные стоматологи используют 0,5% 28 бетадин, 0,5% хлорамин, а также 0,2% хлогексидин в виде раствора и геля [20, 136, 161]. Ассортимент антибактериальных препаратов общего действия включает в себя тетрациклины, пенициллины, нитроимидазолы, макролиды, линкозамины, хинолоны [17, 48]. Антимикробные препараты местного действия (на основе метронидазола, доксициклина, тетрациклина, миноциклина) в большинстве случаев дают положительную клиническую динамику [30, 35, 38, 40]. Однако, несмотря на доказанную клиническую эффективность, и антисептики, и антибиотики имеют ряд недостатков, которые могут выражаться как в недостаточно эффективном действии (резистентность пародонтопатогенов, формирование устойчивых штаммов микроорганизмов), так и выраженных побочных действиях [20, 136]. Современная медицинская наука уделяет все больше внимания поиску средств, действие которых может селективно подавлять размножение патогенов, свойственных конкретному заболеванию. В исследовании И.А. Горбачевой (2004) дана сравнительная оценка эффективности некоторых лекарственных препаратов, действующих на общие патогенетические факторы ассоциированных заболеваний сердечно-сосудистой системы и пародонта, и достоверно продемонстрировано содружественное клиническое улучшение течения этих заболеваний, которое развивается на фоне нормализации нарушенных показателей гомеостаза [26]. Автором показана клиническая эффективность системной полиферментной терапии (Вобэнзим); препарата лактулозы (Дюфалак), Имудона, Ронколейкина. Также установлено, что средства комплексной терапии, направленной на ключевые звенья патогенеза, объединяющего заболевания внутренних органов и пародонта (антиоксидантные витамины Е, А и С, натрия тиосульфат, минералосодержащие препараты – кламин, панангин, куриозин) способствуют нормализации различных факторов измененного гомеостазиса, что свидетельствует о сложном взаимодействии патогенетических механизмов по принципу мобилен. 29 В качестве противовоспалительных препаратов в комплексном лечении пародонтита назначают вещества, обладающие антиоксидантным действием. А. Митрониным и соавт. (2011) установлено, что применение гелей Гиалудент № 2 и Гиалудент № 3, содержащих гиалуроновую кислоту, оказывает выраженный противовоспалительный эффект на ткани пародонта и способствует восстановлению их структуры. Результаты исследования Л.Х. Болатовой (2010) подтверждают эффективность лечебного воздействия препаратов группы «Гиалудент» в сочетании с применением лазера при терапии воспалительных заболеваний пародонта. Клиническими и лабораторными исследованиями других российских ученых [17] доказана эффективность средства Фагодент на основе бактериофагов в комплексном лечении инфекционно-воспалительных заболеваний пародонта. В последние годы в комплексном лечении воспалительных заболеваний пародонта много внимания уделяется применению эубиотических препаратов, укрепляющих барьеры колонизационной резистентности организма человека. Лактобактерии с успехом применяются в комплексном лечении пародонтита у больных сахарным диабетом и с патологией сердца [19]. К стабилизирующей микрофлоре относятся также вейлонеллы, которые расселяясь по слизистой оболочке полости рта, выделяют биотические вещества, которые тормозят развитие и проявление активности гноеродной микрофлоры, вызывающей воспалительные процессы в пародонте. Некоторые исследователи считают актуальным включение в схемы лечения препаратов на основе растительных компонентов [60]. В результате проведенного исследования С.И. Гажва с соавт. (2013) установили, что применение растительных препаратов «Стоматофит», «Стоматофит А» и адгезивного бальзама «Асепта» сокращает сроки купирования воспаления. Кроме того, они являются препаратами социальной реабилитации, поскольку дезодорируют полость рта и повышают качество жизни пациентов. В настоящее компонентом время патогенетически комплексного лечения оправданным заболеваний и необходимым пародонта является 30 иммунокорригирующая терапия, позволяющая активизировать местный иммунитет, т.е. как можно эффективнее повышать способность тканей к защите от инфекции и регенерации [204]. Поиск новых иммунологических препаратов позволил обратить внимание на препарат гепон, который обладает не только иммуномодулирующими свойствами за счет изменения спектра синтезируемых клетками цитокинов, но и повышает функциональную активность фибробластов и эпителиальных клеток, что увеличивает способность эпителиальных покровов к регенерации [11]. Актуальность проблемы восстановления иммунологических нарушений организма с помощью иммуномодулирующих препаратов в настоящее время не вызывает сомнений и имеет большое практическое значение. О положительном влиянии имунофана и ликопида на клиническую ситуацию в пародонте и иммунной системе свидетельствуют исследования Е.А. Киселевой (2011). С.Л. Блашковой и Н.А. Макаровой (2010) установлена высокая клинико- иммунологическая эффективность препарата Беталейкин; И.А. Госьков с соавт. (2011) показали клиническую аминодигидрофталазина натрия эффективность (тамерит) в иммуномодулятора комплексном лечении воспалительных заболеваний тканей пародонта. Однако коррекция иммунитета при пародонтите изучена недостаточно и требует внедрения новых иммуномодулирующих препаратов. Исследования, проведенные A. Braun et al. (2008), показали значительное клиническое улучшение состояния тканей пародонта у пациентов с хроническим периодонтитом после использования фотодинамической терапии (ФДТ) по сравнению с традиционной терапией. Наряду с этим, ФДТ имеет преимущества, такие как сокращение времени обработки, целевое уничтожение бактерий, отсутствие резистентности бактерий и побочных эффектов для окружающих тканей [174]. Низкоэнергетическое лазерное излучение (10—30 мВт) при взаимодействии с живыми биотканями оказывает положительное воздействие вазодилатации кровеносных и лимфатических сосудов в участках воспаления, 31 усиленное обогащения зоны воздействия кислородом, что обусловливает его применение в терапии многих заболеваний [52,79]. Доказано, что под действием ФДТ происходит снижение уровня местных факторов воспалительной деструкции ФНО-α и IL-1β [112, 122]. Другие авторы опровергают специфическое влияние ФДТ на иммунную систему. Так, R. de Oliveira et al. (2011) изучали влияние ФДТ на цитокиновый профиль пациентов с агрессивным пародонтитом. После ФДТ отмечалось значительное снижение уровня цитокинов, но аналогичные изменения произошли и в группе пациентов, получивших традиционное консервативное лечение. N. Christodoulides et al. (2008) считают, что антимикробную ФДТ можно рассматривать только в качестве дополнительного метода к традиционной терапии пародонтита. Таким образом, фотодинамическая терапия может стать в ближайшем будущем реальной альтернативой традиционным методам антибактериального воздействия при лечении воспалительных заболеваний пародонта, хотя окончательные выводы об ее эффективности еще не сделаны [52]. На стоматологическом приеме необходимо оценивать риск для пародонтологических пациентов с диагностированной или недиагностированной соматической патологией. Важнейшую роль у таких пациентов играют оценка и контроль гигиены полости рта с включением антимикробных средств гигиены (зубной пасты, ополаскивателя для полости рта) и зубной щетки для эффективной очистки поверхности зубов с целью уменьшения образования зубного налета [75]. Необходимыми условиями эффективной терапии и профилактики воспалительных заболеваний полости рта являются нормализация естественных механизмов противомикробной защиты полости рта, ограничение условий, способствующих нарушению микробного гомеостаза и избирательному росту патогенной флоры, и использование антимикробных средств для воздействия на возбудителей стоматологических заболеваний инфекционного генеза [12]. Для устранения и предотвращения бактериального воспаления в полости рта необходимо профессиональное механическое удаление зубного налета с помощью скейлинга и очищения корней зубов в пришеечной области в 32 пародонтальных карманах [7, 29, 35]. Анализируя данные литературы [156] и собственный клинический опыт, Т.Б. Волинская (2013) сделала вывод, что на сегодняшний день невозможна любая пародонтальная терапия без применения хендибластера, и единственный порошок, который максимально удовлетворяет требованиям при лечении больных с воспалительными заболеваниями тканей пародонта, является порошок на основе глицина – Clinpro Prophy Powder. Для местного применения целесообразно использовать антимикробные препараты (типа PerioChip®, Arestin®, Artidox®), которые особенно эффективны при глубоких пародонтальных карманах (5 мм и более). Эти средства могут обеспечивать воздействие на микрофлору пародонтального кармана в течение ограниченного отрезка времени, сокращая воспалительную реакцию и обеспечивая условия для лучшего заживления. Ежедневное механическое удаление зубного налета в домашних условиях и направленная модификация состава и свойств зубной бляшки – важные составляющие комплексной терапии и профилактики воспалительных заболеваний пародонта [12]. Доказана эффективность применения анитмикробных/противовоспалительных зубных паст, содержащих триклозан с сополимером (формула 0,3% триклозан + 2,0% PVM/MA запатентована под торговой маркой Триклогард и входит в состав зубных паст Colgate®Total) для ухода за полостью рта в домашних условиях. Триклозан имеет широкий спектр антибактериальной активности; эффективен при низких концентрациях (МПК=0,5-3,0 ppm); оказывает прямое противовоспалительное действие [147]; обладает противоналетной активностью, низкой аллергенностью и не окрашивает зубную эмаль. Триклозан убивает бактерии путем нарушения процессов ферментообразования, необходимых для кислотно-жирового синтеза [126]. Кроме того, триклозан воздействует непосредственно на воспалительный процесс путем непосредственного подавления медиаторов воспаления. Сополимер удерживает триклозан в полости рта и продлевает его действие в течение 12 часов. Важно отметить, что имеются достоверные данные, подтверждающие, что длительное использование зубной пасты Colgate®Total не приводит к нарушению естественного баланса нормальной микрофлоры полости 33 рта в сторону патогенной или условно-патогенной. Ополаскиватель Colgate®Plax содержит антибактериальный компонент широкого спектра действия – цетилпиридиний хлорид, способствует удалению до 46% зубного налета и обеспечивает 12-часовую защиту от бактерий [225]; на 50% снижает образование зубного налета в труднодоступных местах и на 27% - во всей полости рта; снижает число бактерий, вызывающих гингивит и галитоз, и надолго освежает дыхание [121]; содержит источник фтора для укрепления зубов и предотвращения появления кариеса [218]. Регулярная чистка зубов – не менее двух раз в день, с использованием специально разработанной зубной щетки Colgate® 360 «Глубокая очистка» удаляют бактериальный налет на 96% эффективнее по сравнению с обычной зубной щеткой с ровной подстрижкой щетины [220]. Тяжесть осложнений, наблюдаемых после операций на открытом сердце по поводу приобретенных задуматься о пороков профилактических клапанного аппарата мероприятиях сердца, не только заставили терапевтов и кардиологов, но и стоматологов [185,226]. Значение одонтогенной инфекции в этиологии послеоперационного клапанного эндокардита равняется 25—30% [222]. Однако в отечественной и зарубежной литературе крайне недостачно освещены методы стоматологической реабилитации больных, страдающих сердечно-сосудистыми заболеваниями, перенесшими аортокоронарное шунтирование (АКШ), а также особенности стоматологической помощи больным до операций и в раннем послеоперационном периоде [23, 123]. По мнению В.С. Герез (2011), оказание помощи пациентам, перенесшим операцию АКШ, сопряжено с определенными трудностями, так как прием антикоагулянтных препаратов и антибиотикотерапия в послеоперационном периоде создают сложности в проведении стоматологических манипуляций ввиду высокого риска возникновения таких осложнений, как кровотечения, появление резистентности к антибиотикам, снижение общего и местного иммунитета, повышение уровня транзиторной бактериемии. Исследование минимальной подавляющей концентрации антибиотиков и антибактериальных химиопрепаратов in vitro к штаммам — клиническим изолятам представителей 34 пародонтопатогенных видов − позволило А.О. Акиншиной (2009) обосновать схемы применения амоксиклава, цефтриаксона и кларитромицина для проведения профилактики инфекционных осложнений при операциях на сердце и сосудах у больных хроническим генерализованным пародонтитом лѐгкой и средней степени тяжести. Помимо применения комплекса лечебных мероприятий, включающих в себя медикаментозное, механическое воздействие на ткани пародонта, необходима индивидуальная гигиена полости рта в раннем послеоперационном периоде с применением пенки для индивидуальной гигиены полости рта, ирригационной системы, электрической зубной щетки. Анализ литературы свидетельствует о том, что до сих пор не существует обобщающих представлений о проведении стоматологической реабилитации данной категории больных в раннем послеоперационном периоде. Отсутствует также единый взгляд на сроки начала стоматологической помощи и методы в ранний послеоперационный период, не определен подход к лечению и ведению данной категории больных стоматологами стационарных лечебных учреждений. Недостаточная теоретическая разработка данных вопросов, практическая необходимость проведения реабилитационных мероприятий стоматологамитерапевтами с обозначенной категорией больных определяют актуальность исследований в данном направлении. Таким образом, в связи с высокой распространенностью заболеваний пародонта и патологии сердечно-сосудистой системы необходимы углубленные научные исследования механизмов их взаимовлияния. Ситуация усугубляется тем, что в отечественной и зарубежной литературе практически отсутствуют научно обоснованные данные о возможностях комплексного подхода к системным методам лечения сердечно-сосудистых заболеваний, ассоциированных с пародонтитом, что обусловлено функциональной и производственной разобщенностью стоматологов с кардиологами. Новые научные данные могут оказать существенное влияние на развитие здравоохранения: профилактика и лечение стоматологических заболеваний может явиться действенной мерой по предупреждению или снижению риска патологии сердечно-сосудистой системы. 35 Глава 2. МАТЕРИАЛ И МЕТОДЫ 2.1. Объем и объекты исследования Работа выполнена на кафедре терапевтической стоматологии ГБОУ ВПО Казанский ГМУ Минздрава России. Согласно поставленным целям и задачам набор пациентов, забор анализов и проведение лечебно-профилактических мероприятий осуществлялся на базе кардиохирургического отделения № 1 ГАУЗ «Межрегиональный клинико-диагностический центр» больницы РТ. Лабораторные исследования показателей секреторного Ig A в смешанной слюне, иммунологическое исследование по определению в периферической крови содержания субпопуляций лимфоцитов по СД-маркерам: СДЗ+, соотношения СД4+/СД3+ и СД3+/СД8+, СД16+56+ (NK), В-лимфоциты, Fago-test (E.Coli), Burst-test (PMA), уровня сывороточных IgA, IgM, IgG проводилась на базе ГАУЗ "Республиканский центр по профилактике и борьбе со СПИД и инфекционными заболеваниями МЗ РТ". Анализ микробного содержимого проводили в ГАУЗ «Республиканская клиническая больница» МЗ РТ и иммунологической и микробиологической лаборатории ГАУЗ "Республиканский центр по профилактике и борьбе со СПИД и инфекционными заболеваниями МЗ РТ". Для решения поставленных задач нами был проведен анализ распространенности заболеваний пародонта на фоне ишемической болезни сердца перед аортокоронарным шунтированием. Объектом исследования служили 144 пациента в возрасте от 35 до 69 лет. Учитывая незначительную долю женщин среди данной категории пациентов, в исследуемую выборку нами были включены только лица мужского пола. Все пациенты были разделены на 3 группы: Первую группу (основная) составили 54 человека с выявленным на дооперационном этапе хроническим генерализованным пародонтитом легкой и средней степени тяжести. Для данной группы пациентов был разработан алгоритм 36 мероприятий с использованием индивидуальных средств гигиены полости рта с первого дня поступления в стационар до момента выписки. Во вторую группу вошли 52 пациента, также имеющие заболевания пародонта, но при этом профилактические мероприятия в этой группе не проводились. К третьей группе были отнесены 38 пациентов, которые имели здоровые ткани пародонта перед аортокоронарным шунтированием. Распределение пациентов в исследуемых группах по возрастным диапазонам представлено в таблице 1. Таблица 1 – Распределение пациентов в исследуемых группах по возрастным диапазонам Число пациентов, чел. Возраст пациентов, лет Первая группа Вторая группа Контрольная группа чел. % чел. % чел. % 35 – 39 1 1,8 1 1,9 3 7,9 40 – 44 2 3,7 1 1,9 6 15,8 45 – 49 6 11,1 4 7,7 11 28,9 50 – 54 9 16,7 11 21,2 7 18,4 55 – 59 21 38,9 20 38,5 11 28,9 60 – 64 12 22,2 14 26,9 0 0,0 65 – 69 3 5,6 1 1,9 0 0,0 ИТОГО: 54 100,0 52 100,0 38 100,0 Для всех участников исследования являлось обязательным ознакомление и подписание информированного согласия (приложение 1), одобренного локальным этическим комитетом ГБОУ ВПО Казанский ГМУ Минздрава России. Постановку диагноза проводили согласно рекомендациям ВОЗ, в соответствии с МКБ-10, на основании клинических проявлений заболевания, выявленных в результате организации диагностики с использованием клинической основных и стоматологической дополнительных методов 37 обследования. При диагностике заболеваний пародонта использовали классификацию, принятую 16-м Пленумом Всесоюзного Общества стоматологов (1983) и доработанную Российской Ассоциацией в 2001 году и МКБ- 10. Общесоматический статус больных оценивался на основании общеклинических исследований по медицинским картам стационарных обследований. Критериями исключения больных из исследования явились наличие: сахарного диабета I и II типа; гемотрансфузии; полная адентия; больные с новообразованиями в анамнезе. Всем пациентам было проведено клиническое обследование. Состояние тканей пародонта изучали с помощью стоматологических индексов: Грин Вермилиона (OHI-S), РМА, пародонтального индекса Рассела (PI), индекса кровоточивости по Muhleman H.R. (1971), подвижности зубов по шкале Miller (в модификации Fleszar 1980). У всех пациентов изучали микробиологический статус и состояние общего и местного иммунитета полости рта, высокочувствительный С реактивный белок, в смешанной слюне определяли s IgA и общий анализ крови с лейкоформулой. 2.2. Клинические методы исследования Все пациенты были обследованы по определѐнному плану с использованием специально разработанной карты (приложение 2), куда вошли общие данные пациента (ФИО, пол, возраст), анамнез развития заболевания, жалобы пациента, объективная оценка клинического состояния полости рта и тканей пародонта с использованием индексов ВОЗ — гигиенического индекса по Грин – Вермильону (OHI-S) , индекса ПМА (по Parma), позволяющего судить о тяжести заболевания и эффективности терапии, индекса кровоточивости Мюллемана, пародонтального индекса Рассела (ПИ) , свидетельствующего о тяжести-деструктивных процессов. Осмотр полости рта и исследование пародонтологического статуса проводили в первый день поступления, на 2 сутки после операции и на 22 день выписки. При клиническом обследовании выясняли жалобы пациента (на наличие кровоточивости десен, отечности десневого края, неприятного запаха изо рта, 38 зубных отложений, патологической подвижности и повышенной чувствительности зубов к температурным и химическим раздражителям, боль при приеме пищи), давность заболевания и причины его развития (время проявления первых признаков, характер заболевания: наличие рецидивов, их частота обострения и продолжительность ремиссии, проводилось ли лечение ранее и каковы были результаты), профессиональные вредности, перенесенные и сопутствующие заболевания (проводили связь системных заболеваний с болезнями пародонта), возраст, наследственность, наличии вредных привычек (курение, надкусывание предметов и т. п.), гигиенических навыках пациента. Осмотр полости рта включал в себя: измерение глубины преддверия полости рта, оценку состояния слизистых оболочек полости рта, уздечек верхней и нижней губы и языка, состояние слизистой оболочки альвеолярного отростка (окраска, консистенция, кровоточивость), наличие тяжей, травматической окклюзии, состояние прикуса, зубную формулу, состояние твердых тканей зуба, наличие кариозных полостей, качество постановки пломб, наличие имплантатов и ортопедических конструкций. Для оценки стоматологического статуса определяли уровень гиены полости рта и состояние тканей пародонта. Гигиеническое состояние полости рта определяли методом Грина Вермиллиона (OHI-S) (Simplified Oral Hygiene Index). Упрощенный индекс гигиены полости рта заключается в оценке площади поверхности зуба, покрытой налетом и/или зубным камнем. Для определения OHI-S исследовали щечную поверхность 16 и 26, губную поверхность 11 и 31, язычную поверхность 36 и 46, перемещая кончик зонда от режущего края в направлении десны. Отсутствие зубного налета обозначается как 0, зубной налет до 1/3 поверхности зуба – 1, зубной налет от 1/3 до 2/3 – 2, зубной налет покрывает более 2/3 поверхности эмали – 3. Затем по такому же принципу определяется зубной камень (таблица 2). 39 Расчет упрощенного индекса гигиены полости рта проводили по формуле (2.1): (2.1) где n – количество зубов, ЗН – зубной налет, ЗК – зубной камень. Таблица 2 – Критерии оценки метода Грина - Вермиллиона (OHI-S) Налет: Камень: 0– Нет 0– Нет 1– на 1/3 коронки 1– наддесневой камень на 1/3 коронки 2– на 2/3 коронки 2– наддесневой камень на 2/3 коронки 3– >2/3 коронки 3– наддесневой камень> поддесневой зубной 2/3 камень, коронки или окружающий пришеечную часть зуба Результаты для оценки индекса: 0 – 1,2 балл: низкий, хорошая гигиена 1,3 – 3,0 балл: средний, неудовлетворительная гигиена 3,1 – 6,0 балл: высокий, плохая гигиена Интенсивность и распространенность воспалительной реакции количественно выражают с помощью индекса РМА (Shour I., Massler М.,1947), модифицированного Parma С. в 1960 г. Для его определения йодсодержащим раствором окрашивали вестибулярную поверхность десны и определяли ее состояние у каждого зуба - в области десневого сосочка, свободной краевой (маргинальной) десны и прикрепленной (альвеолярной) десны. Воспаленные участки окрашиваются в темно-коричневый цвет. Коды для оценки степени воспаления десны: 0- отсутствие воспаления; 1- воспаление десневого сосочка; 40 2- воспаление десневого сосочка и маргинальной десны; 3- воспаление десневого сосочка, маргинальной и альвеолярной десны. Формула для расчета значения индекса (2.2) РМА = Сумма кодов / 3*количество зубов (2.2) Интерпретация значений индекса: менее 30% - легкая тяжесть воспаления; 31-60% - средняя тяжесть воспаления; 61% и более – тяжелая степень. Пародонтальный индекс Рассела (PI Russel, 1956) учитывает тяжесть гингивита, наличие пародонтальных карманов, подвижность зубов, деструкцию костной ткани. В зубной формуле напротив каждого зуба проставляют баллы (от 0 до 8), отражающие состояние тканей пародонта: 0 – воспаления десны нет; 1 – легкий гингивит, воспаление не окружает весь зуб; 2 – гингивит, воспаление окружает весь зуб, однако повреждения эпителиального прикрепления нет; 6 – гингивит с образованием пародонтального кармана, жевательная функция зуба не нарушена, зуб устойчив; 8 – выраженная деструкция тканей пародонта, жевательная функция зуба нарушена, зуб легко подвижен, может быть смещен. Состояние пародонта регистрируют возле каждого зуба (за исключением третьих моляров), ставят наивысший балл. В сомнительных случаях ставят низший балл. Расчет ПИ проводят по формуле (2.3): PI (2.3) S – сумма баллов возле каждого зуба; n – количество обследованных зубов. 41 Оценка результатов: 0,1–1,5 – начальная и I стадия заболевания, 1,5–4,0 – II стадия, 4,0 –8,0– III стадия. Индекс Мюллемана–Коуэлла (Muhlemann–Cowell) определяет степень кровоточивости десневой борозды при зондировании или при давлении на зубной сосочек. Для изучения щечной и язычной поверхности зубов использовали пуговчатый зонд или специально затупленный. Кончик зонда без давления прижимали к стенке бороздки и медленно проводили по медиальной и дистальной стороне зубов. Оценочная шкала: 0 – после исследования кровоточивость отсутствует; 1 – кровоточивость появляется не раньше, чем через 30 с; 2 – кровоточивость возникает или сразу после проведения исследования или в пределах 30 с; 3 – кровоточивость отмечается при приѐме пищи или чистке зубов. Расчет проводили по формуле (2.4) (2.4) Критерии: 0,1–1,0 – легкое воспаление, 1,1–2 – среднее воспаление, 2,1– 3 – тяжелая степень воспаления. Приведенные методы индексных оценок позволяют специалисту количественно представить определенные параметры поражения, а главное − оценить динамику заболевания пародонта, эффективность лечебных мероприятий. Индексные системы сведены и другие клинические проявления поражений пародонта, такие как подвижность зубов. 42 Подвижность зубов определяется по степени их смещения с помощью либо пинцета, либо ручек инструментов. Оценивают подвижность зубов в баллах по шкале Миллера (Miller) в модификации Флезара [Fleszar Т. J., 1980]: 0—зуб устойчивый, имеется только его физиологическая подвижность; 1— смещение зуба относительно вертикальной оси несколько больше, но не превышает 1 мм; 2— зуб смещается на 1-2 мм в щечно-язычном направлении, функция не нарушена; 3— подвижность резко выражена, при этом зуб движется не только в щечноязычном направлении, но и по вертикали, функция его нарушена. 2.3. Методы иммунологических исследований Комплексное иммунологическое обследование заключалось в определении в периферической крови содержания субпопуляций лимфоцитов по СД-маркерам: СДЗ+, соотношения СД4+/СД3+ и СД3+/СД8+, СД16+56 (NK), В – лимфоцитов (СD19+), Fago – test (E. Coli), BURST-test (PMA), содержания иммуноглобулинов основных классов - A, M, G. Определялся уровень секреторного Ig A в слюне. Клинико-лабораторное исследование проводилось до лечения, на второй день после операции и на момент выписки (22 день). Для выделения лимфоцитов брали венозную кровь в количестве не менее 5 мл с гепарином из расчета 20 БД гепарина на 1 мл крови. Для подсчета остальных параметров иммунограммы получали сыворотку из свежей венозной крови без антикоагулянта в количестве не менее 3 мл. Определение T и B лимфоцитов К клеточным элементам специфических иммунных реакций слизистой оболочки полости рта и глотки относятся Т– и В–лимфоциты. Т–лимфоциты (Т– клетки) – гетерогенная популяция белых клеток, образующихся в тимусе. В зависимости от специализации Т–лимфоциты способны или многократно усиливать местный иммунный ответ на появление антигена, или непосредственно уничтожать сам чужеродный агент. В–лимфоциты синтезируют и секретируют 43 различные классы иммуноглобулинов, но эффективны только в присутствии АПК и Т–хелперов. Некоторые Т–клетки (CD4–клетки) активируют В–лимфоциты, которые формируются в костном мозге и продуцируют антитела. Другие лимфоциты участвуют в гиперчувствительности замедленного типа. Эти клетки также подавляют активность В–лимфоцитов (Т–супрессоры или CD8). Некоторые из них способны повреждать или лизировать другие клетки, их называют цитотоксическими Т–лимфоцитами. Исследования Т–лимфоцитов и их популяций CD4 и CD8 важны в клинической практике. Так как эти клетки играют важную роль в защите организма от активации микробов, в том числе от являющихся неотъемлемой частью нормальной микрофлоры полости рта, а также условно–патогенных микробов, грибов, вирусов. Для определения лизированной субпопуляций крови использовали лимфоцитов метод человека в двухцветной цельной прямой иммунофлюоресценции. Образцы цельной крови окрашивали с помощью реагентов A, B, C, D, E, F. Разбавляли реагентом G – 1 –кратный лизирующий раствор, приготовленный из 10 –кратного раствора реагента G. Выполняли процедуру при комнатной температуре (20-25°C) с использованием реагентов комнатной температуры. Анализ клеток проводили на проточном цитометре. BURST-test (количественный анализ “респираторного взрыва лейкоцитов”). При проведении данного анализа нами производился забор крови в количестве 2 мл из кубитальной вены на гепарине (10-15 Ед на мл крови). Затем идет подготовка реагентов, fMLP and PMA – разводили 1 :200 необходимый реагент рабочим раствором WASHING SOLUTION (к 5 мкл реагента добавляли 1 мл WASHING SOLUTION). Процедура анализа: 1. Нами были подготовлены 4 пробирки FALCON на одного пациента. Каждая из пробирок была отмечена цифрой: 1 (негативный контроль), 3(низкий 44 контроль), 4 (высокий контроль) и добавляли по 100 мкл цельной крови на гепарине в каждую пробирку и помещали на 10 минут на ледяную баню. 2. Проведении активации – добавляли 20 мкл WASHING SOLUTION в пробирку 1, 20 мкл E.coli в пробирку 2, 20 мкл fMLP в пробирку 3, 20 мкл PMA в пробирку 4. Тщательно перемешивали на ледяной бане и помещали на 10 минут при 37 °C на водяную баню. 3. После 10 минут инкубации добавляли по 20 мкл субстрата (substrat disk раствор) в каждую пробирку и инкубировали 10 минут при 37 °C на водяной бане. 4. Добавляли в каждую пробирку по 2 мл рабочего раствора лизирующего реагента комнатной температуры и инкубировали 20 минут в темноте при комнатной температуре. 5. Центрофугировали 5 минут при 1500 об/мин при 4 °C и удаляли надосадочную жидкость и добавляли по 3 мл WASHING SOLUTION охлажденного до 0 °C. Затем перемешивали, центрофугировали 5 минут при 1500 об/мин при 4 °C. Удаляли надосадочную жидкость. 6. Добавляли к осадку 200 мкл DNL STAINING SOLUTION, охлажденного до 0°C, перемешивали и инкубировали при 0°C 10 минут. 7. Проводили цитометрирование в течение 30 минут. FAGO –test (E. Coli). Данный набор позволяет определить фагоцитарную активность лейкоцитов в гепаринизированной цельной крови. Он состоит из флуоресцеина (FITC) меченным опсонированных бактерии (E.coli -FITC) и необходимые реагенты. Измеряет процент моноцитов и гранулоцитов, показывающих фагоцитоз в целом (прием внутрь одного или более бактерий на клетку) и индивидуальный фагоцитарной активности (число бактерий на клетку). 45 Суть методики: 1. Реактивы 1.1 Разводили соль WASHING SOLUTION для промывочного раствора в 1000 мл дважды дистиллированной воды. Развести 10 х LYSING SOLUTION 1: 10 в дважды дистиллированной воде. 1.2 Подготовка ледяной бани. 1.3 Охлаждали бактерии (E.coli) и нейтрализующий раствор на ледяной бане. 1.4 Подогревали водяную баню до 37 ° С. 1.5 Включение и калибровка цитометра. 2. Проведение фагоцитоза 2.1 Перемешивание Гепаринизированную цельную кровь перемешивали и аликвотировали в 5 мл пробирки по 100 мкл на тест. 2.2 Активация Перемешивали предварительно охлажденную суспензию E.coli и добавляли по 20 мкл на тест к цельной крови. 2.3 Инкубация Все пробирки тщательно перемешивали. Контрольные образцы оставляли на льду. Испытуемые образцы инкубировали в течение 10 мин при 37,0 ° С на водяной бане. Время и температуру инкубации отслеживали, а водяная баня была закрыта и подогревали еѐ. 2.4 Остановка реакции По окончанию времени инкубации все образцы доставались из водяной бани и помещались на лед, с целью остановки фагоцитоза. 100 мкл охлажденного на льду QUENCHING SOLUTION добавлялись в каждый образец. 2.5 Отмывка Добавляли 3 мл WASHING SOLUTION к пробам, перемешивали, центрифугировали 5 минут при 1500 об/мин 4 ° C. 46 2.6 Образцы промывались 3 мл моющего раствора еще раз. 2.7 Лизирование и фиксация Цельную кровь лизировали и фиксировали 2 мл предварительно нагретого (комнатная температура) 1 х лизирующего раствора. Смешивали и инкубировали образцы в течение 20 мин при комнатной температуре. Центрофугирование 5 минут при 1500 об/ мин 4 ° C. 2.8 Отмывка Образцы еще раз промывали 3 мл промывочного раствора. Оценка активности NK-клеток. NK-клеток относятся к системе естественной резистентности организма, т.к. распознавание и киллинг ими клеток-мишеней не требует процессинга и презентации антигена макрофагами. NK-клеток обладают цитотоксической активностью против опухолевых клеток, они способны лизировать клетки, инфицированные внутриклеточными возбудителями, и ингибировать размножение микроорганизмов. Лабораторный метод подсчета NK-клеток основан на выявлении поверхностных дифференцированных антигенов лимфоцитов (кластеров дифференцировки) CD 16, CD56. Определение количественного состава иммуноглобулина А в сыворотки крови человека турбодиметрическим методом. Для определения содержания иммуноглобулина А (Ig A) использован метод турбодиметрического анализа. Исследуемые и контрольные образцы смешивали с буфером и антисывороткой к Ig A. В результате иммунологической реакции образуются иммунные комплексы, содержание которых зависит от концентрации Ig A в анализируемых образцах. Содержание Ig A прямо пропорционально оптической плотности исследуемых образцов при длине волны 340 нм. Для проведения анализа использовали прибор фотоэлектрокалориметр. Перед началом определения исследуемые образцы сывороток разводили в 16 раз буфером 1. Для этого брали 20 мкл образца и смешивали с 300 мкл буфера 1. Затем перемешивали содержимое пробирок и через 10 минут измеряли оптическую плотность в калибровочных и опытных пробах против холостой пробы при длине волны 340 47 нм при комнатной температуре (20-25 °C). Нормальное содержание иммуноглобулина А в сыворотке крови здорового человека от 0,9 до 2,5 мг/мл. Определение количественного состава иммуноглобулина М в сыворотки крови человека турбодиметрическим методом. Для определения содержания иммуноглобулина M (Ig М) использован метод турбодиметрического анализа. Исследуемые и контрольные образцы смешивали с буфером и антисывороткой к Ig М. В результате иммунологической реакции образуются иммунные комплексы, содержание которых зависит от концентрации Ig М в анализируемых образцах. Содержание Ig М прямо пропорционально оптической плотности исследуемых образцов при длине волны 340 нм. Для проведения анализа использовали прибор фотоэлектрокалориметр. Перед началом определения исследуемые образцы сывороток разводили в 6 раз буфером 1. Для этого брали 20 мкл образца и смешивали с 100 мкл буфера 1. Затем перемешивали содержимое пробирок и через 10 минут измеряли оптическую плотность в калибровочных и опытных пробах против холостой пробы при длине волны 340 нм при комнатной температуре (20-25 °C). Нормальное содержание иммуноглобулина M в сыворотке крови здорового человека от 0,6 до 2,8 мг/мл. Определение количественного состава иммуноглобулина G в сыворотки крови человека турбодиметрическим методом Для определения содержания иммуноглобулина G (Ig G) использован метод турбодиметрического анализа. Исследуемые и контрольные образцы смешивали с буфером и антисывороткой к Ig G. В результате иммунологической реакции образуются иммунные комплексы, содержание которых зависит от концентрации Ig G в анализируемых образцах. Содержание Ig G прямо пропорционально оптической плотности исследуемых образцов при длине волны 340 нм. Для проведения анализа использовали прибор фотоэлектрокалориметр. Перед началом определения исследуемые образцы сывороток разводили в 101 раз буфером 1. Для этого брали 20 мкл образца и смешивали с 2000 мкл буфера 1. Затем перемешивали содержимое пробирок и через 10 минут измеряли оптическую плотность в калибровочных и опытных пробах против холостой пробы при длине 48 волны 340 нм при комнатной температуре (20-25 °C). Нормальное содержание иммуноглобулина G в сыворотке крови здорового человека от 8 до 18 мг/мл. Количественное определение секреторного Ig A методом твердофазного иммуноферментного анализа (ИФА). Для изучения состояния местного иммунитета полости рта исследовали ротовую жидкость у всех исследуемых пациентов. Материалом служила не стимулированная смешанная слюна. Перед взятием материала пациенту предлагали прополоскать рот кипяченой водой комнатной температуры. Для забора материала в каждом случае использовали стерильные флаконы. Слюну подвергали центрифугированию при 3000 об/мин в течение 15 мин, после чего замораживали при температуре минус 70 градусов. Для определения секреторного Ig A использовали набор «IgA секреторный – ИФА-БЕСТ» методом твердофазного иммуноферментного анализа (ИФА). Секреторный IgA относится к маркерам местного иммунитета. Сборка секреторного иммуноглобулина происходит на базальной мембране лимфоидных и эпителиальных клеток из предшественника секреторного компонента сывороточного IgA. Изменение количества sIgA в смешанной слюне позволяет определить состояние местного иммунитета полости рта, а так же контролировать динамику лечения. Принцип метода определения основан на твердофазном иммуноферментном анализе, который проводиться в две стадии. В лунках планшета при добавлении анализируемых образцов во время первой инкубации происходит связывание sIgA с иммобилизованными моноклональными антителами к секреторному компоненту sIgA. Во время второй инкубации конъюгат моноклональных антител к α – цепи IgA с перокзидазой связывается с Образовавшиеся sIgA, иммобилизованными иммунные комплексы в ходе выявляют первой цветной инкубации. реакцией. Интенсивность окрашивания пропорциональна концентрации sIgA в смешанной слюне. После измерения величины оптической плотности раствора в лунках на 49 основании калибровочного графика определяли концентрацию sIgA в анализируемых образцах. 2.4. Определение С реактивного высокочувствительного белка С–реактивный белок (ультрачувствительный) – белок острой фазы – является показателем воспаления. С–реактивный белок синтезируется в печени в ответ на отсутствие цитокинов, таких как интерлейкин-1-альфа, интерлейкин-1-бета, интерлейкин-6 и присутствует в крови в норме практически у всех здоровых людей (около 1 мкг/мл) при отсутствии воспалительного процесса. При воспалении практически любого генеза, некротическом процессе, опухолевом росте содержание СРБ в сыворотке крови значительно увеличивается. Поэтому СРБ относят к неспецифическим показателям острой фазы. Повышение содержания СРБ является ранним признаком инфекции. Повышение содержания СРБ наиболее выражено при бактериальных инфекциях. В последнее время показана прогностическая значимость СРБ (в зависимости от его содержания в крови даже в пределах нормальных значений) в оценке риска развития сердечно–сосудистых заболеваний и связанных с ними осложнений. Также была установлена тесная связь между С–реактивным белком острой фазы сыворотки крови и тяжестью заболевания пародонта. Исследования проводилось на автоматической системе «Иммулайт 2000» производства американской компании «SIEMENS» методом ферментативноусиленной хемилюминесценции. В данной системе имеется запатентованная тестединица, позволяющая использовать уникальную технологию промывки. Тестединица, содержит шарик, покрытый антителами (антигенами), служит пробиркой, где происходит иммунологическая реакция, промывка и выработка хемилюминесцентного сигнала. Уникальность технологии промывки достигается вращением тест-единицы с высокой скоростью вокруг своей оси с одновременным добавлением промывающего раствора. Это позволяет проводить несколько промывок в течение секунд и одновременно полностью отделять несвязанный материал, который собирается в специальной камере для отходов. Ферментативно усиленная реакция хемилюминесценции, значительно 50 увеличивает нижние границы и испускает при каждом событии тысячи фотонов в ферментативно усиленной хемилюминесцентной реакции. При данном методе генерируется продолжительное свечение. Все это обеспечивает высокую чувствительность анализа. 2.5. Методы исследования микробиологического статуса Всем пациентам проводилось микробиологическое исследование, которое заключалось в проведении бактериологического посева биоматериала, выделенного из десневой борозды и содержимого пародонтальных карманов. Забор материала для исследования осуществлялся натощак на второй день после поступления в стационар, на вторые сутки после операции и на 20-22 день выписки. Перед забором из десневой борозды и пародонтального кармана пациент прополаскивал рот кипяченой водой и стерильным физиологическим раствором. Зуб, в области которого планировали проводить забор содержимого, обкладывали стерильными ватными валиками и высушивали. После забора материала штифты помещались в стерильный контейнер с транспортной средой Amies с активированным углем, обеспечивающим полное выделение аэробных и факультативно - анаэробных микроорганизмов. Биоматериал доставлялся в бактериологическую лабораторию ГАУЗ "Республиканский центр по профилактике и борьбе со СПИД и инфекционными заболеваниями МЗ РТ" в течение двух часов с момента забора. Для получения чистой культуры и количественного определения микроорганизмов производили посев на агар Шедлера фирмы BIO-RAD (Франция). Культивирование микроорганизмов проводили при температуре 37°C в течение 48 часов в термостате (рисунок 1). Для создания анаэробных условий использовались газогенерирующие пакеты (фирмы BioMerieux, Франция). Выделенные культуры идентифицировали по биохимическим показателям с помощью планшетов Lachema (Чехия) на приборе LabsystemsJems (Финляндия). Уровень обсемененности ротовой жидкости микроорганизмами определяли по числу колоний в 1 мл (КОЕ), результат выражали в логарифмических единицах (lg КОЕ/ мл). 51 Рисунок 1 - Выделенные культуры на агаре Шедлера Также нами применялся анализатор MALDI Biotyper, Bruker Daltonik (Германия) для точного подтверждения наличия анаэробных микроорганизмов (рисунок 2). Методика основана на принципах масс-спектрометрии константных белков и используется для идентификации любых МО, выращенных в лабораторных условиях. В программе содержится более чем 4 500 штаммов (2 185 видов из 364 родов) микроорганизмов всех типов — бактерий, микобактерий, грибов мицелиальных и дрожжевых, спор. Рисунок 2 – Прибор MALDI Biotyper и металлическая мишень 52 Для идентификации МО использовали минимальную колонию после первичного посева. При прямой идентификации колонию наносили на многоразовую металлическую мишень, покрывали матричным раствором и после высыхания производилась идентификация МО в масс-спектрометре по спектрам рибосомальных белков. Расшифровка одного образца занимала менее минуты и производилась в автоматическом режиме. Исследование проводилось в лаборатории клинической бактериологии ГАУЗ «Республиканская клиническая больница» МЗ РТ. 2.6. Методы исследования биохимических показателей крови Для проведения данного исследования материалом служила сыворотка крови человека. Взятие крови происходило натощак, перед проведением диагностических или лечебных процедур. Бралась в сухую, чистую пробирку (одноразовую). Использовали иглу с большим просветом. Плавно перемешивали и плотно закрывали. Для проведения данного анализа использовали гематологический анализатор, в основу которого заложен принцип проточной цитометрии. Суть метода: клеточная суспензия попадает в поток жидкости, проходящий через проточную ячейку и клетки выстраиваются друг за другом за счет гидродинамического фокусирования струи в струе. В момент пересечения клеткой лазерного луча детекторы фиксируют рассеяние света под малыми углами (от 1° до 10°) и рассеяние света под углом 90° клеток. Состав и характеристики крови определяют по трѐм параметрам: электрическому сопротивлению (метод, лежащий в основе подсчета клеток и определения их объема), ѐмкости (дают информацию об внутренней структуре клеток, плотности и размера ядра, а также позволяют определить электрическую непрозрачность и оценить сигнал проводимости) и светорассеянию (позволяет оценить рассеяние лазерного излучения неокрашенными клетками, получить информацию о гранулярности и структуре поверхности клеток, сегментированности ядер, а также позволяет классифицировать субпопуляций лейкоцитов и ретикулоцитов). 53 В результате исследования крови на гематологических анализаторах получают следующие параметры: WBC (лейкоциты), RBC (эритроциты), Hgb (гемоглобин), Hct (гематокрит), MCV (средний объем эритроцитов), Plt (тромбоциты), LY% (лимфоцит), MO% (моноцит), NE% (нейтрофилы), EO% (иозинофилы), BA% (базофилы), RET% (ретикулоциты). 2.7. Алгоритм комплексной профилактики заболеваний пародонта у пациентов с ИБС Алгоритм комплексной профилактики заболеваний пародонта у пациентов с ИБС на этапе подготовке к операции АКШ разработан с учетом выявленных изменений состояния тканей пародонта, коагуляционных свойств крови, общего и местного иммунитета, который проводился с первого дня поступления пациента в стационар до момента выписки из него. Суть методики заключалась в соблюдении определенной последовательности, в которую входила лечебнопрофилактическая зубная паста, оказывающая противовоспалительный эффект и имеющая в своем составе ферменты и термальную грязь, обладающая успокаивающим, заживляющим и восстанавливающим эффектом (рекомендовалось использовать после каждого приема пищи — 3 раза в день); ополаскиватель, который обладает противовоспалительным и антибактериальным действием, уменьшает кровоточивость и воспаление десен, оказывает обезболивающий компонент, борется с появлением неприятного запаха изо рта, предотвращает возникновение зубного налета (рекомендовано применять 2—3 раза в день в течение 20 секунд); адгезивный бальзам для дѐсен, обладающий противомикробным действием в отношении пародонтопатогенной микрофлоры и действует локализовано в ротовой полости в месте воспаления. Наносился в виде аппликаций тонким слоем на дѐсны два раза в день. Эффективность разработанного лечебно-профилактического комплекса оценивали по результатам клинических (длительность сохранения признаков воспаления, показатели OHI-S, ПМА, PI, Muhleman), а также лабораторных 54 исследований (микробный состав содержимого пародонтальных карманов, показатели местного и общего иммунитета). 2.8. Методы статистической обработки результатов Материалы исследования были подвергнуты статистической обработке с использованием методов параметрического анализа с предварительной проверкой сравниваемых совокупностей на нормальность распределения. Накопление, корректировка, систематизация исходной информации и визуализация полученных результатов осуществлялись в электронных таблицах Excel. Статистический анализ проводился с использованием программ IBM SPSS Statistics 20 и Microsoft Office Excel 2007. В случае анализа количественных показателей, полученные нами данные, исходя из принадлежности к определенной группе пациентов, объединялись в вариационные ряды, в которых проводился расчет средних арифметических величин (M), средних квадратических отклонений (σ) и средних ошибок средней арифметической (m) по стандартным формулам. Каждая из сравниваемых совокупностей оценивалась на предмет соответствия ее распределения закону нормального распределения, для этого использовался критерий Шапиро-Уилка, рекомендуемый при числе исследуемых менее 60. В случае подтвержденного нормального распределения совокупностей способом оценки статистической значимости различий между ними служил t-критерий Стьюдента. В случаях, когда распределение хотя бы одной из совокупностей не являлось нормальным, для сравнения использовались методы непараметрического анализа с применением U-критерия Манна-Уитни. При сравнении средних величин в нормально распределенных совокупностях рассчитывался t-критерий Стьюдента. Полученные значения tкритерия Стьюдента оценивались путем сравнения с критическими значениями, указанными в соответствующих справочных таблицах. Различия показателей считались статистически значимыми при уровне значимости p<0,05. 55 Для сравнения независимых совокупностей в случаях отсутствия признаков нормального распределения данных использовался U-критерий Манна-Уитни. Для этого составляли единый ранжированный ряд из обеих сопоставляемых выборок, расставив их элементы по степени нарастания признака и приписав меньшему значению меньший ранг. Затем разделяли единый ранжированный ряд на два, состоящие соответственно из единиц первой и второй выборок, в каждом из которых отдельно подсчитывали сумму рангов. Рассчитанные значения U-критерия Манна-Уитни также оценивались путем сравнения с табличными данными: в том случае, если рассчитанное значение Uкритерия Манна-Уитни было равно или меньше критического, признавалась статистическая значимость различий. Для сравнения более чем двух групп пациентов по количественным показателям применялся однофакторный дисперсионный анализ, позволяющий ответить на вопрос, оказал ли фактор существенное влияние на разброс выборочных средних или разброс является следствием случайностей, вызванных небольшими объемами выборок. В качестве статистического критерия использовался критерий Фишера. В том случае, если расчетное значение критерия Фишера F было меньше критического, определяемого по таблице, делался вывод об отсутствии статистически значимого влияния изучаемого фактора на разброс средних значений признака. В противном случае признавалось существенное влияние независимого фактора на разброс средних значений при определенном уровне статистической значимости. В случае обнаружения статистически значимых различий между группами, дополнительно проводилось парное сравнение совокупностей при помощи критерия Тьюки. При сравнении более двух зависимых совокупностей, распределение которых отличалось от нормального, использовался непараметрический критерий Фридмана. Интерпретация критерия Фридмана выполнялась путем сравнения с критическим значением: если критическое значение превышало 56 фактическое, принималась нулевая гипотеза, в обратном случае признавалась статистическая значимость различий сравниваемых совокупностей. Сравнение показателей, измеренных в номинальной шкале, проводилось при помощи критерия χ2 Пирсона, позволяющего оценить значимость различий между фактическим (выявленным в результате исследования) количеством исходов или качественных характеристик выборки, попадающих в каждую категорию, и теоретическим количеством, которое можно ожидать в изучаемых группах при справедливости нулевой гипотезы. Вначале рассчитывалось ожидаемое количество наблюдений в каждой из ячеек таблицы сопряженности при условии справедливости нулевой гипотезы об отсутствии взаимосвязи. Для этого перемножались суммы рядов и столбцов (маргинальных итогов) с последующим делением полученного произведения на общее число наблюдений. Затем значение критерия χ2 сравнивалось с критическими значениями для (r – 1) × (c – 1) числа степеней свободы по таблице. В том случае, если полученное значение критерия χ2 превышало критическое, делался вывод о наличии статистической взаимосвязи между изучаемым фактором риска и исходом при соответствующем уровне значимости. В случае анализа четырехпольных таблиц, нами рассчитывался критерий χ2 с поправкой Йейтса, позволяющей уменьшить вероятность ошибки первого типа, т.е. обнаружения различий там, где их нет (Гланц С., 1999). Поправка Йейтса заключается в вычитании 0,5 из абсолютного значения разности между фактическим и ожидаемым количеством наблюдений в каждой ячейке, что ведет к уменьшению величины критерия χ2. Для проверки значимости воздействия более двух факторов на группы в случае, если исход выражался дихотомической переменной, использовался критерий Q Кохрена. Нулевая гипотеза отклоняется, если статистика критерия Кохрена попадает в критическую область. Построение прогностической модели вероятности хронического генерализованного пародонтита выполнялось при помощи метода бинарной 57 логистической регрессии. Выбор метода обусловлен тем, что зависимая переменная является дихотомической, а независимые переменные характеризуют как качественные, так и количественные признаки, то есть могут измеряться по любой шкале. Прогностическая модель, построенная данным методом, имеет следующее математическое выражение (2.5): p 1 , 1 e z z = a0 + a1x1 + a2x2 + a3x3 + … + anxn, (2.5) где p – вероятность наличия хронического генерализованного пародонтита, x1…xn – значения факторов риска, измеренные в номинальной, порядковой или количественной шкале, a1…an – коэффициенты. Отбор независимых переменных производился методом пошаговой прямой селекции с использованием в качестве критерия исключения статистики Вальдовского. Статистическая значимость полученной модели определялась с помощью критерия χ2. Мерой определенности, указывающей на ту часть дисперсии, которая может быть объяснена с помощью логистической регрессии, в нашем исследовании служил показатель Наделькеркеса. 58 Глава 3. Результаты клинических исследований В исследовании приняли участие 144 пациента кардиохирургического отделения № 1 ГУ «Межрегиональный клинико-диагностический центр», которым была выполнена операция аортокоронарное шунтирование. Наблюдения и осмотры пациентов осуществлялись совместно с врачами кардиохирургами на протяжении всего времени нахождения в стационаре. Назначение клинических и лабораторных исследований проводилось в первый и второй день поступления в стационар пациентов, на 1-2-ые сутки в реанимации и на момент выписки из отделения на 22 день. Проведение лечебно- профилактических мероприятий в основной группе проходило на протяжении всего времени нахождения в стационаре. 3.1. Общая характеристика и анамнестические данные пациентов с ишемической болезнью сердца В начале нашего исследовании пациенты были разделены на группы. Учитывая незначительную долю женщин среди данной категории пациентов, в исследуемую выборку нами были включены только лица мужского пола. Это свидетельствует о том, что ИБС чаще встречается у мужчин, чем у женщин. По данным ряда авторов, в возрасте до 55 лет заболеваемость ИБС среди мужчин в 34 раза выше, чем у женщин (Крюков Н.Н., Поляков В.П., Николаевский Е.Н., 2010), после 75 лет заболеваемость ИБС среди мужчин и женщин одинакова. Первую группу составили 54 человека с выявленными на этапе до операции заболеваниями пародонта, которым проводились профилактические мероприятия. Возраст исследуемых в данной группе составил от 36 до 65 лет, в среднем – 56,1±0,8 лет. Во вторую группу вошли 52 пациента, также имеющие заболевания пародонта, но при этом профилактические мероприятия в этой группе не проводились. Возраст исследуемых составил от 37 до 65 лет, средний возраст – 56,4±0,7 лет. 59 Пациенты с отсутствием патологии пародонта на этапе до операции были объединены в контрольную группу. Ее численность составила 38 человек, возраст – от 39 до 58 лет, в среднем – 49,3±1,0 лет. При сравнении среднего возраста первой и второй группы нами не было выявлено статистически значимых различий (p>0,05), что позволяет сделать вывод о сопоставимости этих групп по возрасту. Структура исследуемых групп по возрасту также сопоставлена на рисунке 3. Рисунок 3 – Структура исследуемых групп по возрасту (%) Исходя из полученного распределения, в первой и второй группах преобладали пациенты в возрасте от 55 до 59 лет (38,9 и 38,5%, соответственно). В группе контроля наибольшую долю в возрастной структуре составляли пациенты как от 55 до 59 лет, так и от 45 до 49 лет (по 28,9%). Полученные нами данные согласуются с результатами Елисеевой А.Ф. (2014), которые указывают, что заболевания пародонта на фоне ишемической болезни сердца чаще встречается у мужчин в возрасте от 58 до 60 лет. Основным диагнозом у всех исследуемых была ишемическая болезнь сердца по III функциональному классу стенокардии напряжения. Часть пациентов 60 перенесла ранее инфаркт миокарда или мозговой инсульт. Распределение исследуемых по частоте острых ишемических заболеваний в анамнезе представлено в таблице 3. Таблица 3 – Частота перенесенных ранее острых ишемических заболеваний у пациентов в исследуемых группах Всего пациентов, Группа чел. Число пациентов с ОИЗ в анамнезе инфаркт миокарда мозговой инсульт чел. % чел. % Первая 54 19 35,2±6,5 5 9,3±3,9 Вторая 52 18 34,6±6,6 6 11,5±4,4 Контрольная 38 9 23,7±6,9 2 5,3±3,6 Наибольшая частота перенесенных инфарктов миокарда отмечалась среди пациентов первой группы (35,2±6,5%). Мозговые инсульты в анамнезе чаще всего наблюдались во второй группе (11,5±4,4%). При оценке различий частоты острых сосудистых катастроф в анамнезе между всеми группами, они оказались статистически не значимыми (χ2 = 1,62; p>0,05 – для инфаркта миокарда и χ2 = 1,06; p>0,05 – для мозгового инсульта). У подавляющего большинства пациентов отмечались также сопутствующие заболевания других органов. Частота сопутствующей патологии сопоставлена для исследуемых групп в таблице 4. Таблица 4 – Частота сопутствующей патологии у пациентов в исследуемых группах Вид (локализация) сопутствующих заболеваний Группа ЖКТ АГ ДС ГБС чел. % чел. % чел. % чел. % Первая 39 72,2±6,1 43 79,6±5,5 8 14,8±4,8 3 5,6±3,1 Вторая 33 63,5±6,7 41 78,8±5,7 7 13,5±4,7 4 7,7±3,7 Контроль 26 68,4±7,5 20 52,6±8,1 4 10,5±5,0 2 5,3±3,6 61 При сравнении частоты сопутствующих заболеваний ЖКТ, ДС и ГБС в анамнезе пациентов между группами статистически значимых различий не наблюдалось. Так, при сравнении частоты заболеваний ЖКТ χ2 составил 0,94 (p>0,05), заболеваний ДС – 0,36 (p>0,05), заболеваний ГБС – 0,33 (p>0,05). По частоте артериальной гипертонии отмечались статистически значимые различия между группами, характеризуемые критерием χ2 = 9,88, соответствующим уровню значимости p<0,01. Наибольший процент пациентов с артериальной гипертонией отмечался в первой группе исследуемых (79,6±5,5%), незначительно меньше – во второй (78,8±5,7%). Доля пациентов с АГ в контрольной группе составила 52,6±8,1%. Одним из распространенных местных факторов риска в этиопатогенезе воспалительных заболеваний пародонта является курение. В то же время курение — фактор риска для заболеваний периферических сосудов практически во всех тканях организма. В связи с этим, исследуемые группы были сопоставлены нами по частоте данной вредной привычки среди пациентов. В результате было получено следующее распределение (таблица 5). Таблица 5 – Сравнение частоты курильщиков среди пациентов в исследуемых группах Группа Всего Частота курильщиков в группе пациентов чел. % Первая 54 45 83,3±5,1 Вторая 52 46 88,5±4,4 Контрольная 38 22 57,9±8,0 При оценке различий частоты курильщиков между всеми исследуемыми группами, значение критерия χ2 составило 13,35, что соответствует уровню значимости p <0,01 и свидетельствует о наличии взаимосвязи критериев деления по группам и фактора курения. На втором этапе статистического анализа проводилось парное сравнение частоты курильщиков. При сравнении первой и второй групп статистически 62 значимых различий не отмечалось (χ2 = 0,23; p>0,05), что свидетельствует об их сопоставимости по данному показателю. При сравнении первой и второй групп с контрольной были получены данные о наличии статистически значимых различий (χ2 = 6,07; p <0,05 и χ2 = 9,51; p <0,01, соответственно). Следовательно, можно сделать вывод, что вредное воздействие курения наиболее ярко проявляется у пациентов, страдающих заболеваниями пародонта по сравнению с контрольной группой. При заболеваниях пародонта и наличие такой вредной привычке как курение происходят изменения в трофике тканей, которые, могут усугубить действие патогенных факторов и способствовать прогрессированию воспалительных процессов в тканях пародонта. Таким образом, в ходе нашего исследования были выявлены основные факторы риска воспалительных заболеваний пародонта среди мужчин с ИБС, находящихся на этапе подготовки к АКШ: пациенты старших возрастных групп, наличие артериальной гипертонии, ранее перенесенного ОИЗ в анамнезе и курение. Полученные данные могут служить прогностическим критерием для выявления групп с высоким риском развития заболеваний пародонта на этапе подготовке к АКШ с целью предотвращения развития осложнений в послеоперационном периоде. 3.2 Клиническая характеристика хронического генерализованного пародонтита у обследованных больных При сборе анамнеза у больных 1 и 2-ой группы выявлено, что за последние 2,5-3 года жизни за стоматологической помощью пациенты обращались лишь в экстренном порядке. При осмотре полости рта у 95 % отмечалась неудовлетворительная гигиена полости рта, 66 % больных чистили зубы 1 раз в день, 13 % больных - 2 раза в день нерегулярно и 21 % забывали почистить зубы. Пациенты 1 и 2-ой группы перед АКШ предъявляли жалобы на наличие зубных отложений (87,5%), кровоточивость десен (92,0%), неприятный запах изо рта (86,4%), отечность десны (77,7 %), потеря здоровых зубов (75,0%), обнажение шеек зубов (51,3%) и подвижность зубов (46,0%). 63 С пациентами основной группы с первого дня поступления в стационар проводились профилактические беседы о важности применения индивидуальной гигиены как метод профилактики обострений заболеваний пародонта, даны подробные рекомендации по уходу за полостью рта и был предложен разработанный алгоритм по использованию лечебно-профилактических препаратов. Пациентам 1-ой группы получили следующие средства индивидуальной гигиены: всем пациентам были выданы противовоспалительная лечебнопрофилактическая зубная паста, оказывающая противовоспалительный эффект; ополаскиватель, который обладал противовоспалительным и антибактериальным действием, (рекомендовано применять 2—3 раза в день в течение 20 секунд); адгезивный бальзам для дѐсен, обладающий противомикробным действием в отношении пародонтопатогенной микрофлоры, наносился в виде аппликаций тонким слоем на десну два раза в день. При проведении стоматологического осмотра, нами были распределены пациенты по степени тяжести хронического пародонтита (таблица 6) в первой и второй группах (в контрольную группу отбирались пациенты без заболеваний пародонта). Процесс носил только генерализованный характер. Таблица 6 – Частота пациентов с пародонтитом легкой и средней степени тяжести в первой и второй группах Группа Степень тяжести пародонтита Всего пациентов Легкая Средняя чел. % чел. % Первая 54 28 51,8±6,8 26 48,2±6,8 Вторая 52 27 51,9±6,9 25 48,1±6,9 Структура первой и второй групп по степени тяжести пародонтита также показана на рисунке 4. 64 Рисунок 4 – Структура первой и второй группы исследуемых по степени тяжести пародонтита Данный факт позволяет считать первую и вторую группы сопоставимыми по исходному состоянию пародонта, в связи с чем представляется возможным дальнейшее изучение клинических показателей у пациентов в зависимости от применения лечебно-профилактических мероприятий. Анализ структуры распространѐнности пародонтита у взрослого населения свидетельствовал о значительном росте воспалительных процессов в тканях пародонта, уровень которого увеличивался с их возрастом. Нами были изучены особенности изменений четырех клинических индексов у пациентов на разных этапах стационарного лечения в отделении кардиохирургии в зависимости от исходного состояния полости рта, а также проведения лечебно-профилактических мероприятий. При изучении особенностей гигиенического статуса пациентов (таблица 7), согласно полученным нами данным, отмечается статистически значимое увеличение индекса Грин-Вермильон в группе пациентов с заболеваниями пародонта и не прошедших профилактику (p<0,01). На всех этапах стационарного лечения средние значения индекса соответствовали низкому уровню гигиены. Практически у всех больных имелся мягкий зубной налет и твердые зубные 65 отложения. В первой группе, напротив, отмечается улучшение состояния гигиены полости рта, что подтверждается статистически значимым снижением индекса Грин-Вермильон (p<0,01). Если среднее значение индекса до операции в данной группе пациентов составило 3,47±0,05, что соответствует низкому уровню гигиены, то при свидетельствующих выписке о среднее достижении значение снизилось удовлетворительного до уровня 2,76±0,05, гигиены. Изменения индекса в контрольной группе, несмотря на наблюдаемый некоторый рост средних показателей, не являются статистически значимыми (p>0,05). На всех этапах средние значения в данной группе пациентов соответствовали удовлетворительному уровню гигиены полости рта. Таблица 7 – Сравнение значений индекса Грин-Вермильон в исследуемых группах на разных этапах стационарного лечения Группа пациентов Этапы стационарного лечения F Р 2,76±0,05 60,3 <0,01 3,51±0,03 3,58±0,03 5,0 <0,01 1,42±0,03 1,43±0,04 1,51±0,03 2,5 >0,05 875,6 815,6 548,9 <0,01 <0,01 <0,01 До После При операции операции выписке Первая 3,47±0,05 3,24±0,04 Вторая 3,44±0,03 Контрольная F Фишера Уровень значимости, p Сравнение значений при помощи критерия ДЗР Тьюки Первая-Вторая >0,05 <0,01 <0,01 Первая-Контроль <0,01 <0,01 <0,01 Вторая-Контроль <0,01 <0,01 <0,01 Графически средние уровни индекса Грин-Вермильон в исследуемых группах сопоставлены на рисунке 5. 66 Рисунок 5 – Средние уровни индекса Грин-Вермильон в исследуемых группах на разных этапах стационарного лечения При сравнении индекса Грин-Вермильон между исследуемыми группами, на всех этапах стационарного лечения были получены статистически значимые различия (p<0,01). Парные сравнения показателей при помощи критерия Тьюки позволили обнаружить некоторые закономерности. Так, исходный уровень индекса в первой и второй группе не имел статистически значимых различий (p>0,05), однако уже на этапе после операции значение индекса в группе пациентов, прошедших профилактику заболеваний пародонта, становится существенно ниже (p<0,01). На этапе выписки из стационара, разница между показателями первой и второй группы становится еще больше, продолжая оставаться статистически значимой (p<0,01). При этом на всех этапах лечения индекс Грин-Вермильон в контрольной группе принимает значения ниже, чем в группах пациентов с заболеваниями пародонта (p<0,01). Это подтверждает, что основным этиологическим фактором для пародонтита являются микроорганизмы зубного налета и показывает значимость гигиены полости рта. Проведенный анализ индекса кровоточивости Мюлеманна обнаружил (таблица 8), что в первой группе пациентов средние значения индекса кровоточивости статистически значимо снижались, составляя на этапе до операции 1,19±0,06, что соответствует стадии среднего воспаления, а при выписке 67 – 0,57±0,06, что свидетельствует о переходе на стадию легкого воспаления. У 7 пациентов из данной группы индекс кровоточивости при выписке составил 0, что является признаком полного устранения симптомов воспаления в области пародонта. Во второй группе индекс кровоточивости не имел статистически значимых различий (p>0,05), при этом его значения на всех этапах стационарного лечения соответствовали среднему уровню воспаления. В группе контроля наблюдалось статистически значимое увеличение индекса кровоточивости от момента поступления в стационар (0,0) до этапа после операции (0,17±0,02) (p<0,01). При выписке средний индекс продолжал оставаться повышенным – 0,19±0,02, что соответствует стадии легкого воспаления. Таблица 8 – Средние значение индекса кровоточивости в исследуемых группах на разных этапах стационарного лечения Группа пациентов Этапы стационарного лечения F Р 0,57±0,06 25,1 <0,01 1,17±0,05 1,19±0,05 0,2 >0,05 0,0 0,17±0,02 0,19±0,02 53,1 <0,01 140,6 86,8 92,1 <0,01 <0,01 <0,01 До После При операции операции выписке Первая 1,19±0,06 0,86±0,06 Вторая 1,15±0,05 Контрольная F Фишера Уровень значимости, p Сравнение значений при помощи критерия ДЗР Тьюки Первая-Вторая >0,05 <0,01 <0,01 Первая-Контроль <0,01 <0,01 <0,01 Вторая-Контроль <0,01 <0,01 <0,01 Средние уровни индекса кровоточивости в исследуемых группах также сопоставлены на рисунке 6. 68 Рисунок 6 – Средние уровни индекса кровоточивости в исследуемых группах на разных этапах стационарного лечения При сравнении значений индекса между группами на всех этапах стационарного лечения отмечались статистически значимые различия (p<0,01). На этапе до операции значения индекса кровоточивости в первой и второй группах оказались сопоставимыми (p>0,05), однако в обоих случаях существенно превышали среднее значение для группы контроля (p<0,01). На этапах после операции и при выписке индекс кровоточивости у пациентов первой группы, прошедших профилактику заболеваний пародонта, был статистически значимо ниже, чем у пациентов второй группы (p<0,01). Статистическая обработка показателей папиллярно-маргинально- альвеолярного индекса (РМА) показала выраженную распространенность и интенсивность патологического процесса в тканях пародонта у всех кардиологических больных (таблица 9). Изменения индекса РМА в зависимости от этапов стационарного лечения во всех исследуемых группах были статистически значимыми (p<0,01), при этом отмечались те же тенденции, что и для представленных ранее стоматологических индексов. 69 Таблица 9 – Средние значений индекса РМА (%) в исследуемых группах на разных этапах стационарного лечения Группа пациентов Этапы стационарного лечения F Р 34,8±1,5 21,9 <0,01 45,8±1,7 52,5±1,7 17,3 <0,01 0,0 19,4±1,4 20,9±1,5 94,5 <0,01 256,5 68,0 92,5 <0,01 <0,01 <0,01 До После При операции операции выписке Первая 49,8±1,7 42,4±1,6 Вторая 38,3±1,7 Контрольная F Фишера Уровень значимости, p Сравнение значений при помощи критерия ДЗР Тьюки Первая-Вторая <0,01 >0,05 <0,01 Первая-Контроль <0,01 <0,01 <0,01 Вторая-Контроль <0,01 <0,01 <0,01 Средние уровни индекса PMA в исследуемых группах также сопоставлены на рисунке 7. Рисунок 7 – Средние уровни индекса PMA в исследуемых группах на разных этапах стационарно лечения 70 Так, в группе пациентов, которым проводилась профилактика заболеваний пародонта, на протяжении всего периода стационарного лечения наблюдалось снижение средних значений индекса РМА – с 49,8±1,7 до 34,8±1,5%. Во второй группе, напротив, происходило повышение индекса от 38,3±1,7 до 52,5±1,7%. Также повышение индекса РМА отмечалось в контрольной группе: при исходном нулевом среднем уровне индекса, на этапе выписки из стационара его значение составило 20,9±1,5%. При сравнении групп на каждом этапе лечения в целом также отмечались статистически значимые различия (p<0,01). На этапе до операции наибольшее среднее значение индекса РМА – 49,8±1,7% – наблюдалось в первой группе пациентов. Среднее значение показателя во второй группе – 38,3±1,7% – было статистически значимо ниже (p<0,01). На этапе после операции средние значения индекса РМА в первой и второй группах не имели статистически значимых различий (p>0,05). При выписке средний индекс РМА в группе пациентов, не прошедших профилактику, оказался статистически значимо выше показателя первой группы (p<0,01). Индекс PI, отражающий тяжесть поражения пародонта определялся у всех пациентов (таблица 10), изменения которого также характеризовали динамику состояния пародонта на протяжении всего периода нахождения в стационаре. Таблица 10 – Средние значение индекса PI в исследуемых группах на разных этапах стационарного лечения Группа пациентов Этапы стационарного лечения F Р 2,57±0,12 12,6 <0,01 3,74±0,19 15,4 <0,01 До После При операции операции выписке Первая 3,44±0,13 3,03±0,12 Вторая 2,32±0,17 3,05±0,18 71 Продолжение таблицы 10. Контрольная 0,0 0,45±0,04 0,47±0,04 F Фишера 143,7 104,5 121,9 <0,01 <0,01 <0,01 Уровень значимости, p 62,5 <0,01 Сравнение значений при помощи критерия ДЗР Тьюки Первая-Вторая <0,01 >0,05 <0,01 Первая-Контроль <0,01 <0,01 <0,01 Вторая-Контроль <0,01 <0,01 <0,01 Средние уровни индекса PI в исследуемых группах также сопоставлены на рисунке 8. Рисунок 8 Средние уровни индекса PI в исследуемых группах на разных этапах стационарно лечения Проведенный анализ показал, что за период стационарного лечения в первой группе происходило статистически значимое снижение PI от 3,44±0,13 до 2,57±0,12 (p<0,01), в то время как во второй группе и группе контроля данный показатель увеличивался, причем изменения также были статистически значимы (p<0,01). При сравнении PI между группами на различных этапах стационарной помощи было установлено, что исходный уровень показателя в первой группе 72 был существенно выше, чем во второй (p<0,01). На этапе сразу после операции значения индекса сравнялись (p>0,05), а при выписке – PI во второй группе принимал статистически значимо более высокие значения, чем в первой группе (p<0,01). В качестве критериев степени тяжести пародонтита использовались показатели подвижности зубов и глубины пародонтального кармана. Сравнение проводилось между первой и второй группой в зависимости от этапов стационарного лечения. Распределение исследуемых в сравниваемых группах по степени подвижности зубов по шкале Miller (в модификации Fleszar, 1980) представлено в таблице 11. Таблица 11 – Распределение пациентов по степени подвижности зубов Этапы стационарного лечения Группа До операции После операции При выписке P чел. % чел. % чел. % Первая 26 48,1±6,8 26 48,1±6,8 25 46,3±6,8 >0,05 Вторая 25 48,1±6,9 25 48,1±6,9 25 48,1±6,9 >0,05 p1-2 >0,05 >0,05 >0,05 Проведенное сравнение при помощи критерия χ2 и критерия Q Кохрена не выявило статистически значимых различий по степени подвижности зубов у пациентов исследуемых групп, как при сравнении в зависимости от применения профилактических мероприятий, так и при сравнении в зависимости от этапов стационарного лечения (p>0,05). Результаты оценки глубины пародонтального кармана у исследуемых представлены в таблице 12. Согласно проведенному дисперсионному анализу, в группе пациентов, прошедших профилактику заболеваний пародонта, отмечается статистически значимое снижение глубины пародонтального кармана, в среднем от 3,4±0,1 на этапе до операции до 2,9±0,1 мм на этапе при выписке (F = 4,56; p<0,05). 73 Таблица 12 – Глубина пародонтального кармана (мм) у исследуемых в зависимости от применения профилактики и этапов лечения Этапы стационарного лечения Группа До операции После операции При выписке P min-max M±m min-max M±m min-max Первая 2,2 – 4,9 3,4±0,1 2,0 – 4,6 3,1±0,1 1,6 – 4,4 2,9±0,1 <0,05 Вторая 2,2 – 4,5 3,3±0,1 2,4 – 4,8 3,5±0,1 2,4 – 5,0 3,6±0,1 >0,05 p1-2 >0,05 <0,05 M±m <0,01 Средние значения глубины пародонтального кармана в первой и второй группах на разных этапах стационарного лечения также сопоставлены на рисунке 9. Рисунок 9 – Средние значения глубины пародонтального кармана в первой и второй группах на разных этапах стационарного лечения (мм) Во второй группе изменения глубины пародонтального кармана оказались статистически не значимыми (F = 1,76; p>0,05). При сравнении показателя между группами, на этапе до операции статистически значимых различий не наблюдалось (p>0,05). После операции и при выписке глубина пародонтального 74 кармана в первой группе оказалась ниже, чем во второй, различия показателя на данных этапах были статистически значимыми (p<0,05 и p<0,01, соответственно). Результаты изучения клинических показателей у пациентов свидетельствовали о том, что исходные значения индексов впервой и во второй группе на этапе подготовке к АКШ были сходными по сравнению с контрольной группой. Значения этих индексов нами использованы в качестве контроля эффективности лечения больных ХГП с исследуемыми препаратами. Визуально на профилактических 2 - 3-й сутки мероприятий после все начала пациенты проведения лечебно- отмечали снижение кровоточивости десен при чистке зубов, исчезновение неприятного запаха изо рта, ощущение свежести. Назначаемые препараты оказывали выраженный антибактериальный и противовоспалительный эффект на ткани пародонта, о чем свидетельствовали изменения основных показателей состояния тканей пародонта. Тогда как у больных второй и контрольной группы были выявлены изменения индексов OHI-S, РМА, PI, Muhleman H.R. в сторону нарастания воспалительных явлений. Следовательно, эффективность лечебно-профилактических мероприятий повышается при включении антибактериальных и противовоспалительных препаратов в алгоритм лечения пациентов с ИБС перед АКШ. Также полученные данные в ходе исследования свидетельствуют о тесной взаимосвязи степени тяжести патологии пародонта и наличия у больных артериальной гипертензии. Это может явиться нарушением в системе микроциркуляторного русла, влияющего на трофику тканей зубочелюстной системы, тем самым способствуя более активному протеканию патологических процессов в пародонте. Таким образом, проведенный статистический анализ изменений стоматологических индексов на этапах стационарного лечения у пациентов кардиохирургического отделения позволил выявить статистически значимое улучшение состояния пародонта у пациентов, среди которых проводились профилактические мероприятия, и, напротив, ухудшение всех показателей у 75 пациентов, не прошедших профилактику, независимо от наличия у них заболеваний пародонта до операции. Благодаря этому на этапе выписки значения всех стоматологических индексов в первой группе были статистически значимо ниже аналогичных показателей второй группы. 76 ГЛАВА 4. РЕЗУЛЬТАТЫ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ В данной главе представлены результаты лабораторных исследований. Обследовано 144 человека в состав которых входили 106 пациентов с ХГП (первая и вторая группа) и 38 человек имели интактный пародонт на этапе подготовке к АКШ. Забор биоматериала, выделенного из десневой борозды и содержимого пародонтальных карманов, периферической крови, не стимулированной смешанной слюны проводился в сроке на второй день поступления в стационар, на вторые сутки после АКШ и на момент выписки. В соответствии с поставленными задачами пациентам первой группы проводились лечебно-профилактические мероприятия на протяжении всего времени нахождения в стационаре. 4.1 Оценка микробного пейзажа ротовой полости у пациентов на разных этапах стационарного лечения пациентов кардиохирургического профиля в зависимости от проводимой профилактики заболеваний пародонта Проведенный бактериальное анализ литературы носительство в первой главе пародонтопатогенов может показывает, проникать что в эндотелиальные и гладкомышечные клетки коронарных артерий и явиться связующим фактором между заболеваниями пародонта и коронарных артерий, тем самым вызывать осложнения в послеоперационном периоде. Такие бактериальные виды, как Actinobacillus actinomycetemcommitans, Porphyromonas gingivalis, Prevotella intermedia, Tannerella forsythia и Treponema denticola представляют агрессивную часть микробиоценоза полости рта, обладают факторами вирулентности и способны оказывать отрицательное воздействие на ткани пародонта и на организм в целом. У здоровых лиц они преобладают в незначительном количестве или отсутствуют совсем. Нами был проведен сравнительный анализ обсемененности аэробной и анаэробной микрофлорой полости рта в зависимости от наличия пародонтита и проводимой профилактики заболеваний пародонта, при этом степень обсемененности определялась порядком значений содержания МО, измеренного в КОЕ на 1 г. 77 Вначале были оценены основные тенденции изменений состава микрофлоры в процессе стационарного лечения. Для этого были проанализированы уровни обсемененности микроорганизмами в контрольной группе на этапах до и после операции, и при выписке (таблица 13). Таблица 13 – Средние уровни обсемененности микрофлорой полости рта в контрольной группе на разных этапах стационарного лечения Наименование Этапы стационарного лечения ↑/↓ микроорганизма До операции После операции При выписке Candida crusei 0,8±0,1 2,5±0,3 3,6±0,4 ↑ Staphylococcus 0,9±0,1 2,2±0,3 3,2±0,4 ↑ Streptococcus mitis 0,8±0,1 1,9±0,3 2,9±0,4 ↑ Staphylococcus 0,6±0,1 1,6±0,3 2,3±0,4 ↑ 0,0 1,8±0,3 2,6±0,4 ↑ Streptococcus oralis 0,0 1,2±0,3 1,8±0,4 ↑ Neisseria sicca 0,0 1,3±0,3 2,3±0,4 ↑ Streptococcus 0,0 0,6±0,2 0,9±0,3 ↑ 0,0 1,9±0,3 2,6±0,4 ↑ Neisseria subflava 0,0 0,8±0,3 1,2±0,4 ↑ Neisseria mucosa 0,0 1,7±0,3 2,5±0,4 ↑ Lactobacillus 0,6±0,1 0,0 0,0 ↓ Corynebacterium 0,8±0,1 0,0 0,0 ↓ Streptococcus 0,6±0,1 0,0 0,0 ↓ aureus epidermides Prevotella intermedia mutans Streptococcus sanguis salivarius 78 В соответствии с полученными данными, в процессе стационарного лечения состав микрофлоры полости рта претерпевает значительные изменения. Уровень обсемененности многими микроорганизмами, в том числе Candida crusei, Staphylococcus aureus, Staphylococcus epidermides, Prevotella intermedia, Streptococcus mitis, Streptococcus oralis, Streptococcus mutans, Streptococcus sanguis, Neisseria sicca, Neisseria subflava, Neisseria mucosa, возрастает, изменения во всех случаях являются статистически значимыми (p<0,05). Другие микроорганизмы, такие как Lactobacillus, Corynebacterium, Streptococcus salivarius, напротив, выявляются только на этапе до операции. После операции и при выписке данные микроорганизмы исчезают из ротовой полости. Анализ состояния микрофлоры полости рта у пациентов с заболеваниями пародонта проводился отдельно для анаэробных и аэробных микроорганизмов. Вначале нами были рассчитаны средние значения обсемененности анаэробной микрофлорой, представленные в таблице 14. Таблица 14 – Средний уровень обсемененности анаэробной микрофлорой полости рта в зависимости от проведения профилактики Наименование Профилактика заболеваний Профилактика заболеваний микроорганизма пародонта проводилась пародонта не проводилась до после операции операции на этапе до после операции операции выписки Porphyromonas gingivalis Prevotella melaninogenica Prevotella intermedia Actinobacillus actinomycetus на этапе выписки 2,6±0,4 1,9±0,3 0,7±0,2 1,8±0,4 2,5±0,5 2,4±0,5 2,6±0,5 2,0±0,4 0,9±0,2 1,9±0,4 2,4±0,5 2,6±0,5 2,7±0,5 1,9±0,3 0,8±0,2 2,6±0,4 3,5±0,5 4,4±0,5 3,0±0,5 2,2±0,4 1,0±0,2 2,4±0,4 3,6±0,5 4,4±0,5 79 Продолжение таблицы 14. Fusobacterium nucleatum Peptostreptococcus micros Streptococcus mitis Veilonella parvula Treponema denticola 3,2±0,4 2,3±0,3 0,9±0,2 2,0±0,4 3,3±0,4 4,0±0,5 3,0±0,5 2,1±0,4 0,9±0,2 3,0±0,4 3,8±0,5 4,3±0,5 3,7±0,5 2,7±0,4 1,3±0,2 2,3±0,4 2,9±0,5 3,3±0,5 2,3±0,4 1,7±0,3 0,8±0,2 2,5±0,4 3,7±0,5 4,1±0,5 3,7±0,5 2,9±0,4 1,3±0,2 3,2±0,4 4,1±0,5 4,6±0,5 Полученные данные анализировались по двум направлениям: оценивалась, во-первых, статистическая значимость изменений содержания каждого МО на разных этапах лечения в кардиохирургическом отделении, во-вторых, значимость различий средних показателей между группами. При сравнении показателей обсемененности анаэробными МО на разных этапах стационарного лечения использовался критерий χ2 Фридмана, соответствующие уровни значимости различий, представлены в таблице 15. Согласно полученным результатам, наблюдаются статистически значимые изменения содержания пародонтопатогенной анаэробной микрофлоры в обеих исследуемых группах (p <0,01 во всех случаях). Однако направление изменений является диаметрально противоположным: в группе пациентов, у которых проводились профилактические мероприятия, отмечается снижение уровня обсемененности полости рта, в то время как во второй группе содержание МО значительно выросло. Данный факт однозначно свидетельствует об эффективности проводимой профилактики заболеваний пародонта, положительно влияющей на состояние микрофлоры. 80 Таблица 15 – Статистический анализ изменений содержания анаэробных МО в полости рта на разных этапах стационарного лечения Первая группа Наименование МО Porphyromonas gingivalis Prevotella melaninogenica Prevotella intermedia Actinobacillus actinomycetes Fusobacterium nucleatum Peptostreptococ cus micros Streptococcus mitis Veilonella parvula Treponema denticola P направление изменений Вторая группа p направление изменений <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост С целью оценки различий уровня обсемененности анаэробными МО на этапе стационарного лечения кардиохирургических пациентов в зависимости от проведения профилактики заболеваний пародонта, нами сравнивались показатели содержания МО, полученные для первой и второй группы исследуемых. Результаты сравнения приведены в таблице 16. 81 Таблица 16 – Оценка значимости различий уровней обсемененности анаэробной микрофлорой полости рта в зависимости от проведения профилактики заболеваний пародонта Наименование МО Этапы стационарного лечения до операции после операции при выписке >0,05 >0,05 <0,01 >0,05 >0,05 <0,01 Prevotella intermedia >0,05 <0,05 <0,01 Actinobacillus >0,05 <0,05 <0,01 Fusobacterium nucleatum >0,05 >0,05 <0,01 Peptostreptococcus >0,05 <0,05 <0,01 Streptococcus mitis <0,05 >0,05 <0,01 Veilonella parvula >0,05 <0,01 <0,01 Treponema denticola >0,05 <0,05 <0,01 Porphyromonas gingivalis Prevotella melaninogenica actinomycetus micros Исходя из полученных данных, важно отметить, что уровень обсемененности, измеренный при поступлении пациентов в стационар, оказался сопоставимым практически для всех пародонтопатогенных МО (p>0,05), за исключением Streptococcus mitis, содержание которого в первой группе исследуемых оказалось даже существенно более высоким, по сравнению со второй группой. Непосредственно после перевода из реанимационного отделения у пациентов, прошедших комплекс профилактических мероприятий, содержание таких МО, как Prevotella intermedia, Actinobacillus actinomycetus, Peptostreptococcus micros, Veilonella parvula и Treponema denticola снизилось до значений, статистически значимо отличающихся от показателей второй группы. 82 На этапе выписки из стационара содержание всех изучаемых анаэробных МО в первой группе оказалось существенно ниже, чем во второй, причем уровень значимости во всех случаях соответствовал p<0,01. Изменения содержания микроорганизмов, имеющих наибольшее значение в патогенезе пародонтита, в первой группе на разных этапах стационарного лечения на рисунке 10. Рисунок 10 – Изменения среднего уровня содержания пародонтопатогенных микроорганизмов на разных этапах стационарного лечения при проведении профилактики пародонтита Далее таким же образом была проанализирована динамика обсемененности полости рта аэробной микрофлорой. Полученные средние значения уровней содержания микроорганизмов на разных этапах стационарного лечения приведены в таблице 17. Согласно полученным нами данным, динамика изменений содержания аэробных микроорганизмов в полости рта имеет схожий характер с изменениями анаэробной микрофлоры. В группе пациентов, прошедших профилактику пародонтита, отмечается статистически значимое снижение уровня обсемененности аэробной микрофлорой (p<0,01 для всех микроорганизмов). Напротив, во второй группе исследуемых содержание микроорганизмов за время стационарного лечения микроорганизмов). значительно увеличивается (p<0,01) для всех 83 Таблица 17 – Средний уровень обсемененности аэробной микрофлорой полости рта в зависимости от проведения профилактики Наименование Профилактика пародонтита Профилактика пародонтита микроорганизма проводилась не проводилась до после операции операции на этапе до после операции операции выписки Candida crusei Streptococcus oralis Neisseria sicca Streptococcus mutans Streptococcus sanguis Neisseria subflava Neisseria mucosa Staphylococcus aureus Staphylococcus epidermides на этапе выписки 3,2±0,5 2,4±0,4 0,9±0,2 2,0±0,4 2,8±0,5 3,2±0,5 2,6±0,4 1,9±0,3 0,9±0,2 2,1±0,4 3,1±0,5 3,6±0,5 2,6±0,4 1,9±0,3 0,8±0,2 2,0±0,4 3,3±0,5 3,9±0,5 2,9±0,4 2,2±0,3 0,9±0,2 2,7±0,4 3,7±0,5 4,3±0,5 2,4±0,5 1,7±0,4 0,9±0,2 2,5±0,4 3,3±0,5 3,7±0,5 2,8±0,5 2,2±0,4 1,0±0,2 3,2±0,4 4,0±0,5 4,5±0,5 3,0±0,5 2,3±0,4 1,1±0,2 2,4±0,4 3,1±0,5 3,5±0,5 2,7±0,4 2,0±0,3 0,9±0,2 2,1±0,4 2,6±0,5 3,0±0,5 3,6±0,4 2,6±0,3 1,2±0,2 2,9±0,4 3,9±0,5 4,3±0,5 Результаты оценки статистической значимости изменений обсемененности аэробной микрофлорой полости рта на протяжении всего периода стационарного лечения приведены в таблице 18. 84 Таблица 18 – Статистический анализ изменений содержания анаэробных МО в полости рта на разных этапах стационарного лечения Наименование Первая группа направление Вторая группа направление МО P Candida crusei <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост <0,01 Снижение <0,01 Рост Streptococcus oralis Neisseria sicca Streptococcus mutans Streptococcus sanguis Neisseria subflava Neisseria mucosa Staphylococcus aureus Staphylococcus epidermides изменений P изменений Нами также было проведено сравнение средних уровней обсемененности аэробной микрофлорой между группами. Результаты анализа представлены в таблице 19. Проведенный анализ показал, что при исходном равном уровне обсемененности аэробной микрофлоры в ротовой полости (за исключением Cand. Crusei), на этапах после операции и при выписке пациентов количество микроорганизмов в первой группе становится статистически значимо ниже, чем в группе пациентов, не прошедших профилактику. 85 Таблица 19 – Результаты сравнения средних уровней обсемененности аэробными микроорганизмами между первой и второй группами Наименование МО Этапы стационарного лечения до операции после операции при выписке Candida crusei <0,05 >0,05 <0,01 Streptococcus oralis >0,05 >0,05 <0,01 Neisseria sicca >0,05 <0,05 <0,01 Streptococcus mutans >0,05 <0,05 <0,01 Streptococcus sanguis >0,05 <0,05 <0,01 Neisseria subflava >0,05 <0,01 <0,01 Neisseria mucosa >0,05 >0,05 <0,01 Staphylococcus aureus >0,05 >0,05 <0,01 Staphylococcus >0,05 <0,05 <0,01 epidermides В первую очередь, после операции, различия становятся значимыми для Streptococcus oralis, Neisseria sicca, Streptococcus mutans, Streptococcus sanguis, Neisseria subflava (p<0,05). К моменту выписки из стационара существенно более низкими в первой группе становятся уровни всех изучаемых микроогранизмов, значимость различий соответствовала вероятности ошибки p<0,01. Вышеперечисленные неблагоприятную признаки ситуацию в плане можно охарактеризовать отягощения как пародонтопатогенной микрофлоры как одного из факторов риска не только развития, но и отягощения форм хронического пародонтита. Поэтому в нашем алгоритме подготовки больных перед АКШ на проводилась микробиологическая диагностика с целью подбора индивидуальной местной противомикробной терапии, основной задачей которой является снижение вирулентности ротовой микрофлоры, особенно пародонтальных карманов или десневого желобка. - микрофлоры 86 Таким образом, нами был установлен факт статистически значимого снижения уровня обсемененности как анаэробной, так и аэробной пародонтопатогенной микрофлорой полости рта у пациентов, прошедших профилактику заболеваний пародонта, по сравнению с пациентами, где профилактические мероприятия не проводились. 4.2 Оценка иммунологических показателей у исследуемых на разных этапах стационарного лечения в зависимости от проведения профилактики Нами были проанализированы данные иммунограмм пациентов, полученные на различных этапах стационарного лечения. На первом этапе, с целью определения основных тенденций, были оценены изменения иммунологических показателей на протяжении стационарного лечения у пациентов контрольной группы. Полученные сведения были объединены в таблице 20. Оценка различий показателей на трех этапах стационарного лечения при помощи дисперсионного анализа показала, что изменения всех показателей являются статистически значимыми (p<0,05). Парные сравнения иммунологических данных по методу Тьюки позволили установить направление и значимость изменений на каждом этапе лечения. Так, после операции у пациентов контрольной группы наблюдается статистически значимое снижение содержания T-лимфоцитов в крови и всех анализируемых видов иммуноглобулинов в сыворотке, а также индексов CD4+ / CD3+ и CD3+ / CD8+. Таблица 20 – Динамика иммунологических показателей у пациентов контрольной группы на разных этапах стационарного лечения, % Средние значения показателя на разных Показатель T-лимф. (CD3+) этапах стационарного лечения 1. До 2. После 3. При операции операции выписке 72,8±0,6 70,3±0,5 70,0±0,5 p1-2 p2-3 <0,01 >0,05 87 Продолжение таблицы 20. CD4+ / CD3+ 45,8±0,5 40,6±0,5 43,8±0,4 <0,01 <0,01 CD3+ / CD8+ 28,8±0,4 22,2±0,3 23,7±0,3 <0,01 <0,05 14,4±0,4 22,6±0,4 21,0±0,4 <0,01 <0,05 11,2±0,3 17,4±0,2 15,9±0,2 <0,01 <0,01 Фаго-тест 96,5±0,2 99,1±0,2 98,9±0,2 <0,01 >0,05 Burst-тест 99,3±0,1 99,5±0,1 99,5±0,1 >0,05 >0,05 IgA сыв., г/л 2,92±0,03 2,14±0,04 2,16±0,04 <0,01 >0,05 IgG сыв., г/л 10,5±0,3 7,8±0,1 8,1±0,2 <0,01 >0,05 IgM сыв., г/л 1,96±0,06 1,42±0,01 1,43±0,01 <0,01 >0,05 CРБ, мг/л 3,9±0,1 112,4±2,4 22,3±0,9 <0,01 <0,01 NK-клетки (CD16+56) B-лимф. (CD19+) Одновременно увеличивается число NK-клеток и B-лимфоцитов, результаты фаготеста и содержание С-реактивного белка. Во всех случаях уровень значимости соответствовал вероятности ошибки p<0,01. При выписке у исследуемых увеличивались значения индексов CD4+ / CD3+ и CD3+ / CD8+ (p<0,01 и p<0,05, соответственно), уменьшалось содержание NK-клеток (p<0,05), В-лимфоцитов (p<0,01) и С-реактивного белка (p<0,01). Дальнейший анализ иммунологического статуса пациентов заключался в сравнении показателей первой и второй группы на разных этапах стационарного лечения. В целях сохранения последовательности описания результатов статистическая обработка проводилась по группам показателей. Данные о среднем содержании лимфоцитов представлены в таблице 21. Проведенный статистический анализ выявил следующие закономерности. Исходные иммунологические показатели на этапе до операции не имели статистически значимых различий (p>0,05), за исключением индекса CD3+/CD8+, среднее значение которого было выше в первой группе (p<0,05). 88 Таблица 21 – Средние значения иммунологических показателей у пациентов с пародонтитом на разных этапах стационарного лечения, % Этап лечения Показатель До операции Средние значения показателя Р Первая группа Вторая группа T-лимф. (CD3+) 61,4±0,4 61,0±0,4 >0,05 CD4+ / CD3+ 37,6±0,3 38,0±0,3 >0,05 CD3+ / CD8+ 22,7±0,3 21,4±0,3 <0,05 NK-клетки 19,2±0,3 19,5±0,3 >0,05 B-лимф. (CD19+) 6,7±0,2 6,6±0,2 >0,05 Фаготест 97,9±0,2 98,3±0,2 >0,05 Burst-тест 98,1±0,2 98,1±0,2 >0,05 IgA сыв., г/л 1,28±0,01 1,25±0,01 >0,05 IgG сыв., г/л 15,8±0,1 16,0±0,1 >0,05 IgM сыв., г/л 2,70±0,01 2,71±0,01 >0,05 СРБ, мг/л 5,5±0,1 5,6±0,1 >0,05 После T-лимф. (CD3+) 62,1±0,4 59,5±0,4 <0,01 операции CD4+ / CD3+ 34,6±0,3 35,3±0,2 <0,05 CD3+ / CD8+ 20,0±0,2 19,4±0,2 <0,05 NK-клетки 23,9±0,2 26,3±0,2 <0,01 B-лимф. (CD19+) 16,9±0,2 17,0±0,2 >0,05 Фаготест 102,7±0,3 103,4±0,3 >0,05 Burst-тест 99,0±0,1 99,0±0,1 >0,05 IgA сыв., г/л 1,25±0,01 1,02±0,02 <0,01 IgG сыв., г/л 8,3±0,2 10,3±0,2 <0,01 IgM сыв., г/л 1,90±0,02 1,56±0,02 <0,01 СРБ, мг/л 198,2±4,1 189,7±3,7 >0,05 (CD16+56) (CD16+56) 89 Продолжение таблицы 21. T-лимф. (CD3+) 64,5±0,3 58,3±0,3 <0,01 CD4+ / CD3+ 44,8±0,5 40,8±0,3 <0,01 CD3+ / CD8+ 21,8±0,2 21,1±0,2 <0,05 NK-клетки 20,8±0,2 24,1±0,2 <0,01 B-лимф. (CD19+) 11,7±0,2 16,0±0,2 <0,01 Фаготест 97,7±0,1 102,6±0,3 <0,01 Burst-тест 99,5±0,1 99,4±0,1 >0,05 IgA сыв., г/л 2,64±0,05 1,05±0,01 <0,01 IgG сыв., г/л 12,0±0,2 11,3±0,2 <0,05 IgM сыв., г/л 2,48±0,01 1,87±0,02 <0,01 СРБ, мг/л 31,4±1,3 51,2±1,2 <0,01 (CD16+56) При выписке После операции в первой группе содержание Т-лимфоцитов и индекс CD3+/CD8+ оказались более высокими, чем во второй группе (p<0,01 и p<0,05, соответственно), а содержание NK-клеток и среднее значение индекса CD4+/CD3+ – напротив, ниже (p<0,01; p<0,05, соответственно). При выписке имеющиеся различия еще более увеличились: содержание Т-лимфоцитов и средние значения обоих индексов были более высокими (p<0,01; p<0,01; p<0,05, соответственно), а количество NK-клеток и В-лимфоцитов – более низкими, чем в первой группе (p<0,01). Согласно полученным результатам, на этапах как до, так и после операции, различия результатов фаготеста и burst-теста (таблица 21) являются статистически не значимыми (p<0,05). При выписке значения фаготеста в первой группе оказались ниже, чем во второй группе, различия статистически значимы (p<0,01). Значения burst-теста при выписке остались сопоставимыми (p>0,05). В ходе исследования, нами были проанализированы различия содержания иммуноглобулинов и СРБ в сыворотке крови между группами (таблица 21). Исходя из полученных данных, содержание всех изучаемых белков в сыворотке 90 крови на начальном этапе не имело статистически значимых различий между группами (p>0,05). После операции содержание иммуноглобулинов снизилось в обеих группах, в отношении IgA и IgM динамика была более выражена во второй группе, в связи с чем их количество оказалось статистически значимо ниже, чем в первой группе (p<0,01). Содержание СРБ значительно выросло после операции – с 5,5-5,6 до 189-198 мг/л в обеих группах. Рост показателя происходил равномерно, независимо от применения профилактических мероприятий, поэтому различия между группами на данном этапе явились статистически не значимыми (p>0,05). При выписке пациентов из стационара, содержание всех иммуноглобулинов было статистически значимо выше в первой группе (p<0,05), а СРБ – во второй группе (p<0,01). Нами была проведена оценка изменений содержания секреторного иммуноглобулина А в слюне в процессе стационарного лечения. Вначале были изучены изменения данного показателя в контрольной группе. Полученные данные представлены в таблице 22. Согласно результатам анализа, в процессе стационарного лечения пациентов без признаков заболеваний пародонта отмечается повышение уровня секреторного IgA. Изменения показателя являются статистически значимыми (F = 184,0; p<0,01). При использовании апостериорного анализа с помощью критерия Тьюки были получены данные о наличии статистически значимых различий как при сравнении уровней секреторного IgA до и после операции (p<0,01), так и при сравнении показателей после операции и на этапе выписки (p<0,01). Таблица 22 – Оценка изменений уровня секреторного IgA в процессе стационарного лечения в контрольной группе, мг/мл Этап лечения Уровень секреторного IgA min – max M±m До операции 196,4 – 266,0 231,6±4,3 После операции 289,0 – 345,0 308,7±3,1 При выписке 301,0 – 378,1 349,8±5,5 91 Далее были проанализированы изменения содержания секреторного IgA у пациентов с заболеваниями пародонта в зависимости от применения профилактических мероприятий. Полученные значения показателя приведены в таблице 23. Таблица 23 – Оценка изменений уровня секреторного IgA в процессе стационарного лечения в зависимости от применения профилактики, мг/мл Этап лечения Средние значения показателя Р Первая группа Вторая группа До операции 443,0±10,5 439,7±15,6 >0,05 После операции 313,6±4,6 494,7±15,5 <0,01 При выписке 228,0±5,3 518,6±13,9 <0,01 Критерий F Фишера 348,4 7,3 - Уровень значимости, p <0,01 <0,01 - Исходя из полученных данных, исходное содержание секреторного IgA в слюне пациентов обеих групп не имело существенных различий (p>0,05). Однако на этапе после операции в первой группе произошло статистически значимое снижение показателя (p<0,01), в то время как во второй группе – его повышение (p<0,01). В результате содержание секреторного IgA оказалось статистически значимо ниже в группе пациентов, прошедших профилактику заболеваний пародонта (p<0,01). При выписке пациентов из стационара, содержание секреторного IgA в первой группе снизилось еще сильнее, а во второй группе продолжало расти, что привело к еще большему увеличению диапазона между средними значениями показателя в сравниваемых группах (p<0,01). Динамика уровня секреторного IgA во всех трех исследуемых группах представлена на рисунке 11. Исходя из приведенного рисунка следует, что на этапе после операции и при выписке уровень секреторного IgA во второй группе исследуемых, значительно превышает показатель для двух других групп. Наименьшим при выписке является уровень секреторного IgA в группе пациентов, прошедших профилактические мероприятия. 92 Рисунок 11 – Динамика содержания секреторного IgA в слюне пациентов в исследуемых группах на разных этапах стационарного лечения, мг/мл 4.3 Оценка клеточного состава крови у исследуемых на разных этапах стационарного лечения в зависимости от проведения профилактики Еще одной группой показателей, сравниваемых между группами, явились данные о клеточном составе крови. Вначале было изучено содержание лейкоцитов, сведения о среднем количестве которых по группам приведены в таблице 24. Таблица 24 – Среднее количество лейкоцитов (109 л-1) в крови исследуемых на разных этапах стационарного лечения Этапы стационарного лечения Группа Первая До операции После операции При выписке min-max M±m min-max M±m min-max 3,7-19,1 8,4±0,4 8,0-19,7 12,8±0, 6,1-16,8 M±m 10,4±0, <0,01 5 Вторая 3,8-18,5 9,0±0,4 8,2-19,5 13,0±0, 3 6,3-16,7 10,3±0, <0,01 4 Контроль 3,7-16,1 7,6±0,5 7,9-19,8 12,2±0, 3 5,5-18,8 10,1±0, <0,01 5 p1-2 >0,05 >0,05 P 4 >0,05 93 Сравнение среднего содержания лейкоцитов в крови исследуемых на разных этапах стационарного лечения приведено на рисунке 12. Рисунок 12 – Средние уровни содержания лейкоцитов в периферической крови пациентов исследуемых групп на разных этапах лечения (109 л-1) Проведенный статистический анализ показал, что на всех этапах стационарного лечения статистически значимые различия при сравнении групп между собой – отсутствуют (p>0,05). Это свидетельствует об общности тенденций изменений содержания лейкоцитов в периферической крови, мало зависящих от состояния пародонта. Вместе с тем, нами зафиксированы основные особенности динамики количества лейкоцитов в крови на протяжении стационарного лечения. При исходном нормальном уровне лейкоцитов, на этапе после операции происходит статистически значимое увеличение их количества (p<0,01), в среднем – до 12,213,0*109 л-1. К выписке из стационара данный показатель снижается до 10,110,4*109 л-1, изменения статистически значимы (p<0,01). Нами также была проведена оценка изменений лейкоформулы в исследуемых группах на протяжении стационарного лечения. Вначале, как и при исследовании иммунограммы, нами была проанализирована динамика 94 показателей в контрольной группе. В результате статистической обработки было получено следующее распределение (таблица 25). Таблица 25 – Средние показатели состава лейкоформулы в контрольной группе на разных этапах стационарного лечения, % Среднее содержание клеток (%) на разных Вид этапах стационарного лечения p1-2 p2-3 56,9±1,3 <0,01 <0,01 14,7±1,0 29,1±0,7 <0,01 <0,01 5,7±0,3 9,6±0,4 7,9±0,3 <0,01 <0,01 Базофилы 0,65±0,03 0,54±0,04 0,71±0,04 <0,05 <0,01 Эозинофилы 2,14±0,1 0,87±0,03 3,15±0,09 <0,01 <0,01 лейкоцитов 1. До 2. После 3. При операции операции выписке Нейтрофилы 55,5±1,3 73,0±1,5 Лимфоциты 27,2±0,8 Моноциты Изменения содержания отдельных видов лейкоцитов на каждом этапе стационарного лечения являются статистически значимыми (p<0,05). После операции наблюдается увеличение содержания нейтрофилов в лейкоформуле до 73,0±1,5% и моноцитов до 9,6±0,4%, при этом доля остальных клеток пропорционально снижается. При выписке количество нейтрофилов возвращается к нормальным значениям, снижается доля моноцитов, параллельно повышается до нормальных значений содержание лимфоцитов и других клеток. Описанные изменения представлены на рисунке 13. На следующем этапе была проанализирована динамика изменений состава лейкоформулы в зависимости от применения у пациентов с заболеваниями пародонта профилактических мероприятий. Сводные данные по первой и второй группам приведены в таблице 26. Изменения состава лейкоформулы у пациентов с заболеваниями пародонта полностью повторяли полученные ранее для контрольной группы тенденции. 95 Рисунок 13 – Изменения содержания клеток в лейкоформуле в контрольной группе на протяжении стационарного лечения Таблица 26 – Средние показатели состава лейкоформулы у пациентов с пародонтитом на разных этапах стационарного лечения, % Этап лечения Показатель До операции Средние значения показателя Р Первая группа Вторая группа Нейтрофилы 59,6±1,5 59,7±1,4 >0,05 Лимфоциты 28,5±1,2 29,0±1,1 >0,05 Моноциты 7,1±0,3 7,2±0,2 >0,05 Базофилы 0,66±0,04 0,65±0,03 >0,05 Эозинофилы 2,59±0,18 2,12±0,08 <0,05 После Нейтрофилы 74,6±1,3 74,4±1,2 >0,05 операции Лимфоциты 16,5±1,0 15,2±1,0 >0,05 Моноциты 9,3±0,4 9,8±0,3 >0,05 Базофилы 0,52±0,04 0,56±0,03 >0,05 Эозинофилы 1,28±0,13 0,95±0,04 <0,05 96 Продолжение таблицы 26. При выписке Нейтрофилы 58,0±0,9 58,8±0,8 >0,05 Лимфоциты 28,4±0,7 27,3±0,6 >0,05 Моноциты 8,2±0,3 8,8±0,2 >0,05 Базофилы 0,92±0,09 0,77±0,05 >0,05 Эозинофилы 3,14±0,20 3,20±0,12 >0,05 При этом динамика показателей при сравнении двух групп отличалась высокой конгруэнтностью, в связи с чем статистически значимые различия долей практически для всех клеток отсутствовали (p>0,05). Исключение составило содержание эозинофилов, доля которых оказалась несколько выше в первой группе на этапах до и после операции (p<0,05). При выписке пациентов, значения данного показателя уравнялись (p>0,05). 4.4. Построение прогностической модели риска развития воспалительного процесса в тканях пародонта у пациентов с ИБС перед АКШ Установленные в результате нашего исследования сведения о влиянии различных факторов на частоту хронического генерализованного пародонтита у пациентов с ИБС, готовящихся к операции аортокоронарного шунтирования, были использованы для построения прогностической модели методом бинарной логистической регрессии (2.6). 1 z р = 1 e ; z = -8,81 + 0,154*xВОЗ + 0,695*хКУР + 1,167*хАГ + 0,885*хОИЗ, (2.6) где р – вероятность наличия ХГП у пациента с ИБС, готовящегося к операции аортокоронарного шунтирования, принимающая значения 0 (отсутствие пародонтита) или 1 (наличие пародонтита), xВОЗ – возраст пациента, xКУР – наличие привычки к курению, хАГ – наличие артериальной гипертонии, хОИЗ – наличие ранее перенесенного острого ишемического заболевания в анамнезе. 97 Согласно полученным коэффициентам, все из указанных факторов способствуют увеличению риска выявления у пациента ХГП. Значение χ 2 для модели (1) составило 42,7, что соответствует уровню значимости p<0,01. Критерий R2 Найджелкерка составил 0,375, то есть полученная прогностическая модель объясняет 37,5% дисперсии показателя частоты ХГП. В качестве разделяющего значения функции (1) была принята вероятность наличия ХГП, равная 0,72, или 72%, при которой отмечались наивысшие значения чувствительности и специфичности оцениваемой прогностической модели. В том случае, если расчетное значение прогностической функции для конкретного пациента превышало 0,72, делался вывод о высоком риске наличия ХГП. В случае расчетных значений функции меньше 0,72 предполагался низкий риск ХГП. Результаты классификации исследуемых при помощи прогностической функции (1) представлены в таблице 27. Таблица 27 – Результаты классификации пациентов, нуждающихся в аортокоронарном шунтировании, по признаку наличия ХГП Фактические значения признака Предсказанные значения признака Отсутствие ХГП Наличие ХГП Всего абс. % абс. % Отсутствие ХГП 30 78,9 8 21,1 38 100,0 Наличие ХГП 21 19,8 85 80,2 106 100,0 Исходя из полученной таблицы соответствия предсказанного признака наличия ХГП фактическому состоянию пародонта, получены данные о чувствительности прогностической модели (2.6), равной 80,2%, специфичности – 78,9%. Общая диагностическая эффективность модели составила 79,9% (115 случаев из 144). 98 Заключение На сегодняшний день проблема заболеваний пародонта остается в центре внимания многочисленных исследований и является актуальной в стоматологии в связи с широкой распространенностью и недостаточной эффективностью проводимого лечения. По статистике ВОЗ (2010), частота поражения пародонта в разных странах мира составляет до 98%. Основное место в структуре заболеваемости пародонта занимает хронический генерализованный пародонтит, который представляет серьезную медицинскую, социальную и экономическую проблему [19, 81, 152,166]. Развитие данной патологии связано с нарушением баланса микрофлоры полости рта и ослаблением функций местных и общих механизмов защиты организма [112, 145]. В последнее десятилетие увеличивается интерес к изучению взаимосвязи между общесоматическими заболеваниями и состоянием органов полости рта. Прямое воздействие на состояние пародонта у пациентов оказывают заболевания сердечно-сосудистой системы в зависимости от вида патологии: гипертоническая болезнь – 26%, ишемическая болезнь сердца (ИБС) – 10,5%, нейроциркуляторные расстройства – 68% [16, 103]. В свою очередь, обострение ХГП повышает риск возникновения общих патологических состояний либо путем участия в патогенезе болезни, либо являясь постоянным источником патогенной микрофлоры [101]. Взаимосвязь патологических процессов, которые развиваются в различных системах организма, на сегодняшней день остается одной из актуальных и до конца не разрешенных проблем клинической медицины [51]. Так, коморбидным состояниям свойственно взаимное отягощение процесса за счет наличия тесной функциональной связи между пораженными органами [14]. Главными факторами данной проблемы является нарушение микробиоценоза, иммунологические и нейрорегуляторные нарушения, изменения метаболизма соединительной ткани, гемодинамики и минерального обмена, дефицит витаминов [15, 66]. Ранее проведенные исследования показали, что немаловажная роль отводится биологическим свойствам микроорганизмов полости рта и зубного 99 налета [50, 69]. Взаимодействие между бактериальной бляшкой и тканями пародонта является одним из факторов развития воспаления и иммунного ответа [49]. Воспаление пародонта, в свою очередь, становится хроническим при низкой противоинфекционной защите полости рта [71]. Иммунные реакции не справляются с повышенной обсеменѐнностью и становятся патогенетической основой хронического процесса [59]. Изучение системы иммунитета при ХГП свидетельствует хронического о том, воспаления несостоятельность что патогенетическими пародонта врожденного у иммунитета, особенностями пожилых людей связанная с течения являются дисфункцией компонентов системы комплемента, поликлональная активация адаптивного иммунитета с высоким уровнем Ig и провоспалительных цитокинов [65]. Несмотря на масштабность исследований, проводимых в области изучения состояния тканей пародонта на фоне ИБС, диагностики и профилактики заболеваний пародонта, отмечается устойчивая тенденция к росту данной патологии во всех возрастных группах. Целью нашего исследования явилось повышение эффективности диагностики и профилактики заболеваний пародонта у пациентов с ИБС после коронарного шунтирования. В ходе проведенной работы за период с 2012 по 2015 год были обследованы 144 человека в возрасте от 35 до 69 лет, которым было выполнено аортокоронарное шунтирование по поводу ИБС. Учитывая незначительную долю женщин среди данной категории пациентов, в исследуемую выборку были включены только лица мужского пола. В зависимости от наличия хронического генерализованного пародонтита, все пациенты были распределены на три группы. В первую группу вошли 54 человека с выявленными на этапе до операции заболеваниями пародонта, которым проводились лечебно-профилактические мероприятия с использованием средств линейки Асепта. Вторую группу составили 52 пациента, также имеющие заболевания пародонта, но при этом профилактические мероприятия в этой группе не проводились. Пациенты с отсутствием патологии пародонта на этапе до операции были объединены в 100 контрольную группу, и еѐ численность составила 38 человек. В первой и второй группах преобладали пациенты в возрасте от 55 до 59 лет (38,9 и 38,5%, соответственно). В группе контроля наибольшую долю составляли пациенты в возрасте как от 55 до 59 лет, так и от 45 до 49 лет (по 28,9%). Для выявления особенностей клинических проявлений хронического генерализованного пародонтита на разных этапах курации были применены современные клинические, специальные и дополнительные методы обследования. Проводили опрос, изучали анамнез и определяли стоматологический статус больных во всех группах. Дополнительно во всех трех группах было выполнено микробиологическое исследование содержимого пародонтальных карманов и зубного налета с поверхности зуба, а также проведено клинико- иммунологическое исследование. Медицинский осмотр и забор материала проводился на первый и второй день поступления, на вторые сутки после операции и при выписке (на 22 день после операции). На первом этапе у всех 144 пациентов изучали общесоматический, клинический, иммунологический и микробиологический статус. При изучении общесоматического статуса нами было установлено, что основным диагнозом у всех исследуемых была стенокардия напряжения III функционального класса. Часть пациентов перенесла ранее инфаркт миокарда или мозговой инсульт. Наибольшая частота перенесенных инфарктов миокарда отмечалась среди пациентов первой группы (35,2±6,5%). Мозговые инсульты в анамнезе чаще всего наблюдались во второй группе (11,5±4,4%). При оценке различий частоты острых сосудистых катастроф в анамнезе между всеми тремя группами, они оказались статистически не значимыми (p>0,05). При сравнении частоты сопутствующих заболеваний ЖКТ, ДС и ГБС в анамнезе пациентов между группами статистически значимых различий также не наблюдалось (p>0,05). Нами были отмечены статистически значимые различия частоты артериальной гипертонии между сравниваемыми группами. Доля пациентов с АГ в первой и второй группах была существенно выше по сравнению с группой контроля (p<0,01). 101 При сборе анамнеза было установлено, что большинство пациентов имели вредную привычку - курение. При сравнении частоты курильщиков среди пациентов, имеющих ВЗП, и исследуемых контрольной группы, были получены данные о наличии статистически значимых различий (p<0,05), что свидетельствует о существенно большей частоте курильщиков среди пациентов с заболеваниями пародонта. При заболеваниях пародонта и наличии такой вредной привычки как курение происходят изменения в трофике тканей, которые, могут усугубить действие патогенных факторов и способствовать прогрессированию воспалительных процессов в тканях пародонта. Выявление факторов риска возникновения основных стоматологических заболеваний у пациентов с ИБС перед АКШ является основополагающим моментом в их профилактике. Приведенные данные позволяют считать, что к факторам риска воспалительных заболеваний пародонта среди мужчин с ИБС, находящихся на этапе подготовки к АКШ, относятся пациенты старших возрастных групп, наличие артериальной гипертонии и ранее перенесенного ОИЗ в анамнезе, а также курение. Указанные факторы были сведены нами в прогностическую модель, обладающую высокой статистической значимостью (χ2 = 42,7; p<0,01) и позволяющую определять возможный риск возникновения заболеваний пародонта в зависимости от выраженности факторов риска. Диагностическая эффективность модели составила 79,9%, чувствительность – 80,2%, специфичность – 78,9%. По степени тяжести ВЗП пациенты первой группы распределились следующим образом: пародонтит легкой степени отмечался у 28 человек (51,8±6,8%), пародонтит средней степени был выявлен у 26 человек (48,2±6,8%). Вторую группу составили 27 пациентов (51,9±6,9%) с пародонтитом легкой степени тяжести и 25 человек (48,1±6,9%) со среднетяжелой формой пародонтита. У всех исследуемых первой и второй групп процесс носил генерализованный характер. Пациенты предъявляли жалобы на кровоточивость и отечность десен, 102 болезненность, подвижность зубов, обнажение шеек зубов, запах изо рта, задержку пищи между зубами, наличие твердых над- и поддесневых отложений. Результаты, полученные в ходе клинического обследования, показали, что в процессе стационарного лечения пациентов, имеющих при поступлении ВЗП, в зависимости от проводимой профилактики появлялись и нарастали различия показателей состояния полости рта, обусловленные их улучшением у пациентов первой группы и ухудшением у пациентов второй группы. Данное наблюдение было подтверждено результатами оценки следующих индексов: Грин Вермилиона (OHI-S), РМА, пародонтального индекса Рассела (PI), индекса кровоточивости по Muhleman H.R. (1971), подвижности зубов по шкале Miller (в модификации Fleszar 1980). Так при поступлении в стационар у пациентов первой и второй группы среднее значение индекса Грин - Вермилиона (OHI-S) составило 3,47±0,05 и 3,44±0,03, соответственно. Полученные данные свидетельствуют о том, что гигиеническое состояние полости рта у больных с ВЗП было сопоставимым, и при этом оценивалось, как неудовлетворительное. При сборе анамнестических данных было установлено, что некоторые периодически, а значительная часть больных – постоянно, отмечали кровоточивость десен либо во время чистки зубов, либо во время еды. Средние показатели индекса кровоточивости Muhleman H.R., составившего в первой группе 1,19±0,06, а во второй – 1,15±0,05, подтвердили данный факт. Выраженность воспалительных изменений в тканях пародонта, согласно пародонтальному индексу Рассела (PI), составила, в среднем, 3,44±0,13 в первой группе, тогда как во второй группе он был равен 2,32±0,17. Распространенность воспалительного процесса в десне определяли по индексу РМА, значение которого составило 49,8±1,7 в первой и 38,3±1,7 во второй группе. Тогда как, у пациентов входящих в контрольную группу, видимые клинические признаки воспаления не определялись и состояние пародонтальных тканей соответствовало норме: OHI-S – 1,42±0,03, индекс Muhleman H.R. – 0, PI – 0, РМА – 0. 103 Данные полученные в ходе клинического обследования согласуются с результатами бактериологического исследования, которые показали, что в двух группах, у которых наблюдались воспалительные процессы в тканях пародонта, был обнаружен большой спектр анаэробных и аэробных микроорганизмов. Из числа микроорганизмов, имеющих наибольшее значение в патогенезе заболеваний gingivalis, пародонта, Prevotella фиксировался melaninogenica, уровень анаэробов: Porphyromonas Prevotella intermedia, Actinobacillus actinomycetus; аэробов: Streptococcus oralis, Neisseria sicca, Streptococcus mutans, Streptococcus sanguis, Neisseria subflava. На этапе до операции содержание перечисленных микроорганизмов у пациентов первой и второй группы было сопоставимым (p>0,05) и составляло более 102-103 КОЕ в 1 г. В контрольной группе при поступлении пациентов в стационар содержание пародонтопатогенов оказалось незначительным – менее 10 КОЕ в 1 г, большинство из них: Prevotella intermedia, Streptococcus oralis, Neisseria sicca, Streptococcus mutans, Streptococcus sanguis, Neisseria subflava – в материале, взятом из ротовой полости, отсутствовали. В результате клинико-иммунологического исследования была установлена связь между показателями местного иммунитета полости рта при хроническом генерализованном пародонтите с изменениями показателей общего иммунного статуса пациентов. На этапе поступления в стационар, между показателями клеточного иммунитета у пациентов с ВЗП и в группе контроля отмечались статистически значимые различия. Количество T-лимфоцитов в контрольной группе составило 72,8±0,6 %, в первой и второй группах показатель был снижен до 61,4±0,4 % и 61,0±0,4 %, соответственно. Индекс CD4+/CD3+ при отсутствии заболеваний пародонта был равен 45,8±0,5 %, а среди пациентов с ВЗП – 37,6±0,3% в группе, где проводилась профилактика, 38,0±0,3% – в группе, где профилактики не было. Значения индекса CD3+/CD8+ также различались до операции: в контрольной группе показатель составлял 28,8±0,4%, в то время как в первой и второй группах был ниже: 22,7±0,3% и 21,4±0,3%, соответственно. Также среди пациентов с ВЗП 104 отмечалось более низкое содержание В-лимфоцитов: в первой группе – 6,7±0,2%, во второй – 6,6±0,2%, в то время как в контрольной группе показатель был равен 11,2±0,3%. Количество NK-клеток было, напротив, повышено среди пациентов с ВЗП: до 19,2±0,3% в первой и 19,5±0,3% во второй группе, по сравнению с группой контроля – 14,4±0,4%. Показатели фаготеста и burst-теста также имели различия в зависимости от наличия заболеваний пародонта: средние значения фаготеста были выше среди пациентов с ВЗП (97,9±0,2%) в первой группе, 98,3±0,2% – во второй) по сравнению с пациентами контрольной группы (96,5±0,2%). Средние значения burst-теста, напротив были выше в контрольной группе – 99,3±0,1%, тогда как в первой группе – 98,1±0,2%, а во второй – 98,1±0,2%. При сравнении показателей гуморального иммунитета были выявлены следующие различия между группами. Содержание сывороточного IgA было существенно выше в контрольной группе – 2,92±0,03109 л-1, в то время как в первой группе – 1,28±0,01, во второй – 1,25±0,01. Уровень IgG в сыворотке крови оказался выше у пациентов с ВЗП, составляя 15,8±0,1 в первой и 16,0±0,1 во второй группе, по сравнению с группой контроля (10,5±0,3). Также у пациентов с заболеваниями пародонта был повышен уровень IgM, который составил 2,70±0,01 в первой группе, 2,71±0,01 – во второй. В контрольной группе показатель составил 1,96±0,06. Содержание СРБ среди пациентов без признаков ВЗП (3,9±0,1) было статистически значимо ниже, чем в первой группе (5,5±0,1) или во второй (5,6±0,1). Следует отметить, что иммунологические показатели при сравнении между первой и второй группами были сопоставимыми (p>0,05). Полученные данные на первом этапе исследования показали, что у большинства пациентов в полости рта обнаруживаются пародонтопатогенные микроорганизмы, которые могут участвовать в возникновении и развитии как воспалительных заболеваний пародонта, так и атеросклероза, стенокардии, ишемической болезни сердца. Особенностью данных микроорганизмов является выделение эндотоксина, активно повреждающего клетки органов, 105 соединительную-ткань, основное вещество. Проникая в ткани пародонта, они приводят к целому каскаду реакций, которые влекут за собой воспалительные и дегенеративные расстройства. В процессе инвазии бактерии вырабатывают соединения, снижающие или полностью блокирующие активность защитных систем организма. В свою очередь персистирование микроорганизмов в полости рта приводит к развитию иммунного дисбаланса. Образовавшийся очаг воспаления в области пародонта даже в неактивной хронической форме является для организма больного резервуаром антигенов, токсических комплексов, биологически активных факторов, способных оказывать отрицательное воздействие на течение послеоперационного периода, вызывая осложнения и обострения со стороны тканей пародонта. При этом отмечалось увеличение концентрации специфических IgA-антител к пародонтопатогенным микроорганизмам, которые могут явиться одним из факторов повышения риска аутоиммунных реакций по отношению к эндотелию сосудов, а достоверное снижение сывороточного Ig A свидетельствует об угнетении В-клеточного звена иммунитета Вышеизложенное явилось основанием для разработки алгоритма мероприятий для пациентов с заболеваниями пародонта на фоне ИБС перед АКШ с целью повышение уровня гигиены полости рта, снижения количества пародонтопатогенных микробов, нормализации микроциркуляции в пародонте. В процессе стационарного лечения состояние пародонта изменялось в зависимости от проведения профилактических мероприятий. Во второй группе на этапах после операции и при выписке происходило статистически значимое повышение средних значений индекса Грин-Вермилион – до 3,51±0,03 и 3,58±0,03, соответственно (p<0,01). Индекс кровоточивости в процессе стационарного лечения изменялся незначительно, оставаясь примерно на том же уровне: 1,17±0,05 – после операции, 1,19±0,05 – при выписке. Динамика индексов РМА и РI характеризовалась существенным ростом, после операции их значения составили 45,8±1,7 и 3,05±0,18, соответственно. При выписке средний индекс РМА составил 52,5±1,7, а индекс PI – 3,74±0,19. 106 Подобные изменения большинства индексов были характерны и для контрольной группы. Так, среднее значение индекса кровоточивости при исходном нулевом значении возрастало после операции до 0,17±0,02, а при выписке – до 0,19±0,02 (p<0,01). Также отмечалось существенное увеличение индекса PМA, среднее значение которого составило на этапе после операции 19,4±1,4, а при выписке – 20,9±1,5 (p<0,01). Индекс PI после операции увеличился до 0,45±0,04, при выписке его значение практически не изменилось, составив 0,47±0,04 (p<0,01). Среднее значение индекса Грин-Вермилион к выписке также увеличилось до 1,51±0,03, однако изменения не имели статистической значимости (p>0,05). В первой группе, где пациенты проходили профилактические мероприятия, изменения всех стоматологических индексов носили противоположный характер. Индекс Грин-Вермилион уменьшился после операции до 3,24±0,04, а при выписке – до 2,76±0,05 (p<0,01). Средние значения индекса кровоточивости составили на этапе после операции 0,86±0,06, при выписке – 0,57±0,06 (p<0,01). Также наблюдалось статистически значимое снижение индексов РМА и PI: на этапе после операции – до 42,4±1,6 и 3,03±0,12, а при выписке – до 34,8± 1,5 и 2,57±0,12, соответственно (уровень значимости для обоих индексов составил p<0,01) В результате указанной динамики, при сравнении средних значений стоматологических индексов в первой и второй группах отмечались статистически значимые различия (p<0,01): во всех случаях средние значения индексов у пациентов, прошедших профилактику заболеваний пародонта, были ниже, чем у пациентов, не получавших профилактики. Динамика содержания микроорганизмов в ротовой полости соответствовала тенденциям, выявленным при сравнении значений стоматологических индексов. Весьма показательны изменения микрофлоры полости рта в контрольной группе. В процессе стационарного лечения содержание патогенных микроорганизмов, таких как Staphylococcus aureus, Streptococcus mitis, Staphylococcus epidermides, Prevotella intermedia, Neisseria sicca, Neisseria mucosa, Streptococcus sanguis, 107 Candida crusei, увеличилось до 102-103 КОЕ в 1 г и выше, причем различия были статистически значимыми. Напротив, бактерии, составляющие нормальную микрофлору ротовой полости: Lactobacillus, Corynebacterium, Streptococcus salivarius – не обнаруживались в исследуемом материале уже на этапе после операции. При сравнении обсемененности микроорганизмами ротовой полости у пациентов первой и второй группы изменения имели противоположное направление. При проведении профилактических мероприятий уровни всех указанных ранее пародонтопатогенных микроорганизмов статистически значимо снижались (p<0,01). В подавляющем большинстве случаев их содержание на этапе выписки составляло не более 10 КОЕ на 1 г. При отсутствии лечебнопрофилактических мероприятий, количество микроорганизмов в ротовой полости значительно возрастало, так во второй группе содержание пародонтопатогенов на этапе выписки составляло от 103 до 104 и выше КОЕ на 1 г материала. При сравнении среднего содержания пародонтопатогенных микроорганизмов между группами пациентов с ВЗП в зависимости от применения профилактики, нами были отмечены статистически значимые различия на этапах после операции и при выписке из стационара. Следующий этап нашего исследования был посвящен изучению изменений иммунологических показателей у пациентов, находящихся на стационарном лечении, в зависимости от наличия у них ВЗП и проведения профилактических мероприятий. Необходимо отметить, что исходный уровень показателей иммунограммы было сопоставимым во всех трех группах (p>0,05). Нами было установлено, что в контрольной группе на этапе после операции наблюдалось статистически значимое снижение содержания T-лимфоцитов в крови и всех анализируемых видов иммуноглобулинов в сыворотке, а также индексов CD4+/CD3+ и CD3+/CD8+. Одновременно увеличивалось число NKклеток и B-лимфоцитов, результаты фаготеста и содержание С-реактивного белка (p<0,01). При выписке у исследуемых значения индексов CD4+/CD3+ и CD3+/CD8+ увеличивались (p<0,01 и p<0,05, соответственно), уменьшалось 108 содержание NK-клеток (p<0,05), В-лимфоцитов (p<0,01) и С-реактивного белка (p<0,01). Данные изменения могут свидетельствовать о существенном и неблагоприятном влиянии операции на показатели иммунологического статуса пациентов, при этом не отличающимся стойким характером. После операции в первой группе содержание Т-лимфоцитов и индекс CD3+/CD8+ оказались более высокими, чем во второй группе (p<0,01 и p<0,05, соответственно), а содержание NK-клеток и среднее значение индекса CD4+/CD3+ – напротив, ниже (p<0,01; p<0,05, соответственно). При выписке обнаруженные различия еще более увеличились: содержание Т-лимфоцитов и средние значения обоих индексов были более высокими (p<0,01; p<0,01; p<0,05, соответственно), а количество NK-клеток и В-лимфоцитов – более низкими, чем в первой группе (p<0,01). Сравнение показателей фаготеста выявило статистически значимые различия первой и второй группы пациентов на этапе выписки (p<0,01). У пациентов, получающих профилактику, среднее значение фаготеста составило 97,7±0,01, а при отсутствии профилактики – средний показатель оказался равным 102,6±0,3. При оценке гуморального иммунитета у пациентов с ВЗП, наблюдались статистически значимые изменения содержания иммуноглобулинов в сыворотке крови. Например, содержание сывороточного IgA в первой группе на этапе после операции снижалось – с 1,28±0,01 до 1,25±0,01, а к выписке увеличивалось до 2,64±0,05. То же происходило и с другими анализируемыми иммуноглобулинами – IgG, IgM. Уровень IgG после операции снижался с исходных 15,8±0,1 до 8,3±0,2. При выписке его содержание было уже 12,0±0,2. Количество IgM в первой группе уменьшалось с 2,70±0,01 до 1,90±0,02, составляя к выписке 2.48±0,01. Во второй группе содержание иммуноглобулинов также вначале снижалось, а потом увеличивалось, однако рост показателей к выписке носил менее заметный характер, в связи с чем уровень сывороточного IgA составлял всего 1,05±0,01, IgG – 11,3±0,2, а IgМ – 1,87±0,02. При сравнении показателей первой и второй групп 109 между собой, наблюдались статистически значимые различия, обусловленные более низкими значениями во второй группе (p<0,05). Представлял интерес анализ изменений С-реактивного белка в сравниваемых группах. На этапах поступления в стационар и после операции значения СРБ не имели статистически значимых различий, их увеличение за этот период составило в первой группе – до 198,2±4,1, во второй – до 189,7±3,7. На этапе выписки из стационара, содержание СРБ оказалось более высоким во второй группе – 51.2±1,2 (в первой группе – 31,4±1,3). Нами также проводилась оценка изменений содержания секреторного иммуноглобулина А в слюне в процессе стационарного лечения. В контрольной группе отмечался непрерывный, статистически значимый рост данного показателя, составившего при поступлении 231,6±4,3 мг/мл, после операции – 308,7±3,1 мг/мл, при выписке – 349,8±5,5 мг/мл (p<0,01). У пациентов с ВЗП исходный уровень секреторного IgA был сопоставимым (в первой группе – 443,0±10,5 мг/мл, во второй группе – 439,7±15,6 мг/мл, p>0,05), и при этом – существенно, почти в 2 раза превышал значения контрольной группы. На этапах после операции и при выписке наблюдалось снижение содержания секреторного IgA в первой группе, и увеличение – во второй. В результате к концу стационарного лечения содержание секреторного IgA составило в первой группе 228,0±5,3 мг/мл, а во второй – 518,6±13,9 мг/мл. Различия данных показателей статистически значимы (p<0,01). Нами было проведено сравнение лейкоцитарного профиля периферической крови пациентов, находящихся на стационарном лечении. Исходный уровень числа лейкоцитов был сопоставимым во всех трех группах, составляя 7,6±0,5 в контрольной, 8,4±0,4 – в первой и 9,0±0,4 – во второй группе. На этапе после операции данный показатель увеличился до 12,2±0,5, 13,0±0,4 и 12,8±0,5, соответственно. А к выписке вновь снизился, принимая значения 10,1±0,4 в контрольной группе, 10,4±0,3 в первой и 10,3±0,3 – во второй группе. Изменения числа лейкоцитов в каждой группе были статистически значимыми (p<0,01). 110 Изменения содержания отдельных видов лейкоцитов на каждом этапе стационарного лечения являются статистически значимыми (p<0,05). После операции наблюдалось увеличение содержания нейтрофилов в лейкоформуле до 73,0±1,5% и моноцитов до 9,6±0,4%, при этом доля остальных клеток пропорционально снижалась. При выписке количество нейтрофилов возвращается к нормальным значениям, снижается доля моноцитов, параллельно повышается до нормальных значений содержание лимфоцитов и других клеток. У пациентов с ВЗП изменения состава лейкоформулы у пациентов с заболеваниями пародонта повторяли полученные ранее для контрольной группы тенденции. Анализируя полученные данные результатов использования индивидуальных средств гигиены, следует отметить, что у пациентов первой (основной) группы отмечалось стабилизация патологического процесса в тканях пародонта. Исчез запах изо рта, десна приобрела бледно-розовую окраску, отечность и кровоточивость десен при чистке уменьшилась, отсутствовала болезненность при приеме пищи. Отмечалось достоверное увеличение иммунологических показателей, что свидетельствует о нормализации процесса. У больных второй группы отсутствовала положительная динамика клинического состояния тканей пародонта, как в основной группе. У пациентов второй группы показатели пародонтальных индексов после операции достоверно повышались, кроме жалоб на подвижность зубов, кровоточивость десен, отечность, болезненность при приеме пищи, появилась ксеростомия и наличие язв на слизистой оболочке рта. Иммунологические показатели после АКШ достоверно повысились, что свидетельствует о наличии воспалительного процесса в тканях пародонта. Результаты, полученные в ходе клинического обследования контрольной группы, на момент поступления в стационар и готовившихся к АКШ, выявили интактный пародонт. На вторые сутки после операции в полости рта были отмечены симптомы воспалительной реакции со стороны тканей пародонта. Больные стали предъявлять жалобы на сухость во рту (ксеростомия), отечность десен, болезненность при нажатии, также как во второй группе указывали на наличии язв на слизистой оболочки рта. Проведение АКШ явилось стрессорным 111 воздействием, что проявилось в подавлении местного иммунитета и как следствие развития воспалительного процесса в тканях пародонта, что согласуется с данными клинического исследования, которое указывает на увеличение количества зубного налета, количества пародонтопатогенных микроорганизмов. Отсутствие адекватной профилактических гигиены мероприятий полости приводит рта, к проведение увеличению лечебно- патогенной микрофлоры, продукты жизнедеятельности которых оказывают не только прямое повреждающее действие на твердые ткани зуба, ткани пародонта и слизистую оболочку полости опосредованно рта, но способствуют и являясь снижению хроническим уровня очагом инфекции, иммуннобиологической реактивности организма. Установлено, что наличие воспалительного процесса, отсутствие его раннего выявления усугубляет течение как стоматологического заболевания, так и общей патологии. Создание единого алгоритма и формулы прогноза для выявления лиц нуждающихся в проведении лечебно-профилактических мероприятий является основным элементом для предотвращения осложнений на всех этапах нахождения в стационаре. Данные исследования показали, что динамика клинических показателей состояния тканей пародонта у больных зависит от своевременно начатой профилактики. Наилучшие клинические показатели наблюдались в группе, где пациенты использовали разработанную нами методику применения индивидуальных средств гигиены полости рта. Таким образом, разработанный алгоритм мероприятий с использованием индивидуальных средств гигиены полости рта с первого дня поступления пациента в стационар быстрее купировал воспалительные процессы в тканях пародонта, тем самым предотвращая обострения заболеваний пародонта и увеличивая сроки ремиссии. 112 Выводы 1.В ходе проведенного стоматологического осмотра было установлено, что воспалительными заболеваниями пародонта страдают 73,6±3,7% пациентов с ИБС. Распространенность хронического генерализованного пародонтита легкой степени тяжести составила 51,9%, средней степени тяжести - 48,1%. К факторам риска воспалительных заболеваний пародонта среди мужчин с ИБС, находящихся на этапе подготовки к АКШ, относятся пациенты старших возрастных групп, наличие артериальной гипертонии, ранее перенесенного ОИЗ в анамнезе, а также курение. 2.Микробный пейзаж биотопов полости рта пациентов с ИБС, отягощенных воспалительными заболеваниями пародонта, характеризуется достоверным увеличением (p>0,05) уровня анаэробных микроорганизмов: Porphyromonas gingivalis, Prevotella melaninogenica, Prevotella intermedia, Actinobacillus actinomycetus; аэробов: Streptococcus oralis, Neisseria sicca, Streptococcus mutans, Streptococcus sanguis, Neisseria subflava. На этапе до операции содержание перечисленных микроорганизмов у пациентов первой и второй группы было сопоставимым и составляло более 102-103 КОЕ в 1 г. 3.Установлено, что у пациентов с ХГП на фоне ИБС отмечается достоверное изменение иммунологических показателей общего и местного иммунитета (уровень IgM, IgG, IgA, В-лимфоцитов (CD19+) в плазме крови, sIgA в смешанной слюне по сравнению с показателями в контрольной группе, что свидетельствует о дисбалансе в иммунной системе. 4. В результате применения в клинике разработанных нами алгоритмов патогенетически пародонта, обоснованной включающие комплексной профилактики противовоспалительные и заболеваний антибактериальные препараты, улучшилось гигиеническое состояние в 1,5 раза, уменьшилась кровоточивость десен в два раза, нормализовался микробный пейзаж полости рта (с 105-106 до 102 КОЕ в 1 г) и иммунологические показатели. 113 5.Создана прогностическая модель риска развития заболеваний пародонта у пациентов с ИБС до АКШ, в которую вошли такие факторы риска как возраст, наличие привычки к курению, артериальная гипертония, ранее перенесенные острые ишемические заболевания в анамнезе, оказывающие прямое влияние на вероятность развития заболеваний пародонта. Статистическая значимость модели составила p <0,01, диагностическая эффективность модели составила 79,9%. 114 Практические рекомендации 1. В комплексном обследовании пациентов с ИБС, поступающих в стационар и планирующих АКШ, для прогнозирования развития воспалительного процесса в тканях пародонта наряду с клиническим методами оценки тяжести заболевания, прогнозирования его течения, целесообразно определять уровень IgM, IgG, IgA, В-лимфоцитов (CD19+) в плазме крови, sIgA в смешанной слюне, а также микробиологические исследования содержимого зубодесневой борозды и пародонтальных карманов. 2. Применение полученной прогностической функции в клинической практике может быть использовано как врачами кардиохирургами, так и стоматологами для выявления пациентов с высоким риском заболеваний пародонта, что позволит проводить своевременную профилактику заболеваний пародонта и будет способствовать улучшению качества медицинской помощи, оказываемой пациентам с ИБС, направляемым на АКШ. 3. Проводить стоматологические и клинико-лабораторные исследования необходимо в сроке на второй день поступления в стационар, вторые сутки после операции и на последний день выписки из стационара. 4. В период подготовки больных к операции АКШ, врачи-стоматологи во время профилактических осмотров должны мотивировать пациентов к поддержанию стоматологического здоровья для оздоровления всего организма и применять разработанный алгоритм мероприятий с целью достижения стойкой ремиссии и исключения обострений заболеваний пародонта в послеоперационном периоде. 5. Диспансерное наблюдение. Кратность наблюдения зависит от тяжести течения пародонтита и течения основного заболевания, показателей лабораторных, бактериологических и иммунологических методов исследования: Пациенты с ишемической болезнью сердца без патологии пародонта или хроническим пародонтитом легкой степени тяжести – не менее 2 раз в год. Пациенты с ишемической болезнью сердца и хроническим пародонтитом средней степени тяжести – не менее 3 раз в год. 115 Пациенты, болеющие ишемической болезнью сердца более 7 лет, и хроническим пародонтитом легкой и средней степени тяжести – не менее 4 − 5 раз в год. 6. Полученные данные в ходе исследования могут использоваться в лечебных учреждениях и в учебном процессе медицинских вузов с целью расширения знаний о выраженности клинико-лабораторных изменений у пациентов с заболеваниями пародонта на фоне ИБС и способов предупреждения развития осложнений в послеоперационном периоде в рамках комплексного проведения лечебно-профилактических мероприятий. 116 Список сокращений ВЗП – воспалительные заболевания пародонта ХГП – хронический генерализованный пародонтит sIgA – секреторный иммуноглобулин А РМА – папиллярно-маргинально-альвеолярный индекс PI – пародонтальный индекс МО – микроорганизмы ИБС – ишемическая болезнь сердца АКШ – аортокоронарное шунтирование ОИЗ – острые ишемические заболевания ЖКТ – желудочно-кишечный тракт АГ – артериальная гипертензия ДС – дыхательная система ГБС – гипертоническая болезнь сердца МКБ-10 - Международная классификация болезней 10-го пересмотра 117 ЛИТЕРАТУРА 1. Абакаров, С.И. Эффективность рационального протезирования в комплексном лечении пародонтита / С.И. Абакаров, В.В. Свирин, Д.С. Абакарова [и др.] // Институт Стоматологии. – 2010. – № 3. – С. 50 − 53. 2. Аболмасов, Н.Г. Современные представления и размышления о комплексном лечении заболеваний пародонта / Н.Г. Аболмасов, Н.Н. Аболмасов, П.Н. Гелетин, А.А. Соловьев // Российский стоматологический журнал. – 2009. – № 5. – С. 26 − 32. 3. Ахкамова, Т.М. Влияние экзо- и эндогенных факторов риска на развитие хронического генерализованного пародонтита / Т.М. Ахкамова, А.И. Булгакова, И.В. Валеев // Медицинский вестник Башкортостана. – 2007. – № 2. – С.82 − 83. 4. Аль – Табиб, М.М. Особенности стоматологического статуса у курящих пациентов молодого возраста / М.М. Аль-Табиб, Л.П. Герасимова, М.Ф. Кабирова // Медицинский вестник Башкортостана № 1. – 2014. -Т 9. - С. 57 – 59. 5. Барер, Г.М. Сравнительная оценка местного применения иммуномодуляторов при пародонтите / Г.М. Барер, С.С. Григорян, Б.Ю. Суражев, Н.В. Постнова // Всероссийская научно-практическая конференция, посвященная 105-летию со дня рождения проф. Е.Е. Платонова: материалы. – М., 2006. – С. 21 − 25. 6. Барер, Г.М. Терапевтическая стоматология: учебник / Г.М. Барер. – М.: ГЭОТАР-Медиа, 2008. – Ч.2. – 314 с. 7. Белоклицкая, Г.Ф. Азбука ручного скейлинга: пособие для врачей / Г.Ф. Белоклицкая, Т.Б. Волинская. – Киев: Изд-во «КИТ», 2011. – 234 с. 8. Блашкова, С.Л. Клинико-иммунологическая характеристика хронического генерализованного пародонтита тяжелой степени / С.Л. Блашкова, Н.А. Макарова // Институт стоматологии. – 2010. – № 2. – С.54. 118 9. Буланников, А.С. Заболевания пародонта: клиника, диагностика и лечение / А.С. Буланников // Медицинская помощь. – 2005. – № 4. – С. 21 − 24. 10. Булгакова, А.И. Клинико-иммунологические аспекты лечения хронического генерализованного пародонтита / А.И. Булгакова, Ю.А. Медведев. – Уфа: ГОУ ВПО «Башгосмедуниверситет РОСЗДРАВА», - 2008. – 106 с. 11. Булкина, Н.В. Применение иммуномодулятора гепона в комплексной терапии больных хроническим генерализованным пародонтитом / Н.В. Булкина, Л.В. Лукина, А.П. Глыбочко [и др.] // Российский стоматологический журнал. – 2008. – № 6. – С. 20 − 22. 12. Булкина, Н.В. Взаимосвязь и взаимовлияние воспалительных заболеваний пародонта на сердечно-сосудистую систему и желудочно-кишечный тракт / Н.В. Булкина // Клиническая стоматология. – 2010. – № 2. – С. 28 − 29. 13. Булкина, Н.В. Коморбидность заболеваний пародонта и соматической патологии / Н.В. Булкина, А.П. Ведяева, Е.А. Савина // Медицинский вестник Северного Кавказа. – 2012. – № 3. – С. 110 − 115. 14. Булкина, Н.В. Современные аспекты этиологии и патогенеза воспалительных заболеваний пародонта. Особенности клинических проявлений рефрактерного пародонтита / Н.В. Булкина, В.М. Моргунова // Фундаментальные исследования. – 2012. – № 2. – С. 416 − 420. 15. Васильева, Л.И. Этиология, патогенез и современные методы лечения воспалительных заболеваний пародонта / Л.И. Васильева, Н.Ю. Желтухина, С.В. Новгородский // Валеология. – 2012. – № 3. – С. 12 − 18. 16. Волинская, Т.Б. Дифференциальный подход в выборе порошка для воздушно-абразивной обработки зубов при лечении больных с воспалительными заболеваниями пародонта / Т.Б. Волинская // Стоматология. – 2013. – № 2. – С. 27 − 32. 17. Волков, Е.А. Использование средства на основе бактериофагов в комплексном лечении инфекционно-воспалительных заболеваний пародонта / Е.А. Волков, В.В. Никитин, Г.С. Пашков [и др.] // Российский стоматологический журнал. – 2013. – № 5. – С. 17 − 22. 119 18. Волков, Е. А. Влияние пародонтита на тяжесть течения хронической обструктивной болезни легких / Е.А. Волков, А.Г. Малявин, В.Ю. Чеснокова // ДОКТОР.РУ. – 2014.- №2 (90). - С. 33 – 39. 19. Воложин, А.И. Применение вейлонелл для укрепления колонизационной резистентности тканей полости рта при «лигатурном» пародонтите в эксперименте / А.И. Воложин, В.Н. Царев, В.К. Ильин [и др.] // Российский стоматологический журнал. – 2008. – № 6. – С. 14 − 17. 20. Вольф, Г.Ф. Пародонтология / Г.Ф. Вольф, Э.М. Ратейцхак, К. Райтецхак; пер. с нем.; под ред. Г.М. Барера. – М.: МЕДпресс, 2008. – 548 с. 21. Гажва, С.И. Сравнительная оценка эффективности лечения хронического генерализованного пародонтита легкой и средней степеней тяжести с использованием антибактериальных средств «Асепта» / С.И. Гажва, А.И. Воронина // Пародонтология. − 2009. − № 2. − С. 19 − 24. 22. Гажва, С.И. Клиническая эффективность консервативного лечения хронического генерализованного пародонтита различными препаратами / С.И. Гажва, К.И. Пилипенко, О.В. Шкаредная, Ю.В. Меньшикова // Клиническая стоматология. – 2011. – № 3. – С. 34 − 36. 23. Герез, В.С. Особенности стоматологического лечения больных ишемической болезнью сердца, перенесших аортокоронарное шунтирование: автореф. дис. … канд. мед. наук: 14.01.17, 14.01.14 / Валентина Сергеевна Герез. – М., 2011. − 21 с. 24. Гинтер, Е.К. Медицинская генетика / Е.К. Гинтер. – М.: Медицина, 2003. – 450 с. 25. Горбачева И. Ф. Общесоматические аспекты патогенеза и лечения генерализованного пародонтита / И.Ф. Горбачева, А.И. Кирсанов, Л. Ю. Орехова // Стоматология. - 2001. – Т. 80, № 1.- С. 26 − 34. 26. Горбачева, И.А. Единство системных патогенетических механизмов при заболеваниях внутренних органов, ассоциированных с генерализованным пародонтитом / И.А. Горбачева, А.И. Кирсанов, Л.Ю. Орехова // Стоматология. – 2004. – № 3. – С. 47 − 51. 120 27. Горбачева, И.А. Комплексные подходы к лечению больных с сочетанными заболеваниями внутренних органов и воспалительными поражениями пародонта: автореф. дис. … д-ра мед. наук: 14.00.05, 14.00.21 / Ирина Анатольевна Горбачева. – СПб., 2004. – 43 с. 28. Григорович, Э.Ш. Взаимосвязь генотипов цитокинов семейства интерлейкина 1 с развитием и течением хронического воспаления пародонта / Э.Ш. Григорович, А.В. Кононов, В.Б. Недосеко [и др.] // Институт стоматологии. – 2010. – № 2. – С. 65 − 67. 29. Григорьян, А.С. Болезни пародонта. Патогенез, диагностика, лечение / А.С. Григорян, А.И. Грудянов, Н.А. Рабухина, О.А. Фролова. – М.: Мед. Информац. Агентство, 2004. – 320 с. 30. Григорьян, А.С. Микроорганизмы в заболеваниях пародонта: экология, патогенез, диагностика / А.С. Григорьян, С.Ю. Рахметова, Н.В. Зырянова. – М.: ГЭОТАР-Медиа, 2007. – 56 с. 31. Грудянов, А.И. Организация пародонтологической помощи в стоматологических учреждениях / А.И. Грудянов, В.И. Калинин, Л.Ю. Орехова // 6-й съезд стоматологической ассоциации России. — М., 2000. — С. 194 − 197. 32. Грудянов, А.И. Заболевания пародонта / А.И. Грудянов. – М.: Издательство «Медицинское информационное агентство», 2009. – 336 с. 33. Грудянов, А.И. Методы диагностики воспалительных заболеваний пародонта: руководство для врачей / А.И. Грудянов, О.А. Зорина. – М.: МИА, 2009. – 112 с. 34. Грудянов, А.И. Частота выявления различных представителей пародонтопатогенной микрофлоры при пародонтите различной степени тяжести / А.И. Грудянов, В.В. Овчинникова // Стоматология. – 2009. – № 3. – С. 34 − 37. 35. Грудянов, А.И. Планирование лечебных мероприятий при заболеваниях пародонта / А.И. Грудянов, И.Ю. Александровская. – М.: Медицинское информационное агентство, 2010. – 146 с. 121 36. Грудянов, А.И. Взаимосвязь воспалительных заболеваний пародонта и рисков развития ишемической болезни сердца и атеросклероза / А.И. Грудянов // Клиническая стоматология. – 2011. – № 4. – С. 34 − 35. 37. Грудянов, А.И. Терапия воспалительных заболеваний пародонта снижает риск развития ишемической болезни сердца и осложнений при сахарном диабете / А.И. Грудянов // Лечащий врач. – 2012. – № 7. – С. 106 − 108. 38. Гусева, О.Ю. антибиотикотерапии при Обоснование обострении дифференцированного хронического подхода к генерализованного пародонтита / О.Ю. Гусева, Н.В. Булкина, Е.Н. Полосухина [и др.] // Саратовский научно-медицинский журнал. – 2011. – № 1. – С. 287 − 288. 39. Дмитриева, Л.А. Особенности изменения микрофлоры пародонтального кармана при применении озонотерапии / Л.А. Дмитриева, Л.М. Теблоева, К.Г. Гуревич [и др.] // Пародонтология. – 2004. – № 4. – С. 20 − 24. 40. Дубровская, Е.Н. Изменение микроциркуляции при использовании мексидола в комплексной терапии хронического генерализованного пародонтита у больных артериальной гипертензией / Е.Н. Дубровская, Л.Н. Казарина, Л.В. Вдовина // Российский стоматологический журнал. – 2008. – № 4. – С. 19 − 20. 41. Елисеева, А.Ф. Клиническая оценка состояния пародонта на фоне ишемической болезни сердца и без неѐ / А.Ф. Елисеева, А.В. Цимбалистов, Г.Б. Шторина // Институт стоматологии. - 2011. - № 52 (3). – С. 70 – 71. 42. Есипова, А.А. Распространенность заболеваний пародонта у лиц с патологией сердечно-сосудистой системы в условиях Европейского Севера (г. Архангельск) / А.А. Есипова, Т.В. Вилова, И.И. Чернов // Экология человека. – 2007. – № 12. – С. 9 − 12. 43. Ерема, Н.А. Стоматологическая помощь больным, принимающим антикоагулянты в постинфарктном периоде: дисс… канд. мед.наук: 14.01.14. - М., 2013. − 21 с. 122 44. Ерохина, Н.И. Анализ распространенности патологии пародонта среди пациентов, обратившихся в муниципальную стоматологическую поликлинику/ Н.И. Ерохина// Пародонтология. - 2006. - №3.–С.6 − 9. 45. Зайратьянц, О.В. Роль иммунокомпетентных клеток десны, Toll-like рецептров и других молекулярных механизмов в патогенезе воспалительнодеструктивных заболеваний пародонта / О.В. Зайратьянц, В.А. Смольянникова // Пародонтология. – 2007. – № 3. – С.12 − 20. 46. Зорина, О.А Взаимосвязь полиморфизма генов с риском развития агрессивного пародонтита / О.А. Зорина, О.А. Борискина, Д.В. Ребриков // Стоматология. – 2013. – № 4. – С. 28 − 30. 47. Зорина, О.А. Сравнительная характеристика микробиоценозов пародонтальных карманов при хроническом генерализованном и агрессивном пародонтите до и после комплексного лечения / О.А. Зорина, И.С. Беркутова, Б.А. Рехвиашвили, Н.К. Аймадинова // Российский стоматологический журнал. – 2013. – № 1. – С.27 − 31. 48. Зудина, И.В. Противовоспалительный эффект аскорбата хитозана в комплексной терапии заболеваний пародонта / И.В. Зудина // Российский стоматологический журнал. – 2013. – № 2. – С.16 − 19. 49. Иванов В.С. Заболевания пародонта / В.С. Иванов. – М.: ООО «Медицинское информационное агентство», 2001. – 296 с. 50. Иорданишвилли А.К. Заболевания эндодонта, пародонта и слизистой оболочки полости рта / А.К. Иорданишвили. -М.: МЕДпресс-информ, 2008. – 344 с. 51. Иващенко, Ю.Ю. Взаимосвязь хронической патологии зубочелюстной системы с ишемической болезнью сердца и ее осложнениями / Ю.Ю. Иващенко // Сартовский научно-медицинский журнал. – 2013. – № 3. – С.408 − 412. 52. Карцева, Е.А. Антимикробная фотодинамическая терапия в пародонологии / Е.А. Карцева // Стоматология. − 2013. – № 5. – С. 61 − 63. 53. Китаева, В.Н. Исследование нарушений функциональной активности тромбоцитов у больных хроническим генерализованным пародонтитом с целью 123 ранней диагностики патологии пародонта / В.Н. Китаева, Н.В. Булкина, Е.Н. Полосухина // Саратовский научно-медицинский журнал. – 2011. – № 1. – С. 295 − 297. 54. Кречина, Е.К. Микроциркуляция в тканях десны пародонта / Е.К. Кречина, В.И. Козлов, В.В. Маслова. – М., 2008. – 247 с. 55. Круглова, Н.В. Оценка эффективности комплексного лечения воспалительных заболеваний пародонта: автореф. дис. … канд. мед. наук: 14.01.14 / Наталья Валерьевна Круглова. – Н. Новгород, 2011. – 19 с. 56. Лабис, В.В. Бактериальный фактор как участник инфекционновоспалительного процесса в полости рта / В.В. Лабис, Э.А. Базикян, И.Г. Козлов // Российский стоматологический журнал. – 2013. – № 4. – С.19 − 21. 57. Лагунина, Л.Е. Маркеры инфекции, психологические расстройства и сердечная недостаточность при остром инфаркте миокарда / Л.Е. Лагунина, Ю.Ю. Иващенко, Э.А. Федотов, Ю.Г. Шварц // Кардиоваскулярная терапия и профилактика. – 2005. – № 2. – С.184 − 185. 58. Ламонт, Р.Дж. Микробиология и иммунология для стоматологов / Р.Дж. Ламонт, М.С. Лантц, Р.А. Бернье, Д.Дж.Лебланк; пер. с англ. – М.: Практическая медицина, 2010. – 504 с. 59. Лебедев К.А. Иммунология образраспознающих рецепторов (интегральная иммунология) / К.А Лебедев, И.Д. Понякина. – М., 2008. – 253 с. 60. Леонова, Л.Е. Медикаментозная терапия у больных пародонтитом с использованием препарата «Холисал» / Л.Е. Леонова, Г.А. Павлова, Е.Н. Тоболина, В.Ф. Коломейцев. – М., 2008. – 4 с. 61. Леонтьев, В.К. Здоровые зубы и качество жизни / В.К. Леонтьев // Стоматология. –2000.–№5.–С. 10 − 13. 62. Лепеева, Н.А. Влияние метаболического синдрома на пародонтологический статус больных / Н.А. Лепеева, Л.А. Ермолаева, А.Н. Шишкин, М.А. Шевелева // Институт стоматологии. – 2013.- № 3. – С. 64 − 67. 124 63. Лукиных, Л.М. Профилактика кариеса зубов и болезней пародонта / Л.М. Лукиных. − М.: Медицинская книга, 2003. ‐ 196 с. 64. Луцкая, И.К. Диагностический справочник стоматолога: справочное пособие / И.К. Луцкая. – М.: Медицинская литература, 2010. – 398 с. 65. Малежик, Л.П. Состояние иммунитета при хроническом генерализованном пародонтите у пожилых людей, страдающих ишемической болезнью сердца / Л.П. Малежик, М.С. Малежик, Ю.И. Пинелис // Бюллетень восточно-сибирского научного центра со рамн. – 2012. - № 3 (85). – С. 109 − 112. 66. Мартиросян, В.Г. Клинико-микробиологические особенности диагностики хронического генерализованного пародонтита / В.Г. Маптиросян, Н.В. Плескановская, Л.Н. Николаева [и др.] // Российский стоматологический журнал. – 2012. – № 4. – С.30 − 34. 67. Мащенко, И.С. Обмен цитокинов у больных с генерализованным пародонтитом / И.С. Мащенко // Современная стоматология. – 2004. – № 1. – С.73 − 75. 68. Митронин, А.В. Принципы, методы и средства лечения хронического периодонтита при комплексной реабилитации пациентов / А.В. Митронин // Стоматология. – 2005. – № 6. – С.67 − 73. 69. Модина Т.Н. Принципы планирования комплексного лечения взрослых пациентов с быстропрогрессирующим пародонтитом / Т.Н. Модина, Г.Б. Оспанова // Клиническая стоматология. – 2001. – № 1. – С. 52 – 56. 70. Модина Т.Н. Индивидуальный подход к комплексному лечению заболеваний пародонта / Т.Н. Модина, С.П. Вааль, В.Ю. Раевская // Клиническая стоматология. — 2011. — № 3. — С. 22 − 25. 71. Московский А.В., Шумский А.В. Клинико-иммунологические особенности осложненного кариеса в сочетании с пародонтитом // Российский стоматологический журнал. – 2007. – № 3. – С. 23 – 26. 72. Николаева, Е.Н. Молекулярно-генетические маркеры риска генерализованного пародонтита и их применение в диагностике: автореф. дис. … 125 д-ра мед. наук: 03.00.07, 14.00.36 / Елена Николаевна Николаева. – М., 2008. – 40 с. 73. Новикова, Е.Н. Применение современных форм хлоргексидинсодержащих препаратов в комплексном лечении пародонтита: автореф. дис. … д-ра мед. наук: 14.00.21 / Елена Николаевна Новикова. – М., 2004. – 45 с. 74. Образцов, Ю.Л. Стоматологическое здоровье: сущность, значение для качества жизни, критерии оценки / Ю.Л. Образцов // Стоматология. – 2006. - № 4. – С. 41 − 43. 75. Орехова, Л.Ю. Оценка эффективности применения новых средств гигиены серии Sensodyne при воспалительных заболеваниях пародонта /Л.Ю. Орехова, О.В. Прохорова, М.В. Осипова // Стоматологический журнал. – 2006. – № 4. – С.294 − 296. 76. Орехова, Л.Ю. Прогнозирование эффективности сложных лечебнопрофилактических программ- при воспалительных заболеваниях пародонта / Л.Ю. Орехова, М.В. Осипова // Пародонтология. − 2009. − №3. − С. 19 − 24. 77. Орехова, Л.Ю. Состояние органов полости рта и изменение тканевого кровотока слизистой оболочки полости рта у больных с хронической сердечной недостаточностью / Л.Ю. Орехова, М.Г. Рыбакова, А.А. Бармашева [и др.] // Стоматология. – 2013. – № 4. – С.23 − 25. 78. Папапаноу, П. Н. Связь пародонтита и атеросклероза сосудов: актуальные данные и значимость для специалистов и общества / П.Н. Папапаноу // Лечащий врач. – 2013. - № 7. – С. 44 − 48. 79. Прохончуков, А.А. Лечение заболеваний пародонта и слизистой оболочки рта с применением лазерного и магнито-лазерного облучения / А.А. Прохончуков, Л.А. Жижина, М.Л. Григорьянц [и др.] // Пародонтология. – 2008. – № 4. – С.36 — 42. 80. Ривс, Д. Системные последствия состояния полости рта: сердечнососудистые заболевания / Д. Ривс // Стоматолог. – 2007. – № 11. – С.26 − 29. 126 81. Сарсенбаева, А.С. Особенности Helicobacter pylori-инфекции и иммунного ответа при тяжелом течении язвенной болезни двенадцатиперстной кишки / А.С. Сарсенбаева // Журнал микробиологии. – 2005. – № 6. – С.73 − 75. 82. Сафонова, А.В. Ассоциации цитокинов с воспалительными заболеваниями аллелей генов пародонта у человека / А.В. Сафонова, А.Н. Петрин, С.Д. Арутюнов, В.Н. Царев // Acta Naturae. – 2011. – № 1. – С.133 − 139. 83. Сафонова, А.В. Клинико-генетические предикторы развития заболеваний пародонта: автореф. дис. … канд. мед. наук: 14.01.14, 03.02.07 / Анастасия Владимировна Сафонова. – М., 2012. – 23 с. 84.Симановская, О.Е. Влияние стоматологического здоровья на качество жизни / О.Е. Симановская // Стоматология. – 2008.–№5.– С.75 − 77. 85. Скочко, О.В. Роль некоторых пародонтопатогенных микроорганизмов и Asp299Gly полиморфизма гена TLR4 в патогенезе атеросклероза / О.В. Скочко, Н.А. Боброва, Измайлова, И.П. Кайдашев // Журнал микробиологии. – 2011. – № 5. – С.83 − 86. 86. Соловьева, А.М. Эпидемиологическое исследование распространенности пародонтопатогенной микрофлоры полости рта у населения России / А.М. Соловьева, С.К. Матело, А.А. Тотолян [и др.] // Стоматология. – 2005. – №5. – С. 14 – 20. 87. Сухова, Т.В. Особенности свободнорадикального окисления, антиоксидантной защиты и состояния нервной системы у больных хроническим генерализованным пародонтитом: автореф. дис. … канд. биол. наук: 03.00.04 / Татьяна Владимировна Сухова. – М., 2000. – 21 с. 88. Теблоева, Л.М. Распространенность, тяжесть, история заболевания пародонта / Л.М. Теблоева, Л.А. Дмитриева, К.Г. Гуревич // Российский стоматологический журнал. – 2011. – № 6. – С.44 − 45. 89.Тец, Г.В. Новые подходы к изучению условно-патогенных бактерий микрофлоры ротовой полости человека / Г.В. Тец, Д.С. Викина, М.Ф. Вечерковская [и др.] // Стоматология. – 2013. – № 1. – С.14 − 16. 127 90. Фролова, О.А. Новые подходы к диагностике пародонта в свете современной концепции их патогенеза: автореф. дис. … д-ра мед. наук: 14.00.21 / Ольга Александровна Фролова. – М., 2007. – 40 с. 91. Царев, В.Н. Выявление маркеров пародонтопатогенных бактерий у пациентов с инфекционным эндокардитом / В.Н. Царев, Е.Н. Николаева, Н.А. Саркисян // Российский стоматологический журнал. – 2009. – № 2. – С. 32 − 34. 92. Царев, В.Н. Роль микрофлоры полости рта в развитии инфекционного эндокардита / В.Н. Царев, М.А. Саркисян, С.Н. Крутова, Д.С. Ревазова // Стоматология для всех. – 2009. – № 2. – С. 18 − 21. 93. Царев, В.Н. Возможная роль микрофлоры полости рта в развитии инфекционного эндокардита / В.Н. Царев, М.А. Саркисян, Г.А. Шамсиев // Медицина критических состояний. – 2010. – № 1. – С. 11 − 15. 94. Царев, В.Н. Экспериментальное обоснование применения биополимерных пленок, содержащих препараты иммуномодулирующего и антибактериального действия для лечения заболеваний пародонта / В.Н. Царев, Е.Н. Николаев, Д.С. Арутюнов, Е.М. Фомичева // Пародонтология. − 2010. − № 1(54). − С. 57. 95. Царев, В.Н. Оценка амфихиральной природы распространения пародонтопатогенных бактерий у больных хроническим генерализованным пародонтитом / В.Н. Царев, Е.Н. Николаева, В.Н. Плескановская [и др.] // Российский стоматологический журнал. - 2011. - N 2. - С. 29 − 31. 96. Царев, В.Н. Цитокиновый профиль плазмы крови и десневой жидкости у жителей Дагестана при хроническом пародонтите / В.Н. Царев, С.Д. Арутюнов, Е.В. Ипполитов [и др.] // Российский стоматологический журнал. – 2012. – № 6. – С.18 − 22. 97. Цепов, Л.М. Заболевания пародонта: взгляд на проблему / Л.М. Цепов. – М.: МЕДпресс, 2006. – 192 с. 98. Цимбалистов, А.В. Клинико-морфологическая оценка состояния пародонта при патологии сердечно-сосудистой системы / А.В. Цимбалистов, А.Ф. 128 Елисеева, Г.Б. Шторина // Вестник Санкт-Петербургской медицинской академии последипломного образования. – 2011. – № 3. – С.58 − 60. 99. Шаповалов, В.Д. Апоптоз и ультраструктурные изменения плазматических клеток собственно слизистой десны больных пародонтитом / В.Д. Шаповалов, Л.М. Михалева, Т.Г. Бархина // Иммунология. – 2002. − № 2. – С. 83 − 87. 100. Шварц, Ю.Г. Взаимосвязь инфаркта миокарда и фибрилляции предсердий со стоматологической патологией: случайная находка? / Ю.Г. Шварц, Ю.Ю. Иващенко, О.В. Форстер, Е.В. Пархонюк // Международный медицинский журнал. – 2006. – № 1. – С.56 − 60. 101. Шмидт, Д.В. Цитокины десневой жидкости: их роль в патогенезе и контроле лечения хронического пародонтита: автореф. дис. … канд. мед. наук: 14.00.36, 14.00.21 / Дарья Валерьевна Шмидт. – Пермь, 2008. – 21 с. 102. Юдина, Н.А. Хроническая инфекция в ротовой полости и ишемическая болезнь сердца: возможные взаимосвязи и пути уменьшения влияния стоматологической патологии на развитие и прогрессирование ИБС / Н.А. Юдина, П.А. Леус // Стоматологический журнал. – 2008. - № 2. – С.24 − 29. 103. Ялчин, Ф. Заболевания пародонта и общее здоровье: существует ли взаимосвязь? / Ф. Ялчин // Лечащий врач. – 2013. – № 3. – С.77 − 78. 104. Янушевич О.О. Стоматологическая заболеваемость населения России / О.О. Янушевич. — М.: МГМСУ, 2009. − 228 с. 105. Янушевич, О.О. Пародонтит XXI век / О.О. Янушевич, Л.А. Дмитриева, А.И. Грудянов. – М., 2012. – 186 с. 106. Яров, Ю.Ю. Состояние местного иммунитета полости рта у больных с разными уровнями гигиены полости рта / Ю.Ю. Яров, А.В.Мельник // Український стоматологічний альманах. – 2013. - № 4. – С. 25 − 28. 107. Стоматологический статус. Уровень стоматологической гигиены [электронный ресурс]// Современная медицина Dommedika URL:http://dommedika.com/ stomatologia /95.html (дата обращения: 19.01.2015). 129 108. Adiloglu, A.K. Detection of Helicobacter pylori and Chlamydia pneumoniae DNA in human coronary arteries and evaluation of the results with serologic evidence of inflammation /A.K. Adiloglu, A. Ocal., R.Can [et al.] // Saudi Med J. – 2005. – Vol.26, № 7. – P.1068 − 1074. 109. Al-Zahrani, M.S. Periodontitis and cardiovascular disease: a review of shared risk factors and new findings supporting a causality hypothesis / M.S.Al-Zahrani, R.A. Kayal, N.F. Bissada // Quint Int. – 2006. – Vol.37, № 1. – P.11—18. 110. Amano, A. Host membrane trafficking for conveyance of intracellular oral pathogens // A. Amano, N. Furuta, K. Tsuda // Periodontol. – 2010. – Vol. 52 (1). – P.84 − 93. 111. Ambili, R. Viruses: are they really culprits for periodontal disease? A critical review / R. Ambili, C. Preeja, V. Archana [et al.] // J. Investig. Clin. Dent. – 2013. – Doi: 10.1111/ jicd.12029. 112. Andersen, R. Treatment of periodontal disease by photodisinfection compared to scaling and root planning / R. Andersen, N. Loebel, D. Hammond [et al.] // J. Clin. Dent. – 2007. – Vol.18, № 2. – P.34 − 38. 113. Anand P.S. Are dental plaque, poor oral hygiene, and periodontal disease associated with Helicobacter pylori infection? / P.S. Anand, K. Nandakumar, K.T. Shenoy // J. Periodontol. − 2006. − Vol.77, №4. − P. 692 − 698. 114. Arancibia, R. Effects of chitosan particles in periodontal pathogens and gingival fibroblasts / R. Arancibia, C. Maturana, D. Silva [et al.] // Journal of Dental Research. – 2013. – Vol.92, № 8. – P.740 − 745. 115. Armitage, G.C. Periodontal infections and cardiovascular disease-how strong is the association? / G.C. Armitage // Oral Diseases. – 2000. – Vol.6, № 6. – P.335 − 350. 116. Auerkari, E. CRP and IL-1β Gene Polymorphisms and CRP in Blood in Periodontal Disease / E. Auerkari, A. Suhartono, N. Djamal [et al.] // The Open Dentistry Journal. – 2013. – Vol.26, № 7. – P.88 − 93. 130 117. Ayazi, G. Analysis of interleukin-1β gene polymorphism and its association with generalized aggressive periodontitis disease / G. Ayazi, M. Pirayesh, K. Yari // DNA and Cell Biology. – 2013. – Vol.32, № 7. – P.409—413. 118. Axelson, P. Periodontal disease. Diagnosis and risk prediction / P. Axelson. – Chicago: Quintessence, 2002. – Vol.3. – P.95 − 119. 119. Behl, Y. Activation of the acquired immune response reduces coupled bone formation in response to a periodontal pathogen // Y. Behl, M. Siquiera, J. Ortiz [et al.] // J. Immunol. – 2008. – Vol.182, № 12. – P.8711 − 8718. 120. Beikler, T. Specific antibiotics in the treatment of periodontitis – a proposed strategy / T. Beikler, K. Prior, B. Ehmke, T.F. Flemming // J. Periodontol. – 2004. – Vol.74, № 1. – P.169 − 175. 121. Boyd, T. Reduction of VSC and salivary bacteria by a multibenefit mouthrinse / T. Boyd, J. Vazquez, M. Williams // Journal of Breath Research. – 2008. – Vol.2, № 1. – doi: 10.1088/1752-7155/2/1/017013. 122. Braham, P. Antimicrobial photodynamic therapy may promote periodontal healing through multiple mechanisms / P. Praham, C. Herron, C. Street [et al.] // J. Periodontol. – 2009. – Vol.80, № 11. – P.1790 − 1798. 123. Bratel, J. Treatment of oral infections prior to heart valve surgery does not improve long-term survival / J. Bratel, C. Kennergren, L. Dernevik, M. Hakeberg // Swed Dent. J. 2011. – Vol.35, № 2. – P.49 − 55. 124. Bredetean, O. The neutrophil in human pathology / O. Bredetean, A.D. Ciochina, O.C. Mungiu // Rev. Med. Chir. Soc. Med. Nat. Iasi. – 2007. – Vol.111, № 2. – P.446 − 453. 125. Contreras, A. Herpesviruses in HIV-periodontitis / A. Contreras, A. Mardirossan, J. Slots // J. Periodontol. – 2001. – Vol.28. – P. 96 − 102. 126. Cullinan, M.P. Acquisition and loss of Porphyromonas gingivalis, Actinobacillus actinomycetemcomitans and Prevotella intermedia over a 5-year period: effect of a triclosan/copolymer dentifrice / M.P. Cullinan, S.M. Hamlet, B. Westerman [et al.] // J Clin Periodontol. – 2003. – Vol.30, № 6. – P.532 − 541. 131 127. De Nardin, E. The role of inflammatory and immunological mediators in periodontitis and cardiovascular disease / E. De Nardin // Ann. Periodontol. – 2001. – Vol.6, № 1. – P.30 − 40. 128. Demmer, R.T. Bleeding on Plobing Differentially Relates to Bacterial Profiles / R.T. Demmer, P.N. Papapanou, D.R. Jacobs, M. Desvarieux // J. Clin. Periodontol. – 2008. – Vol.35, № 6. – P.479 − 486. 129. Desvarieux, M. Gender differences in the relationship between periodontal disease, tooth loss, and atherosclerosis / M. Desvarieux, C. Schwahn, H. Vilzke [et al.] // Stroke. – 2004. – Vol.35, № 9. – P.2029 − 2035. 130. Develioglu, H. Evalution of the marginal gingival health using laser Doppler flowmetry / H. Develioglu, B. Kesim, A. Tuncel // Braz. Dent. J. – 2006. – Vol.17, № 3. – P.219 − 222. 131. Diehl, S. R. Evidence of substaintial genetic basis for IgG2 levels in familias with aggressive periodontitis / S. R. Diehl [et al.] // J. Dent. Res. - 2003. - Vol. 82. - P. 708 − 712. 132. Diomedi, M. The role of chronic infection and inflammation in the pathogenesis of cardiovascular and cerebrovascular disease / M. Diomedi, G. Leone, A. Renna // Timely Top Med Cardiovasc. Dis. – 2005. – Vol.41, № 11. – P. 745 – 753. 133. Domínguez, A. IL-1beta, TNF-alpha, total antioxidative status and microbiological findings in chronic periodontitis treated with fluorescence-controlled Er:YAG laser radiation / A. Domínguez, C. Gómez, A.I. García-Kass, J.A. GarcíaNuñez // Lasers Surg. Med. – 2010. – Vol.42, № 1. – P.24 − 31. 134. Donati, M. Association of the -159 CD14 gene polymorphism and lack of association of the -308 TNFA and Q551R IL-4RA polymorphisms with severe chronic periodontitis in Swedish / M. Donati, T. Berglundh, A.M. Hytonen [et al.] // J. Clin. Periodontol. – 2005. – Vol.32. – P.474 − 479. 135. Duarte, P.M. Differential cytokine expressions affect the severity of periimplant disease // P.M. Duarte, A.C. de Mendonça, M.B. Máximo [et al.] // Clin. Oral. Implants. Res. – 2009. – Vol.20, № 5. – P.514—520. 132 136. Dumitrescu, A.L. Antibiotics and antiseptics in periodontal therapy / A.L. Dumitrescu. – New York: Springer, 2011. – 189 p. 137. Ebadian, A.R. Gene Polymorphisms of TNF-α and IL-1β Are Not Associated with Generalized AggressivePeriodontitis in an Iranian Subpopulation / A.R. Ebadian, M. Radvar, J. Tavakkol Afshari [et al.] // Iran. J. Allergy Asthma Immunol. – 2013. – Vol.12, № 4. – P.345 − 351. 138. Eick, S. Pathogen and resistance spectrum in intraoral infections of the jawfacial area with special reference to anaerobic bacteria / S. Eick, W. Pfister, S. KornStemme [et al.] // Mund. Kiefer. Gesichtschir. – 2000. – Vol.4, № 4. – P.234 − 239. 139. Eke, P.I. Prevalence of periodontitis in adults in the United States: 2009 and 2010 / P.I. Eke, B.A. Dye, L. Wei [et al.] // J. Dent. Res. – 2012. – Vol.91, № 10. – P.914 − 920. 140. Feng, Z. Role of bacteria in health and disease of periodontal tissues / Z. Feng, A. Weinberg // Periodontology. – 2006. – Vol.40, № 1. – P.50 − 76. 141. Firatli, E. Generalized prepubertal periodontitis. A report of 4 cases with the immunological findings / E. Firatli, A. Gurel, A. Efeoglu, I. Cebeci // Clinical Periodontol. – 1996. – Vol.23, № 12. – P.1104 − 111. 142. Fong, I.W. Emerging relations between infectious diseases and coronary artery disease and atherosclerosis / I.W. Fong // CMAJ. – 2000. VOL.163, №1. – P. 49 − 56. 143. Ford, P.J. Cross-reactivity of GroFL antibodies with human heat shock protein 60 and quantification of pathogens in atherosclerosis P.J. Ford, E. Gemmel, S.M. Hamlet [et al.] // Oral. Microbiol. Immunol. – 2005. – Vol.20, № 5. – P. 296 − 302. 144. Franceschi, F. Helicobacter pylori infection and ischaemic heart disease: an overview of the general literature / F. Franceschi, D. Leo, L. Fini [et al.] // Dig. Liver Dis. – 2005. – Vol.37, № 5. – P.301 − 308. 145. Friendlander, A.H. Metabolic syndrome: Phathofenesis, medical care and dental applications / A.H. Friendlander, J. Weinrab, I. Freindlander, J.A. Yagela // J. Am. Dent. Assoc. – 2007. – Vol.138. – P.179 − 185. 133 146. Fujinaka, H. Relationship of periodontal clinical parameters with bacterial composition in human dental plaque / H. Fujinaka, T. Takeshita, H. Sato [et al.] // Arch. Microbiol. – 2013. – Vol.195, № 6. – P.371 − 383. 147. Gaffar, A. The effect of triclosan on mediators of gingival inflammation / A. Gaffar, D. Scherl, J. Afflitto, E.J. Coleman // J. Clin. Periodontol. – 1995. – Vol.22, № 6. – P.480 − 484. 148. Gamonal, J. Levels of interleukin-beta, -8, and -10 and RANTES in gingival reticular fluid and cell populations in adult periodontitis patients and the effect of periodontal treatment / J. Gamonal, A. Acevedo, A. Bascones [et al.] // J. Periodontol. – 2000. – Vol.71, № 10. – P.1535 − 1545. 149. Geerts, S.O. Systemic release of endotoxins induced by gentle mastication: association with periodontitis severity / S.O. Geerts, M. Nys, M.P. De [et al.] // J. Periodontol.- 2002. – Vol.73, № 1. – P.73 − 78. 150. Gemmell, E. Destructive periodontitis lesions are determined by the nature of the lymphocytic response / E. Gemmell, K. Yamazaki, G.J. Seymour // Crit. Rev. Oral Biol. Med. – 2002. – Vol.13. – P.17 − 34. 151. Gemmell, E. Mast cells in human periodontal disease / E. Gemmell, C.L. Carter, G.J. Seymour // J. Dent Res. – 2004. – Vol.83, № 5. – P.384 − 387. 152. Gonzales, J.R. Single-nucleotide polymorphisms in the IL-4 and IL-13 promoter region in aggressive periodontitis / J.R. Gonzales, M. Mann, J. Stelzig [et al.] // J. Clin. Periodontol. – 2007. – Vol.34. – P.473 − 479. 153. Goutoudi, P. Effect of periodontal therapy on crevicular fluid interleukin1beta and interleukin-10 levels in chronic periodontitis / P. Goutoudi, E. Diza, M. Arvanitidou // J. Dent. – 2004. – Vol.32, № 7. – P.511 − 520. 154. Grau, A.J. Periodontal disease as a risk factor for ischemic stroke / A.J. Grau, H. Becher, C. Zeigler [et al.] // Stroke. – 2004. – Vol.35. – P.496 − 501. 155. Grau, A.J. Role of Anti-infective Strategies in the Prevention of Stroke / A.J. Grau // Curr. Treat. Options. Cardiovasc. Med. – 2005. – Vol.7., № 3. – P.187 − 195. 156. Greenstein, G. Periodontal response to mechanical non-surgical therapy: a review / G. Greenstein, A. Polson // J/ Periodontol. – 2009. – Vol.63. – P.118 − 130. 134 157. Grudianov, A.I. The blood immunological indices in rapidly progressing periodontitis (preliminary results) / A.I. Grudianov, I.V. Bezrukova // Stomatologiia. – 2000. – Vol.79, № 3. – P.15 − 17. 158. Haffajee, A.D. Intraduction to microbial aspects of periodontal biofilm communities, development and treatment / A.D. Haffajee, S.S. Socransky // J. Periodontol. – 2006. – Vol.42, № 3. – P.7 − 12. 159. Haraszthy, V.I. Обнаружение пародонтальных патогенов в атероклеротических бляшках / V.I. Haraszthy, J.J. Zambon, M. Trevisan [et al.] // J. Periodontol. – 2000. – Vol.71, № 10. – P.1554 − 1560. 160. Hart T. C. Genetic factors in the pathogenesis of periodontitis / T. C. Hart, K. S. Kornman // Periodontol 2000. – 1997. - Vol. 14. - P. 202 − 215. 161. Hoffman, T. Clinical controlled study on plaque and gingivitis reduction under long-term use of low-dose chlorhexidine solutions in a population exhibiting good oral hygiene / T. Hoffman, G. Bruhn, S. Richter [et al.] // Clin. Oral Invest. – 2001. – Vol.5, № 1. – P.89—95. 162. Jeftha, A. Periodontitis and cardiovascular disease / A. Jeftha, H. Holmes // SADJ. – 2013. – Vol.68, № 2. – P.62 − 63. 163. Kinane, D.F. Periodontal manifestations of systemic disease / D.F Kinane, G.J. Marshall // Aust. Dent. J. – 2001. – Vol.46, № 1. – P.2 − 12. 164. Kinane, D.F. Host-response: understanding the cellular and molecular mechanisms of host-microbial interactions--consensus of the Seventh European Workshop on Periodontology / D.F. Kinane, P.M. Preshaw, B.G. Loos // J Clin Periodontol. – 2011. – Vol.38, Suppl. 11. – P.44 − 48. 165. Kornman, K.S. Candidate genes as potential links between periodontal and cardiovascular diseases / K.S. Kornman, G.W. Duff // Ann. Periodontol. – 2001. Vol.6, № 1. – P.48—57. 166.Kuramitsu, H.K. Role for periodontal bacteria in cardiovascular disease / H.K. Kuramitsu, M. Qi, I.C. Kang [et al.] // Annals of periodontology. – 2001. – № 6. – P.41 − 47. 135 167. Kurdowska, A.K. Interleukin-8 and anti-interleukin-8 autoantibodies in gingival crevicular fluid from patients with periodontitis / A.K. Kurdowska, J.M. Noble, J.E. Adcock // J. Periodontal. Res. – 2003. – Vol.38, № 1. – P.73 − 78. 168. Lappin, D.F. Relative proportions of mononuclear cell types in periodontal lesions analyzed by immunohistochemistry / D.F. Lappin, O. Koulouri, M. Radvar [et al.] // J. Clin. Periodontol. – 1999. – Vol.26, № 3. – P.183 − 189. 169. Lindhe, J. Clinical periodontology and implant dentistry / J. Lindhe, N.P. Lang, T. Karring. − UK: Wiley-Blackwell, 2008. – 1340p. 170. Lu, S.Y. Bacteriological analysis of sub gingival plaque in adolescents / S.Y. Lu, Q. Shi, S.H. Yang // Hua Xi Kou Qiang Yi Xue Za Zhi.- 2008. – Vol.43, № 12. – P.737 − 740. 171. Luis-Delgado, O. Periodontitis as a risk factor in patients with ischemic heart disease / O. Luis-Delgado, J.J. Echevarria-Garcia, L. Berini-Aytes, C. Gay-Escoda // Med. Oral. – 2004. – Vol.9, № 2. – P.125 − 137. 172. Lund, H. Antibody levels to single bacteria or in combination evaluated against myocardial infraction / H. Lund, I. Olsen, P. Nafstad [et al.] // J. Clin. Periodontol. – 2008. – Vol.35. – P.473—478. 173. Madianos, P.N. Is periodontitis associated with an increased risk of coronary heart disease and preterm and/or low birth weight births? / P.N. Madianos, G.A. Bobetsis, D.F. Kinane // J. Clin. Periodontol. – 2002. – Vol.29, Suppl. 3. – P.22 − 36. 174. Malik, R. Photodynamic therapy – a strategic review / R. Malik, A. Manocha, D.K. Suresh // Indian. J. Dent. Res. – 2010. – Vol.21. – P.285 − 291. 175. Marazita, M. L. Evidence for autosomal dominant inheritance and raceshecific heterogeneity in early-onset periodontitis / M. L. Marazita [et al.] // J. Periodontol. - 1994. - Vol. 65. − P. 62 176. Masaka, T. Solute CD14-dependent intercellular adhesion molecular-1 induction by Porphyromonas gingivalis lipopolysaccharide in human gingival fibroblasts / T. Masaka, J. Hayashi, I. Ishikawa // J. Periodontol. – 1999. – Vol.70, № 7. – P.772 − 778. 136 177. Mattila, K.J. Age, dental infection, and coronary heart disease / K.J. Mattila, S. Asikainen, J. Wolf [et al.] // J. Dent. Res. – 2000. – Vol.79. – P.756—760. 178. Mattila, K.J. Dental infections and cardiovascular diseases: a review / K.J. Mattila, P.J. Pussinen, S. Paju // J. Periodontol. – 2005. – Vol.76, № 11. – Suppl.: 2085—2088. 179. Meurman, J.H. Oral health, atherosclerosis and cardiovascular disease / J.H. Meurman, M. Sanz, S.J. Janket // Crit. Rev. Oral Biol. Med. – 2004. – Vol.15, № 6. – P.403—413. 180. Michalowicz, B. S. Evidence of a substaintial genetic basis for risk of adult periodontitis / B. S. Michalowicz [et al.] // J. Periodontol. - 2000. - Vol. 71. - P. 1699 1707. 181. Mineoka, T. Site-specific development of periodontal disease is associated with increased levels of Porphyromonas gingivalis, Treponema denticola, and Tannerella forsythia in subgingival plaque / T. Mineoka, S. Awano, T. Rikimaru [et al.] // J. Periodontol. – 2008. – Vol.79, № 4. – P.670—676. 182. Mitchell, H.L. Treponema denticola biofilm-induced expression of a bacteriophage, toxin-antitoxin systems and transposases / H.L. Mirchell, S.G. Dashper // Micribiology. – 2010. – Vol.156. – P.774—788. 183. Moutsopoulos, N.M. Porphyromonas gingivalis promotes Th17 inducing pathways in chronic periodontitis / N.M. Moutsopoulos, H.M. Kling, N. Angelov [et al.] // J. Autoimmun. – 2012. – Vol.39, № 4. – P.294—303. 184. Mupparapu, M. Periodontal disease prevalence in the United States: a paradigm shift towards the worse? /M. Mupparapu // Quintessence Int. – 2013. – Vol.44, № 2. – P.95—96. 185. Nakamura, Y. Prevalence of periodontitis and optimal timing of dental treatment in patients undergoing heart valve surgery / Y. Nakamura, O. Tagusari, Y. Seike [et al.] // Interact. Cardiovasc. Thorac. Surg. – 2011. - Vol.12, № 5. – P.696— 700. 137 186. Nibali, L. Interleukin-6 polymorphisms are associated with pathogenic bacteria in subjects with periodontitis / L. Nibali, M.S. Tonetti, D. Ready [et al.] // J. Periodontol. – 2008. – Vol.79, № 4. – P.677—683. 187. Orozco, A. Interleukin 18 and periodontal disease / A. Orozco, E. Gemmel, M. Bickel, G.J. Seymour // J. Dent Res. – 2007. – Vol.86, № 7. – P.586—593. 188. Ozawa, A. Expression of IL-2 receptor beta and gamma chains by human gingival fibroblasts and up-regulation of adhesion to neutrophils in response to IL-2 / A. Ozawa, H. Tada, R. Tamai [et al.] // J. Leukoc. Biol. – 2003. – Vol.74, № 3. – P.352— 359. 189. Pauschinger, M. Viral heart disease: molecular diagnosis, clinical prognosis, and treatment strategies / M. Pauschinger, K. Chandrasekharan, M. Noutsias [et al.] // Med. Microbiol. Immunol. – 2004. – Vol.193. – P.65—69. 190. Reichert, S. Interferon-gamma and interleukin-12 gene polymorphisms and their relation to aggressive and chronic periodontitis and key periodontal pathogens / S. Reichert, H.K.G. Machulla, J. Klapproth // J. Periodontol. – 2008. – Vol.79, № 8. – P.1434—1443. 191. Reynolds, H.Y. Modulating airway defenses against microbes / H.Y. Reynolds // Curr. Opin. Pulm. Med. – 2002. – Vol.8, № 3. – P.154—165. 192.Rezavandi, K. Expression of ICAM-1 and E-selecting in gingival tissues of smokers and non-smokers with periodontitis / K. Rezavandi, R.M. Palmer, E.W. Odell [et al.] // J. Oral Pathol. Med. – 2002. – Vol.31, № 1. – P.59—64. 193. Scarel-Caminaga, R.M. Investigation of an IL-2 polymorphism in patients with different levels of chronic periodontitis / R.M. Scarel-Caminaga, P.S. Trevillatto, A.P. Souza [et al.] // J. Clin. Periodontol. – 2002. – Vol.29. – P.587—591. 194. Schmidt, A.M. Advanced glycation endproducts (AGES) induce oxidant stress in the gingival: a potential mechanism underlying accelerated periodontal disease associated with diabetes / A.M. Schmidt, E. Weidman, E. Lalla [et al.] // J. Periodont. Res. – 1996. – Vol.31, № 7.- P.508—515. 195. Scott, D.A. Neutrophils in periodontal inflammation / D.A. Scott // Front Oral Biol. – 2012. – Vol.15. – P.56—83. 138 196. Seguier, S. Collagen fibers and inflammatory cells in healthy and diseased human gingival tissues: a comparative and quantitative study by immunohistochemistry and automated image analysis / S. Seguier, G. Godeau, N. Brousse // J. Periodontol. – 2000. – Vol.71, № 7. – P.1079—1085. 197. Seidel, B.M. Secretory IgA, free secretory component IgD in saliva of newborn infants / B.M. Seidel, S. Schubert, B. Schulze, M. Borte [et al.] // Early Hum. Dev. – 2001. – Vol.62, № 2. – P.159—164. 198. Seymour, R.A. Cardiovascular disease and periodontology / R.A. Seymour, P.M. Preshaw, J.M. Thomason [et al.] // J. Clin. Periodontol. – 2003. – Vol.30. – P.279—292. 199. Shangase, S.L. The association between periodontitis and systemic health: an overview / S.L. Shangase, G.U. Mohangi, S. Hassam-Essa, N.H. Wood // SADJ. – 2013. - Vol.68, № 1. – P.10—12. 200. Shay, K. Oral infections in the Elderly. Part I: Bacterial infections of the Mouth / K. Shay // Clinical Geriatrics. – 2006. – Vol.14. – P.36—45. 201. Shusterman, M.A. The free transverse rectus abdomens musculocutaneous flap for breast reconstruction: one centers experience with 211 consecutive cases / M.A. Shusterman, S.S. Kroll, M.J. Miller // Ann. Plast. Surg. – 1994. – Vol.32. – P.234—242. 202.Simonson, L.G. Bacterial synergy of Treponemadenticola and Porphyromonasgingivalis in a multinational population / L.G. Simonson, K.T. McMahon, D.W. Childers, H.E. Morton // Oral Microbiol. Immunol. – 1992. – № 7. – P.111—112. 203. Slots, J. Periodontology: past, present, perspectives / J. Slots // Periodontol. – 2013. – Vol.62, № 1. – P.7—19. 204. Suresh, S. Evalution of anti-inflammatory effect of statins in chronic periodontitis / S. Suresh, S. Narayana, P. Jayakumar [et al.] // Indian J. Pharmacol. – 2013. – Vol.45, № 4. – P.391—394. 139 205. Suzuki, T. Presence of activated eosinophils, high IgE and sCD23 titers in gingival crevicular fluid of patients with adult periodontitis / T. Suzuki, N. Sugita, H. Yoshie, K. Hara // J. Periodontal. Res. – 1995. – Vol.30, № 3. – P.159—166. 206. Taba, M. Jr. Periodontal disease: a genetic perspective / M.Jr. Taba, S.L. Souza, V.C. Mariguela // Braz. Oral. Res. – 2012. – Suppl. 1. – P.32—38. 207. Taguchi, A. Association between Oral Health and the Risk of Lacunar Infarction in Japanese Adults // A. Taguchi, M. Miki, A. Muto [et al.] // Gerontology. – 2013. – Vol. 59, № 6. – P. 499 – 506. 208. Takahashi, K. Studies on the phenotypic and functional characterization of peripheral blood lymphocytes from patients with early-onset periodontitis / K. Takahashi, A. Nagai, N. Saton [et al.] // J. Periodontol. – 1995. – Vol.66, № 5. – P.391—396. 209. Takeda, K. Toll-like receptors in innate immunity / K. Takeda, S. Akira // In/ Int. Immunol. – 2005. – Vol.17. – P.1—14. 210. Tervonen, T. Polymorphisms in the CD14 and IL-6 genes associated with periodontal disease / T. Tervonen, T. Raunio, M. Knuuttila, R. Karttunen // J. Clin. Periodontol. – 2007. – Vol.34. – P.377—383. 211. Thornton-Evans, G. Periodontitis among adults aged ≥30 years - United States, 2009-2010 / G. Thornton-Evans, P. Eke, L.Wei [et al.] // MMWR Surveill. Summ. – 2013. – Suppl. 3. – 129—135. 212. Tonetti, M.S. Periodontitis and risk for atherosclerosis: an update on intervention trials / M.S. Tonetti // J. Clin. Periodontol. – 2009. – Suppl.10. – P.9—15. 213. Tonetti, M.S. Periodontitis and atherosclerotic cardiovascular disease: consensus report of the Joint EFP/AAP Workshop on Periodontitis and Systemic Diseases / M.S. Tonetti, T.E. Van Dyke // J. Periodontol. – 2013. – Vol.84, № 4. – P. 24 − 29. 214. Tribble, G.D. Genetic diversity in the oral pathogen Porphyromonas gingivalis: molecular mechanisms and biological consequences / G.D. Tribble, J.E. Kerr, B.Y. Wang // Future Microbiol. – 2013. – Vol.8, № 5. – P.607 − 620. 140 215. Trombelli, L. Response to a plaque control regimen on different levels of gingival inflammation / L. Trombelli, S. Bottega, E. Orlandini [et al.] // Minerva Stomatol. – 2003. – Vol.52, № 3. – P.75 − 79. 216.Tsai, C.C. Changes in gingival crevicular fluid interleukin-4 and interferongamma in patients with chronic periodontitis before and after periodontal initial therapy / C.C.Tsai, C.H. Ku, Y.P. Ho [et al.] // Kaohsiung. J. Med. Sci. – 2007. – Vol.23, № 1. – P.1—7. 217. Van Dyke, T.E. Risk factors for periodontitis / T.E. Van Dyke, D. Sheilesh // J. Int. Acad Periodontol. – 2005. – Vol.7, № 1. – P.3—7. 218. Wallace, M.C. The 48-month increment of root caries in an urban population of older adults participating in a preventive dental program / M.C. Wallace, D.H. Retief, E.L. Bradley // J. Public. Health. Dent. – 1993. – Vol.53, № 3. – P.133—137. 219. Wang, G. Role for Porphyromonas gingvalis in the progression of atherosclerosis / G. Wang, X. Zhou, D. Huag // Med. Hypotheses. – 2009. – Vol.72, № 1. – P.3—71. 220. Williams, M.I. Clinical efficacy of Colgate 360 degrees and three commercially available toothbrushes on the removal of desquamated epithelial cells / M.I. Williams, J. Vazquez, D. Cummins // Compend. Contin. Educ. Dent. – 2004. – Vol.25. – P.12—16. 221. Wilson, T.G. Fundamentals or periodontics / T.G. Wilson, K.S. Kornman. – Tokyo: Quintessence Publishing Co, 1996. – 564 p. 222. Wisniewska-Spychala, B. Dentigenous infectious foci – a risk factor of infective endocarditis / B. Wisniewska-Spychala, J. Sokalski, S. Grajek [et al.] // Med. Sci. Monit. – 2012. – Vol.18, № 2. – P.93—104. 223. Wolf, H.F. Parodontology / H.E. Wolf, M. Edith, K. Rateitschak. – Georg Thieme Verlag, 2004. – 548 p. 224. Wozakowska-Kaplon, B. Oral health status and the occurrence and clinical course of myocardial infarction in hospital phase: A case-control study / B. Wozakowska-Kaplon, M. Wosowicz, I. Gorczyca-Michta, R. Gorska // Cardiol. J. – 2013. – Vol.20, № 4. – P.370—377. 141 225. Xu, T. Effectiveness of a triclosan/copolymer dentifrice on microbiological and inflammatory parameters / T. Xu, M. Deshmukh, V.M. Barnes [et al.] // Compend. Contin. Educ. Dent. – 2004. – Vol25, № 7. – P.46—53. 226. Yasny, J.S. Dental considerations for cardiac surgery / J.S. Yasny, J. White // J. Card. Surg. – 2009. – Vol.24, № 1. – P.64—68. 227. Zaremba, M. Evalution of the incidence of periodontitis-associated bacteria in the atherosclerotic plaque of coronary blood vessels / M. Zaremba, R. Corska. P. Suwalski [et at.] // J. Priodontol. – 2007. – Vol.78, № 2. – P.322—327. 228. Zhou, T. Distribution of five periodontal pathogens in subgingival plaque in chronic periodontitis / T. Zhou, Y.Xu, Y. Ding, H. Zhao // Hua Xi Kou Qiang Yi Xue Za Zhi. – 2007. – Vol.25,№ 5. – P.470—473. 142 Список иллюстрированного материала Таблица 1 – Распределение пациентов в исследуемых группах по возрастным диапазонам…………………………………………………………………………….36 Таблица 2 – Критерии оценки метода Грина - Вермиллиона (OHI-S) ……………39 Рисунок 1 - Выделенные культуры на агаре Шедлера …………………………….51 Рисунок 2 – Прибор MALDI Biotyper и металлическая мишень ………………. ...51 Рисунок 3 – Структура исследуемых групп по возрасту (%) ………………….......59 Таблица 3 – Частота перенесенных ранее острых ишемических заболеваний у пациентов в исследуемых группах ………………………………………………… 60 Таблица 4 – Частота сопутствующей патологии у пациентов в исследуемых группах ………………………………………………………………………………. 60 Таблица 5 – Сравнение частоты курильщиков среди пациентов в исследуемых группах …………………………………………………………...................................61 Таблица 6 – Частота пациентов с пародонтитом легкой и средней степени тяжести в первой и второй группах …………………………………………………………...63 Рисунок 4 – Структура первой и второй группы исследуемых по степени тяжести пародонтита ………………………………………………………………...................64 Таблица 7 – Сравнение значений индекса Грин-Вермильон в исследуемых группах на разных этапах стационарного лечения ……………………………….. 65 Рисунок 5 – Средние уровни индекса Грин-Вермильон в исследуемых группах на разных этапах стационарного лечения ……………………………………………..66 Таблица 8 – Средние значение индекса кровоточивости в исследуемых группах на разных этапах стационарного лечения ……………………………………………...67 Рисунок 6 – Средние уровни индекса кровоточивости в исследуемых …………. 68 Таблица 9– Средние значений индекса РМА (%) в исследуемых группах на разных этапах стационарного лечения ……………………………………………. 69 Рисунок 7 – Средние уровни индекса PMA в исследуемых группах на разных этапах стационарно лечения ………………………………………………………... 69 Таблица 10 – Средние значение индекса PI в исследуемых группах на разных этапах стационарного лечения ……………………………………………………. ..70 143 Рисунок 8 Средние уровни индекса PI в исследуемых группах на разных этапах стационарно лечения ………………………………………………………………. ..71 Таблица 11 – Распределение пациентов по степени подвижности зубов ………...72 Таблица 12 – Глубина пародонтального кармана (мм) у исследуемых в зависимости от применения профилактики и этапов лечения …………………… 73 Рисунок 9 – Средние значения глубины пародонтального кармана в первой и второй группах на разных этапах стационарного лечения (мм) …………………. 73 Таблица 13 – Средние уровни обсемененности микрофлорой полости рта в контрольной группе на разных этапах стационарного лечения …………………. 77 Таблица 14 – Средний уровень обсемененности анаэробной микрофлорой полости рта в зависимости от проведения профилактики …………………………………. 78 Таблица 15 – Статистический анализ изменений содержания анаэробных МО в полости рта на разных этапах стационарного лечения …………………………… 80 Таблица 16 – Оценка значимости различий уровней обсемененности анаэробной микрофлорой полости рта в зависимости от проведения профилактики заболеваний пародонта ……………………………………………………………... 81 Рисунок 10 – Изменения среднего уровня содержания пародонтопатогенных микроорганизмов на разных этапах стационарного лечения при проведении профилактики пародонтита ………………………………………………………… 82 Таблица 17– Средний уровень обсемененности аэробной микрофлорой полости рта в зависимости от проведения профилактики …………………… …………….83 Таблица 18 – Статистический анализ изменений содержания анаэробных МО в полости рта на разных этапах стационарного лечения ……………………………84 Таблица 19 – Результаты сравнения средних уровней обсемененности аэробными микроорганизмами между первой и второй группами …………………………… 85 Таблица 20 – Динамика иммунологических показателей у пациентов контрольной группы на разных этапах стационарного лечения, % ……………………………. 86 Таблица 21 – Средние значения иммунологических показателей у пациентов с пародонтитом на разных этапах стационарного лечения, % ……………………. 88 144 Таблица 22– Оценка изменений уровня секреторного IgA в процессе стационарного лечения в контрольной группе, мг/мл …………………………… 90 Таблица 23 – Оценка изменений уровня секреторного IgA в процессе стационарного лечения в зависимости от применения профилактики, мг/мл…………………………………………………………………………………..91 Рисунок 11 – Динамика содержания секреторного IgA в слюне пациентов в исследуемых группах на разных этапах стационарного лечения …………………92 Таблица 24 – Среднее количество лейкоцитов (109 л-1) в крови исследуемых на разных этапах стационарного лечения ……………………………………………...92 Рисунок 12 – Средние уровни содержания лейкоцитов в периферической крови пациентов исследуемых групп на разных этапах лечения (109 л-1) ……………...93 Таблица 25 – Средние показатели состава лейкоформулы (в %) в исследуемых группах на разных этапах стационарного лечения ………………………………..94 Рисунок 13 – Изменения содержания клеток в лейкоформуле в контрольной группе на протяжении стационарного лечения ……………………………………95 Таблица 26 – Средние показатели состава лейкоформулы (в %) у пациентов с пародонтитом на разных этапах стационарного лечения ………………………….95 Таблица 27 – Результаты классификации пациентов, нуждающихся в аортокоронарном шунтировании, по признаку наличия ХГП …………………….97 145 ПРИЛОЖЕНИЯ ПРИЛОЖЕНИЕ 1 ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА С ФОРМОЙ ИНФОМИРОВАННОГО СОГЛАСИЯ НА УЧАСТИЕ В КЛИНИЧЕСКОМ ИССЛЕДОВАНИИ Название: «Клиническое и диагностическое значение оценки стоматологического статуса у пациентов после коронарного шунтирования». Исследователь: Василевская Елена Михайловна Вас приглашают принять участие в научном исследовании, посвященном исследованию рисков развития заболеваний пародонта после коронарного шунтирования. Однако прежде чем Вы согласитесь, Вам необходимо прочитать следующее. В этом документе описаны цели, процедуры, возможные неудобства, связанные с участием в исследовании. После прочтения задайте вопросы, которые у Вас могли возникнуть, чтобы, прежде чем Вы подпишите и датируете этот бланк, Вы могли убедиться, что включает в себя Ваше участие в этом исследовании. Вы можете забрать домой неподписанный экземпляр данной формы, чтобы подумать или обсудить ее с членами семьи или друзьями, до того, как Вы примете окончательное решение. Описание и цели исследования: В исследование планируется включить пациентов, идущих на кардиохирургические операции, а в частности коронарное шунтирование. Распространенность заболеваний пародонта чрезвычайно велика как в развитых, так и в развивающихся странах, и имеет устойчивую тенденцию к повышению. Заболевания сердечно-сосудистой системы являются ведущей причиной смертности и инвалидности во всем мире. 146 Установлена тесная связь патологии пародонта с общими заболеваниями организма, особое место среди которых занимает сердечно-сосудистая патология, и в частности ишемическая болезнь сердца. Доказана ведущая роль бактериальной бляшки в развитии заболеваний пародонта и возможного поражения сердечно-сосудистой системы. В ходе роста бактериальной пленки пласты микроорганизмов могут отрываться и попадать в кровеносное русло, что приводит к снижению резистентности организма к системным заболеваниям. В настоящее время методы стоматологической реабилитации больных, страдающих сердечно-сосудистыми заболеваниями, перенесших кардиохирургические операции, а также особенности стоматологической помощи до и в раннем послеоперационном периоде исследуемой категории больных в отечественной и зарубежной литературе освещены крайне незначительно. Проведение исследования: В исследование будут включены 144 пациента с ИБС, нуждающихся в коронарном шунтировании. В ходе исследования будет предложено проведение комплексного обследования: включающего сбор жалоб, анамнеза жизни и заболевания, изучение стоматологических (пародонтологических) индексов, исследование различных показателей крови и слюны с их последующей обработкой и интерпретацией. Показатели крови будут браться в момент поступления в больницу и после проведения операции на 4-5 день. Вам необходимо знать, что для взятия образцов крови необходимо введение иглы в вену. Данная процедура может сопровождаться болезненностью, образованием «синяка» и припухлости в месте введения иглы и/или головокружением. Существует небольшой риск инфицирования в месте укола. Весь биологический материал будет взят в рамках общего обследования, дополнительного забора материала для исследования забираться не будет. Всем пациентам будут проводиться профилактические мероприятия по гигиене полости рта и использовании препаратов, обладающих 147 противовоспалительным и антимикробным действием, для устранения прогрессирования процесса. Целью работы является повышение эффективности диагностики и профилактики воспалительных заболеваний пародонта у пациентов после коронарного шунтирования. Участие в данном исследовании является добровольным. Вы можете отказаться участвовать в исследовании, и Ваш отказ никак не повлияет на Ваше дальнейшее ведение, без последствий и утраты возможных преимуществ. В любое время прекратить Ваше участие в исследовании может врачисследователь. Конфиденциальность: Информация, полученная лично от Вас в ходе этого исследования, останется конфиденциальной. ограничиваться законодательством, Доступ к Вашим уполномоченным рекомендациями медицинским персоналом и документам в будет соответствии стандартами с профессиональной деонтологии. Результаты данного исследования могут быть опубликованы на научных собраниях и в публикациях, информация так же может быть предоставлена государственным официальным инстанциям – в любом случае без указания на Вашу личность. По Вашему желанию результаты обследований могут быть предоставлены какому-либо из наблюдающих Вас в повседневной практике врачей. Согласие: Я ______________________________________________ прочитал (а) информацию о научном исследовании «Клиническое и диагностическое значение оценки стоматологического статуса у пациентов после коронарного шунтирования» и я согласен (а) в нем участвовать. У меня было достаточно времени, чтобы принять решение об участии в исследовании. 148 Я понимаю, что могу в любое время по моему желанию отказаться от дальнейшего участия в исследовании и если я это сделаю, то это не повлияет на мое последующее лечение и внимание врачей. Я добровольно соглашаюсь, чтобы мои данные, полученные в ходе исследования, использовались в научных целях и были опубликованы с условием соблюдения правил конфиденциальности. Я получил (а) экземпляр «Информации для пациента и Информированного согласия пациента». ___________________________________ ФИО пациента, разборчиво (рукой пациента) ____________________ Подпись пациента ___________________________________ ФИО лица, проводящего процедуру согласия, разборчиво ____________________ Подпись лица, проводящего процедуру согласия Дата (день, месяц, год) Дата (день,месяц,год) 149 ПРИЛОЖЕНИЕ 2 Индивидуальная регистрационная карта пациента (ИРК) Клиническое и диагностическое значение оценки стоматологического статуса у пациентов после коронарного шунтирования Диагноз: ЗАБОЛЕВАНИЯ ПАРОДОНТА ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА Идентификация пациента: НОМЕР ПАЦИЕНТА ИНИЦИАЛЫ ПАЦИЕНТА ДАТА ЗАПОЛНЕНИЯ 150 I. Общие данные: 1. Ф.И.О. 2. Возраст: 3. Пол: мужской женский 4. Семейное положение: женат замужем разведен(а) вдовец вдова не женат/не замужем 5. Род занятий: работает (указать ниже): руководитель (уточнить) _________________________ предприниматель (уточнить)________________________ служащий/специалист (уточнить)____________________ рабочий (уточнить)________________________________ работник сельского хозяйства (уточнить)_____________ другое (уточнить) _________________________________ учащийся домохозяйка инвалид пенсионер не работает 6. Инвалидность: нет да 7. Основная причина оформления инвалидности: ишемическая болезнь сердца другое заболевание 151 8. Регион проживания: Город (указать) Сельская местность (указать область) 9. Курение: некурит курил(а) ранее курит в настоящее время: стаж курения ____(лет) I. Анамнез: 1. Жалобы ___________________________________________________________________ 2. Возраст на момент начала заболевания: (лет) 3. Длительность симптомов до момента установления диагноза: (лет) (мес) II. Пальпация регионарных лимфатических узлов (поднижнечелюстных, подбородочные, шейные): не увеличены увеличены; плотной консистенции, рыхлые; болезненные, безболезненные; подвижные,спаянные. III. Осмотр полости рта: 1. Зубная формула: 2. Преддверие полости рта: мелкое (не более 5 мм), среднее (6-10 мм), глубокое (более 10 мм). 152 3. Соотношения отделов десны (в норме десна примерно 0,5-1,5 мм, прикрепленная в пределах 1-9 мм): нормальное соотношение (свободная десна <прикрепленной), узкая зона (свободная десна ≥ прикрепленной). 4. Тяжи слизистой оболочки: нет есть в области ________ зубов. 5. Прикрепление уздечек: нормальное высокое прикрепление низкое прикрепление. 6. Локализация очага: локализованный, в области ______ зубов генерализованный. 7. Прикус: ортогнатический аномалия прикуса__________________ деформация зубных дуг: нет, есть, скученность: нет, есть, тремы, диастемы: есть, нет 8. Зубные ряды: - пониженная стертость: нет, есть - отсутствие зубов: нет, есть - кариозные полости: нет, есть - не кариозные поражения: нет, есть - качество пломб: хорошее, удовлетворительное, неудовлетворительное, - ортопедические конструкции: нет, есть 153 Симптомы болезней пародонта: I. 1. Боль: нет есть 2. Неприятный запах: нет есть. 3. Зубной налет: нет есть: мягкие зубные отложения, твердые зубные отложения: наддесневые, поддесневые. 4. Кровоточивость: нет есть. 5. Гиперемия: нет, есть: артериальная (ярко красная), венозная (цианоз). 6. Отек: нет есть. 7. Наличие очагов некроза, изъявлений, некротического налета: нет есть. 8. Гипертрофия: нет есть: легкая (1/3 коронки зуба) средняя (1/2 коронки зуба) 154 тяжелая (более ½ коронки зуба). 9. Зубодесневое прикрепление: сохранено утрачено. 10. Пародантальный карман: нет есть: до 4 мм до 5 мм более 5 мм. 11. Обнажение корня: нет, есть: в ___ мм. 12. Патологическая подвижность: нет, есть: I степень- зуб смещается вестибулярно или орально по отношению к коронке соседнего зуба на 1 мм; II степень – зуб смещается в тех же направлениях более чем на 1 мм или присоединяется подвижность в медиальном и дистальном направлениях; III степень – присоединяется подвижность в вертикальном направлении. 13. Пародонтальный абсцесс: нет есть. 14. Гноетечение: нет есть. 15. Гиперестезия зубов: нет, есть. 155 II. Индексная оценка: 1. индекс Грин – Вермилиона: 0 – 1,2 балл: низкий, хорошая гигиена; 1,3 – 3,0 балл: средний, неудовлетворительная гигиена; 3,1 – 6,0 балл: высокий, плохая гигиена. 2. пародонтальный индекс: 0,1–1,5– начальная и I стадия заболевания; 1,5–4,0– II стадия; 4,0 –8,0– III стадия. 3. Индекс Мюллемана–Коуэлла: 0,1–1,0 – легкое воспаление; 1,1–2 – среднее воспаление; 2,1– 3 – тяжелая степень воспаления. 4. PMA: до 30% гингивит легкой степени; 30 – 60% гингивит средней степени, больше 60% гингивит тяжелой степени. III. Лабораторные исследования _______________________________________ VIII. Предварительный диагноз: 1. по классификации заболеваний пародонта (1983 г.) ________________________________________________________________ 2. по МКБ 10 ____________________________________________________ IX. Данные из истории болезни _____________________________________