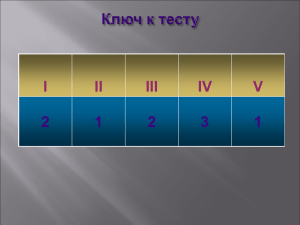
: «Свойства основных классов неорганических веществ в свете теории электролитической диссоциации».
advertisement

Тема урока: «Свойства основных классов неорганических веществ в свете теории электролитической диссоциации». Класс: 8 Тип урока: Обобщение и закрепление изученного материала. Цель урока: 1.Обобщить знания учащихся о классификации, химических свойствах основных классов неорганических соединений с точки зрения теории электролитической диссоциации, используя игровые приёмы. 2.Закрепить практические умения учеников работать с веществами, соблюдая правила техники безопасности, записывать уравнения происходящих реакций в молекулярной и ионной формах. Оборудование: р-ры H2SO4, Fe2O3, CuO, Cu, Zn, Fe, S, I2, Na2SiO3, Na2CO3, CuSO4, BaCl2, HCl, 3пронумерованные пробирки с кислотой, щёлочью и водой, индикаторы. План урока: 1.Организационный момент. Вступительная часть. 2.Основная часть урока. 3.Заключительная часть урока. Подведение итогов урока. Ход урока. Звучит музыка из кинофильма «Розовая пантера» или музыкальная тема из любого «шпионского» кинофильма. Учитель: «Здравствуйте дорогие ребята! Приглашаю вас принять участие в конкурсе химических детективов». Сообщается тема, девиз и эпиграф урока. Девиз урока: «Опыт-основа познания». Эпиграф урока: «Дерево науки всеми корнями связано с практикой» ( А.Н.Несмеянов ) У каждого ученика на столе - карточка с изображением 6 незаконченных смайликов. Ученик дорисовывает смайлики соответственно его настроению В начале урока В конце урока Основная часть. Учитель: «Умение из множества фактов выбрать те, которые помогут привести к правильному решению, способность к анализу в сочетании с интуицией – то, что отличает профессионального детектива от любителя. Итак, задание № 1. Перед вами последовательности химических формул. Выберите в каждой последовательности формулу, которая является «лишней». 1.AlCl3, Fe(NO3)3, KOН, HNO3, CuO. (CuO – неэлектролит). 2.CaO, Fe2O3, Na2O2, Cu2O, ZnO. (Na2O2 – не оксид) 3.NaOH, NH3. H2O, KOH, Ca(OH)2, Ba(OH)2. (NH3. H2O – слабый электролит) 4.H2SO4, H2S, H2SiO3, H2CO3, H2SO3. (H2SO4 – сильный электролит) 5.MgO, Li2O, CaO, Mn2O7, BaO. (Mn2O7 – кислотный оксид) За правильный ответ ученики начисляют себе по одному баллу. Задание № 2. Практическое. В 3-х пронумерованных пробирках – кислота, щёлочь и вода. Опытным путём надо определить, в какой пробирке находится каждое из веществ. Ответ: с помощью индикатора (метилового оранжевого или лакмуса). (3 балла) Задание № 3. Преступники, скрываясь с места преступления, пытались замести следы – стереть уравнения реакций. Задача детектива – восстановить написанное: 1….+… = BaSO4 +HCl 2…+ HCl = AgCl + … 3.Na2CO3 + … = NaCl + H2O+… 4.Fe(NO3)3 +… = Fe(OH)3 +… По одному баллу за уравнение. Задание № 4. «Слушается дело о похищении золотых украшений из ювелирного магазина. О преступнике известно, что он образуется при растворении в воде бесцветного газа с резким запахом. Термически устойчив. «Дымит» на воздухе. Сильный. Работает в паре с соучастником, образуя состав, в котором растворяются «царь металлов» - золото, а так же платина и другие благородные металлы. В совершённом злодеянии обвиняется серная кислота. Есть два свидетеля – лакмус и метиловый оранжевый» Учитель приливает к раствору серной кислоты в двух пробирках лакмус и метилоранж. Учитель: «Но что это? Два свидетеля покраснели, т.к. сказали неправду. Ребята, найти настоящего преступника - наша задача. Нам необходимо определить его с помощью реактивов. С какими из данных веществ будет реагировать серная кислота? Ответив на этот вопрос, мы узнаем имя настоящего преступника». С обратной от этикетки с формулой стороны склянки скотчем закреплена соответствующая буква. Если реактивы подобраны правильно, получается слово «соляная». Реактивы могут быть, например, такими: Fe2O3-«C» S-«K», I2-«T», Cu-«И», CuSO4-«У» Zn-«O» Fe-«Л» Na2SiO3-«Я» BaCl2-«Н» Na2CO3-«А» КОН-«Я» Учитель: «Итак, имя преступника – соляная кислота. Вместе с азотной кислотой образует «царскую водку», в которой растворяются Ag, Au, Pt и другие благородные металлы. Обвиняемая – серная кислота – оправдана. Проведите одну из реакций с участием соляной кислоты. Назовите признаки реакции. Составьте уравнение реакции в молекулярной и ионной формах». (7 баллов) Задание №5. «Хитроумные преступники, по всей видимости, неплохо знают химию и потому свои послания друг другу передают зашифрованными в химические формулы. В наши руки попало их секретное послание. Попытаемся разгадать его». ZnSO4+2H+ = Zn2++H2 Ca2++CO3 2- = CaCO3 H ++OH - = H2O CaO+2H+ = Ca2+ +H2O У доски работают учащиеся, составляя уравнения реакций в молекулярной и полной ионной формах. (По 1 баллу за реакцию). Подведение итогов урока. Рефлексия. Учитель: «Итак, ребята, вы с честью прошли все испытания, показав свои знания и практические умения. Предлагаю вам подсчитать свои баллы и оценить свою деятельность на уроке. Составьте дома задания для настоящих детективов. Надеюсь, знания, полученные вами на уроках химии, пригодятся вам в жизни, ведь не случаен девиз нашего урока: «Опыт – основа познания». Дорисуйте ваше настроение соответствующими смайликами. Спасибо всем за урок!»