ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК
advertisement

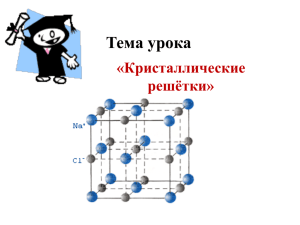
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК Любое химическое вещество образованно большим числом одинаковых частиц, которые связаны между собою. При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку. Кристаллическая решетка – это структура расположением частиц в пространстве. с геометрически правильным В самой кристаллической решетке различают узлы и межузловое пространство. Одно и то же вещество в зависимости от условий (p, t,…) существует в различных кристаллических формах (т.е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам. Например, известно четыре модификации углерода – графит, алмаз, карбин и лонсдейлит. Если скорость роста кристаллов мала при охлаждении – образуется стеклообразное состояние (аморфное). 1. Атомная кристаллическая решётка Построена из атомов, атомы в узлах. Между узлами ковалентные связи , как полярные так и неполярные. Для веществ атомного строения характерно: Большая твёрдость; Высокая температура плавления; Отсутствие растворимости в воде; Примеры веществ: Алмаз, графит, кремнезём (кварцевый песок) 2. Молекулярная кристаллическая решётка Построена из молекул, молекулы в узлах. Между узлами непрочные, межмолекулярные связи; Для веществ молекулярного строения характерно: Достаточная твёрдость; Низкая температура плавления; Могут растворяться в воде и нет; Летучесть, испаряемость; Примеры веществ: Вода (лёд), сухой лёд, сахар. 3. Ионная кристаллическая решётка Построена из ионов, ионы в узлах. Между узлами ионные связи . Для веществ ионного строения характерно: Большая твёрдость; Высокая температура плавления; Часто растворимость в воде, причем растворы; растворы проводят электрический ток; Примеры веществ: Соли, щелочи, некоторые оксиды Взаимосвязь между положением элемента в кристаллической решёткой его простого вещества. Периодической системе и Между положением элемента в периодической системе и кристаллической решёткой его соответствующего простого вещества существует тесная взаимосвязь. I II III г р у п п а IV V VI II Li Be B C N2 III Na Mg Al Si IV K Ca Ga V Rb Sr In VII H2 VIII He O2 F2 Ne P4 S8 Cl2 Ar Ge As Se Br2 Kr Sn Sb Te I2 Xe I п е р и о д Тип металлическая атомная молекулярная кристаллической решётки Простые вещества остальных элементов имеют металлическую кристаллическую решётку. Тип решетки Виды частиц в узлах решетки Ионы (катионы и анионы) Вид связи между частицами Примеры веществ Наиболее характерные физические свойства Ионная Соли, оксиды и гидроксиды типичных металлов Атомная Атомы Ковалентная Алмаз, кремний, бор, кварц. Молекулярная Молекулы Между молекуламислабые силы межмолекулярного притяжения, а вот внутри молекулпрочная ковалентная связь При обычных условиях газы или жидкости, или твердые вещества с низкой температурой плавления: органические вещества (нафталин), вода, углекислый газ и др. Металлы и сплавы Тугоплавкие, нелетучие, твердые, многие растворимы в воде и проводят электрический ток в растворе и расплаве Твердые, нерастворимые, тугоплавкие, как вещества с ионной кристаллической решеткой, но часто в превосходной степени – очень твердые, очень прочные и т.д. Легкоплавкие, летучие, в твердом виде хрупкие, способны к возгонке, имеют малую твердость Ионная Металлическая Атом-ионы Металлическая Ковкие, пластичные, тягучие, электро- и теплопроводные, имеют металлический блеск и т.д.