Cr2O3 + CaO
advertisement

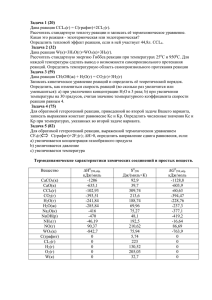
Повторение курса химии 8-го класса. (летнее задание) Решение задач. Химическая формула. Расчеты по химической формуле. 1. 5 г некоторого порошка было растворено в возможно малом количестве кипящей воды. При охлаждении выкристаллизовалось 3 г. Эти кристаллы были отфильтрованы и растворены снова в таком же количестве кипящей воды; при охлаждении выкристаллизовалось 2,9 г. Был ли порошок чистым веществом или смесью веществ? Ответ пояснить. 2. Какие из перечисленных ниже веществ являются смесями, и какие – химически чистыми веществами: а) бензин, б) азот, полученный пропусканием воздуха через нагретую медь, в) генераторный газ, г) речная вода? 3. Укажите, в каких случаях речь идет о молекулах кислорода: а) «кислород входит в состав оксида ртути», б) «кислород входит в состав оксида меди», в) «кислород плохо растворим в воде», в) «кислород собран в цилиндр», д) «кислород входит в состав воздуха», е) «кислород необходим для дыхания». 4. Может ли в молекуле относительная атомная масса азота составлять: а) 7, в) 28, в) 21? Почему? 5. Относительная молекулярная масса сернистого газа SO2 в два раза больше, чем относительная атомная масса серы. Найдите относительную атомную массу серы. 6. Напишите формулы следующих соединений: а) оксида цинка (на 1 атом цинка приходится 1 атом кислорода), б) оксид магния (на 1 атом магния приходится 1 атом кислорода), в) хлорида натрий (на каждый атом натрия приходится 1 атом хлора), г) перекиси водорода (молекула состоит из двух атомов водорода и двух атомов кислорода), д) железного колчедана (на каждый атом железа приходится два атома серы). Рассчитайте массовые доли химических элементов в этих соединениях. 7. Изменится ли: а) массовая доля элементов; б) относительная молекулярная масса при преобразовании: а) NO2 в N2O4, б) HF в H2F2? 8. Какая масса атомов углерода будет содержаться в 160 г метана (CH4)? 9. Какое количество вещества сульфата алюминия (Al2(SO4)3) содержит 288 г серы? 10. Вывести формулу химического соединения, имеющего состав: 10,11% алюминия, 89,89% брома. 11. Составьте химическую формулу соединения, зная, что в состав 1 моль входит: 96 г углерода, 8 г водорода, 48 г кислорода. 12. Определите формулу питьевой соды. Массовые отношения элементов в соединении: m(Na):m(H):m(C):m(O) = 23:1:12:48. 13. Вычислите массовые отношения элементов по формулам следующих соединений: а) Fe3O4, б) H3PO4. 14. Напишите формулы и проставьте степени окисления элементов в соединении углерода с а) кислородом, б) серой, в) фтором. Степени окисления определить по положению элементов в периодической системе. 15. Напишите степени окисления (высшие и низшие), которые могут иметь следующие химические элементы: а) бериллий, б) фтор, в) кремний, г) алюминий, д) хлор, е) магний. 16. Определите степень окисления химических элементов, исходя из химической формулы: N2O5, CO, CrO, Cr2O3, CrO3, MnO2, PCl3, PCl5, OF2, H2O2. 17. Определите степени окисления элементов в соединениях: H2SO4, K3PO4, NaMnO4, Cr(OH)3, K2CrO4, Zn(NO2)2. Растворы. Концентрация растворов. 1. Растворимость соли в 100г воды при 600С равна 110г. Определите массу этого вещества, которую можно растворить в 300г воды при той же температуре. 2. В воде массой 100г при 300С растворяется соль массой 81,8г. При охлаждении насыщенного при 300С раствора соли массой 300г до 0 0С выпадает осадок массой 36,8г. Определите, какая растворимость соли при 00С в 100г воды. 3. Коэффициент растворимости соли при 600С равен 46,4 г. Сколько граммов BaCl2 * 2H2О может раствориться в 400 г воды при этой температуре. 10. Вычислите массу воды, которую необходимо добавить к 1 л раствора с массовой долей растворенного вещества 36% (плотность 1,36 г/мл), чтобы получить раствор с массовой долей растворенного вещества 10%. 4. Вычислите объем воды, которую необходимо добавить к 250 мл раствора с массовой долей растворенного вещества 28% (плотность 0,898 г/мл), чтобы получить раствор с массовой долей растворенного вещества 8%. 5. Вычислите массу раствора с массовой долей растворенного вещества 6%, который необходимо добавить к 800 г раствора с массовой долей вещества 30%, чтобы получить раствор с массовой долей растворенного вещества 10% 6. Какой объем раствора соляной кислоты с массовой долей растворенного вещества 4% (плотность 1,02 г/мл), нужно добавить к 1 л раствора соляной кислоты с массовой долей растворенного вещества 20% (плотность 1,1 г/мл), чтобы получить раствор с массовой долей растворенного вещества 8%. 7. Смешали 150 г раствора с массовой долей растворенного вещества 75% и 200 г раствора с массовой долей растворенного вещества 25%. Определите массовую долю растворенного вещества в полученном растворе. 8. Коэффициент растворимости соли при определенной температуре равен 87,4 г. Для приготовления насыщенного раствора взяли 200 г воды. Определите массовую долю полученного раствора. 9. В 750 мл насыщенного раствора (плотность 1,05 г/мл) массовая доля соли составляет 57,65%. Определите коэффициент растворимости данной соли. 10. В лаборатории имеются два раствора сульфида натрия: 1-й – 250 мл (плотность 1,1 г/мл) с массовой долей растворенного вещества 23% и 2-й – 150 мл (плотность 1,02 г/мл) с массовой долей 13%. Раствор с какой массовой долей может быть получен при сливании этих растворов? 11. Чему равна молярная концентрация 250 г (плотность 1,02 г/мл) раствора фторида кальция с массовой долей вещества 13%? 12. Определить массовую долю раствора хлорида бария, который получится при сливании 150 мл 0,5 молярного и 250 мл 0,25 молярного растворов хлорида бария. Плотность растворов принять за 1 г/мл. Химическое уравнение. Расчет по химическому уравнению. 1. Расставьте коэффициенты в уравнениях химических реакций (обратить внимание, что коэффициент изменяет число атомов только одного элемента): Fe2O3 + Al = Al2O3 +Fe Mg + N2 = Mg2N3 CaO + C = CaC2 + CO Ca + P = Ca3P2 2. Расставьте коэффициенты в уравнениях химических реакций (обратить внимание, что коэффициент изменяет число атомов двух элементов): Zn + HCl = ZnCl2 + H2 KClO3 + S = KCl + SO2 SiO2 + C = Si + CO Mg2Si + HCl = MgCl2 + SiH4 3. Расставьте коэффициенты в уравнениях химических реакций (обратить внимание, что коэффициент изменяет число атомов двух или нескольких элементов): Fe2O3 + HCl = FeCl3 + H2O SiF4 + H2O = H2SiF6 + H2SiO3 PCl5 + KOH = K3PO4 + KCl + H2O Al4C3 + HCl = AlCl3 + CH4 4. Расставьте коэффициенты в уравнениях химических реакций (обратить внимание, что один элемент содержится в двух или нескольких соединениях): NO2 + H2O + O2 = HNO3 KOH + P2O5 = K2HPO4 + H2O C4H8 + O2 = CO2 + H2O MnO + HCl = MnCl2 + Cl2 + H2O 5. Расставьте коэффициенты в уравнениях химических реакций (обратить внимание, что один элемент содержится в двух или нескольких соединениях): Fe2(SO4)3 + KOH = Fe(OH)3 + H2O ZnO + HNO3 = Zn(NO3)2 + H2O Cu(OH)2 + H2SO4 = CuSO4 + H2O CaC2 + H2O = Ca(OH)2 + C2H2 6. Закончите уравнения химических реакций (коэффициенты в уравнениях приведены): CaO + … = CaCO3 … + SO3 = H2SO4 Fe + H2SO4 = FeSO4 + … TiCl4 + 2… = 2MgCl2 7. Исправьте ошибки в уравнениях химических реакций: 2Mg + O2 = MgO P2O5 + 3H2O = H3PO4 Fe3O4 + H2 = 3Fe + 4H2O 2NaOH + CO2 = 2Na2CO3 + 2H2O 8. Составьте уравнения химических реакций: а) взаимодействие металлического натрия с водой; б) взаимодействие молекулярного азота с водородом; в) взаимодействие железа с хлором. 9. Смешали 3 моль серы (-2) и 2 моль порошка меди (+2) и нагрели, полностью ли вещества вступят в реакцию? В скобках даны степени окисления элементов в образующемся соединении. 10. Хватит ли 3,5 моль кислорода для получения оксида железа (Fe3O4) из 2,5 моль железа? 11. Хватит ли соляной кислоты (HCl) количеством вещества 0,4 моль для реакции с 0,25 моль оксида кальция. Уравнение реакции: HCl + CaO = CaCl2 + H2O. 12. Какое количество вещества сульфида железа (П) образуется, если для реакции соединения взяли 1 моль железа и 2 моль серы? 13. Какое количество оксида алюминия образуется, если для реакции соединения взяли 4 моль алюминия и 3,5 моль кислорода? 14. Какое количество вещества воды образуется, если для реакции взяли 20 моль водорода и 20 моль кислорода? 15. По уравнению химической реакции Cu + O2 = CuO вычислить массу меди, вступившей в реакцию с 0,5 моль кислорода. 16. По уравнению химической реакции Al + S = Al2S3, найдите массу сульфида алюминия, образовавшегося из 3,5 моль алюминия. 17. При взаимодействии алюминия с хлором (Cl2) образуется 0,3 моль хлорида алюминия (AlCl3). Вычислите массу алюминия и хлора, вступивших в реакцию. 18. При реакции водорода с кислородом образуется вода количеством вещества 1,2 моль, вычислите массы веществ, вступивших в реакцию. Кислород в лаборатории часто получают по реакции: 2KMnO4 = MnO2 + K2MnO4 + O2. 15. Вычислите количество вещества образовавшегося кислорода, если разложению подвергли 1,58 г перманганата калия. Периодический закон Д.И. Менделеева. Строение атома. Строение периодической таблицы химических элементов. 1. Напишите электронные конфигурации следующих элементов6 азота, кремния, железа, криптона. Теллура, вольфрама. 2. Сколько неспаренных электронов содержат невозбужденные атомы бора, серы, мышьяка и хрома? 3. Как изменяются неметаллические свойства элементов в периодах периодической системы? Приведите конкретные примеры соединения элементов, подтверждающих эти свойства. 4. В атоме, какого элемента – лития или цезия – связь валентного электрона с ядром сильнее? Объясните, почему. 5. Какие общие свойства имеют элементы марганец и хлор, находящиеся в одной группе Периодической системы? 6. Каков состав изотопов 16О и 17О, 3Не и 4Не? 7. Сколько электронов и протонов входит в состав следующих частиц: – а) NO2 ,б) PH3? 8. Назовите два элемента, в атомах которых количество пар спаренных электронов равно количеству неспаренных электронов. 9. Объясните, почему на первом энергетическом уровне не могут быть более двух электронов, на втором – более восьми, на третьем – более 18. Выведите общую формулу, описывающую максимальное число электронов N на каждом уровне. 10. Природный хлор содержит два изотопа: 35Cl и 37Cl. Относительная атомная масса хлора равна 35,45. Определите мольную долю каждого изотопа хлора. Химическая связь. Строение вещества. 1. Чем объяснить, что такие вещества как кислород, водород, углекислый газ имеют низкие температуры кипения и плавления? 2. Приведите по два примера соединений с полярной и неполярной ковалентной связью. Приведите схемы образования данных молекул. 3. Приведите примеры неполярных молекул, имеющих ковалентные полярные связи. 4. Напишите формулы двух соединений, имеющих одновременно ионную и ковалентную связи. 5. Объясните, почему водородное соединение фосфора менее прочное, чем водородное соединение азота. 6. Изобразите структурные формулы иона аммония, молекулы пероксида водорода. 7. Напишите структурные формулы следующих соединений: перхлорат калия, хлорат калия, хлорит калия, гипохлорит калия, хлорид калия. 8. Напишите структурную и электронную формулы угарного газа и углекислого газа. 9. Напишите структурные формулы фосфата, гидрофосфата и дигидрофосфата кальция. 10. В чем заключается сущность донорно-акцепторного механизма образования химической связи? Приведите не менее 3-х примеров соединений, связь в которых образована по этому механизму. 11. Какие значения валентности могут проявлять в своих соединениях следующие элементы: фтор, бром, кислород, селен, ксенон? Определите максимальную валентность азота и фосфора в их соединениях Определите степени окисления элементов в следующих соединениях: FeS2, K3[Fe(CN)6], Fe3O4, Na2S2O3, Mn[PtF6], C6H5CH3, CH2Cl2, CH3COOH. Основные классы неорганических соединений. 1. В одном из газообразных соединений азота горючие вещества горят, как в кислороде. Формула этого соединения была установлена на основании следующих измерений: при сгорании угля в определенном объеме соединения образуется такой же объем азота и вдвое меньший объем углекислого газа. Установите формулу соединения азота. 2. Дайте названия кислотам и их кислотным остаткам, укажите валентность и степень окисления для следующих кислот: H2SO4, HNO3, H3PO4, H2SeO4, H2CrO4, HClO4, H2Cr2O7. 3. Установите формулу уксусной кислоты по данным о массовых отношениях элементов в этом соединении: m(C) : m(H) : m(O) = 6 : 1 : 8. Молекулярная масса уксусной кислоты в 2 раза больше молекулярной массы оксида азота (П). 4. 0,49 г серной кислоты растворили в воде и довели объем до 250 мл. Найдите молярную концентрацию полученного раствора серной кислоты. 5. Какой объем азотной кислоты с молярной концентрацией 2 моль можно приготовить из 100 мл раствора азотной кислоты с массовой долей растворенного вещества 20% с плотностью 1,10 г/мл? 6. Найти массу оксида алюминия, которая может образоваться при взаимодействии 5,4 г алюминия с 0,2 моль кислорода. 7. Допишите следующие уравнения реакций: Cr2O3 + CaO = Cr2O3 + P2O5 = Li2O + CO2 = ZnO + P2O5 = 8. Возможно ли взаимодействие между следующими веществами: а) оксидом серы (IV) и оксидом свинца (II); б) оксидом лития и оксидом хрома (III); в) оксидом бария и оксидом углерода (IV); г) углекислым газом и оксидом меди (II); д) сернистым газом и оксидом алюминия; е) оксидом олова (II) и оксидом кремния (IV)? Напишите уравнения соответствующих реакций. 9. Приведите уравнения реакций, характеризующих химические свойства следующих веществ: а) оксид стронция; б) ангидрида серной кислоты; в) оксида алюминия. 10. Зная свойства оксидов, приведите уравнения реакций, с помощью которых можно получить следующие вещества: а) гидроксид бария; б) хромовую кислоту; в) карбонат натрия (2 способа); г) фосфат кальция (2 способа) 11. Составьте уравнения следующих реакций или укажите, если они невозможны: CuO + H2O = ZnO + H2SO4 = SO2 + NaOH = CO + Ca(OH)2 = t Cl2O +Ca(OH)2 = Cl2O7 + Ba(OH)2 = KOH + Al2O3 = ZnO + KOH = 12. Каким реактивом – концентрированным раствором гидроксида металла или соляной кислотой – вы воспользовались бы, чтобы отличить часто встречающийся в химических лабораториях оксид кремния (IV) от оксида цинка? 13. Как осуществить следующие превращения: а) Fe(OH)3 → Fe(NO3)3, б) Fe(OH)2 → FeO? Составьте уравнения реакций. 14. Как осуществить следующие превращения: а) Al(OH)3 → Al2O3 → Al(NO3)3 → Al(OH)3 → K3[Al(OH)6] б) Al2(SO4)3 ←Al2O3 → NaAlO2. 15. Составьте формулы оксидов, соответствующих следующим веществам: H2SiO3, Mn(OH)4, HNO3, Pb(OH)2, H3PO4, Cr(OH)3, Be(OH)2, H2SiO3, Mg(OH)2. Какие из этих соединений амфотерные? 16. Составьте уравнения реакций нейтрализации. Назовите образовавшиеся соли: H2SO4 + Al(OH)3 = H2S + LiOH = H3PO4 + NaOH = HClO4 + Ba(OH)2 = HNO3 + Fe(OH)3 = H2Cr2O7 + KOH = 17. С какими из перечисленных веществ, формулы которых указаны, реагирует разбавленная серная кислота: Fe2O3, Mg, Ca(OH)2, Zn(OH)2, Cu, P2O3, Hg? Приведите молекулярные и ионные уравнения реакций. 18. Как осуществить следующие превращения: KNO3 ← HNO3 →CuSO4. Приведите уравнения реакций.