p-элементы IV группы
advertisement
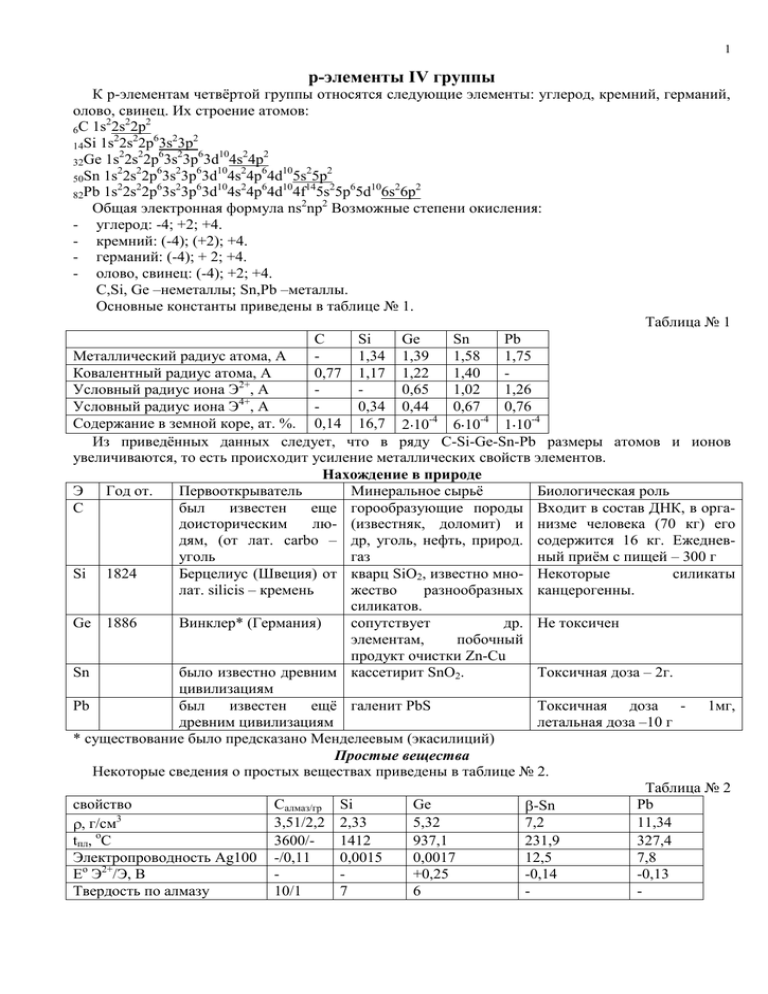
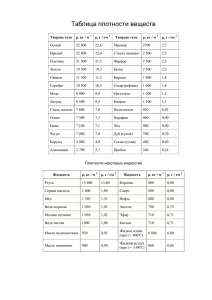
1 р-элементы IV группы К р-элементам четвёртой группы относятся следующие элементы: углерод, кремний, германий, олово, свинец. Их строение атомов: 2 2 2 6C 1s 2s 2p 2 2 6 2 2 14Si 1s 2s 2p 3s 3p 2 2 6 2 6 10 2 2 32Ge 1s 2s 2p 3s 3p 3d 4s 4p 2 2 6 2 6 10 2 6 10 2 2 50Sn 1s 2s 2p 3s 3p 3d 4s 4p 4d 5s 5p 2 2 6 2 6 10 2 6 10 14 2 6 10 2 2 82Pb 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 6s 6p 2 2 Общая электронная формула ns np Возможные степени окисления: - углерод: -4; +2; +4. - кремний: (-4); (+2); +4. - германий: (-4); + 2; +4. - олово, свинец: (-4); +2; +4. C,Si, Ge –неметаллы; Sn,Pb –металлы. Основные константы приведены в таблице № 1. Таблица № 1 C Si Ge Sn Pb Металлический радиус атома, А 1,34 1,39 1,58 1,75 Ковалентный радиус атома, А 0,77 1,17 1,22 1,40 2+ Условный радиус иона Э , А 0,65 1,02 1,26 4+ Условный радиус иона Э , А 0,34 0,44 0,67 0,76 Содержание в земной коре, ат. %. 0,14 16,7 2 10-4 6 10-4 1 10-4 Из приведённых данных следует, что в ряду C-Si-Ge-Sn-Pb размеры атомов и ионов увеличиваются, то есть происходит усиление металлических свойств элементов. Нахождение в природе Э Год от. Первооткрыватель Минеральное сырьё Биологическая роль С был известен еще горообразующие породы Входит в состав ДНК, в оргадоисторическим лю- (известняк, доломит) и низме человека (70 кг) его дям, (от лат. carbo – др, уголь, нефть, природ. содержится 16 кг. Ежедневуголь газ ный приём с пищей – 300 г Si 1824 Берцелиус (Швеция) от кварц SiO2, известно мно- Некоторые силикаты лат. silicis – кремень жество разнообразных канцерогенны. силикатов. Ge 1886 Винклер* (Германия) сопутствует др. Не токсичен элементам, побочный продукт очистки Zn-Cu Sn было известно древним кассетирит SnO2. Токсичная доза – 2г. цивилизациям Pb был известен ещё галенит PbS Токсичная доза - 1мг, древним цивилизациям летальная доза –10 г * существование было предсказано Менделеевым (экасилиций) Простые вещества Некоторые сведения о простых веществах приведены в таблице № 2. Таблица № 2 свойство Салмаз/гр Si Ge Pb -Sn 3 3,51/2,2 2,33 5,32 7,2 11,34 , г/см tпл, оС 3600/1412 937,1 231,9 327,4 Электропроводность Ag100 -/0,11 0,0015 0,0017 12,5 7,8 о 2+ Е Э /Э, В +0,25 -0,14 -0,13 Твердость по алмазу 10/1 7 6 - 2 Выводы: олово и свинец относятся к тяжёлым и легкоплавким металлам, металлы средней активности. Свойства алмаза и графита существенно отличаются. Все р-элементы IV группы в воде нерастворимы. У углерода в отличие от элементов всех других групп число валентных электронов равно числу валентных орбиталей. Поэтому для углерода возможны: sp3 – гибридизация (координационное число 4); sp2 – гибридизация (координационное число 3); sp – гибридизация (координационное число 2). Поэтому углероду соответствует 3 типа простых веществ, то есть характерных аллотропных модификаций: алмаз; графит; карбин. Эти аллотропные модификации имеют различное строение, причём графит – самая устойчивая модификация. Алмаз – это кристаллическое вещество с атомной координационной кубической решёткой. Вследствие sp3-гибридизации каждый атом углерода в алмазе образует равноценные прочные связи с четырьмя соседними, что обуславливает исключительную твёрдость и отсутствие электронной проводимости. Графит – это слоистое кристаллическое вещество с гексагональной структурой. В соответствии с sp2-гибридизацией атомы углерода объединяются в макромолекулы С2 , представляют собой бесконечные слои из шестичленных колец. sp2 – состояние в этом случае стабилизируется делокализованной -связью, образованной за счёт четвёртого электрона каждого из атомов макромолекулы. -связь в графите делокализована в пределах всей макромолекулы. Этим определяется его электропроводность, серый цвет и металлический блеск. Углеродные слои объединяются в основном за счёт межмолекулярных сил в кристаллическую решётку. Прочность химических связей в плоскости макромолекулы 716 кДж/моль, а между слоями всего 17 кДж/моль. Расстояние между атомами внутри слоя – 0,142 нм, а между слоями – 0,335 нм. Поэтому графит довольно легко расслаивается, химически несколько активнее алмаза. Карбин (древесный уголь, сажа) – это чёрный порошок = 1,9-2,0 г/см3. Его решётка гексагональная, построена из прямолинейных цепочек С , в которых каждый атом образует по 2 - и 2 -связи. Карбин является полупроводником. Фуллерены (бакминстерфуллерены, названы в честь американского изобретателя и архитектора Ричарда Бакминстера Фуллера) – минимальный элемент структуры не атом, а молекула С60, С70, С76, С84, С94, представляющая собой замкнутую поверхность в виде сферы, существует и вытянутый изомер. Они впервые были обнаружены в природе в местах метеоритных ударов. Производятся и искусственно. У кремния известны две модификации: - алмазоподобная модификация – имеет тёмно-серый цвет и металлический вид, высокую твёрдость, является полупроводником. - графитоподобная модификация – неустойчива. При обычных температурах углерод и кремний инертны, что является следствием их полимерного строения и большой энергии связи между атомами. При высоких температурах они взаимодействуют со многими металлами и неметаллами, проявляя при этом, в основном, восстановительные свойства. Окислительные свойства выражены слабо. Углерод растворяется только в кислотах - сильных окислителях. Кремний в кислотах пассивируется и растворяется лишь в смеси азотной и плавиковой кислот: 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O Si – 4e + 6HF = [SiF6]2- + 6H+ NO3- + 3e + 4H+ = NO + 2H2O Кремний растворяется в растворах щелочей: Si + 2KOH + H2O = K2SiO3 + 2H2 Германий – имеет серебристо-белый цвет, по внешнему виду похож на металл, но имеет алмазоподобную решётку, полупроводник, хрупкий неметалл. В ряду напряжений германий стоит после водорода (между медью и серебром). Германий взаимодействует только с кислотами, окислителем у которых является анион кислоты. При окислении азотной кислотой 3 (концентрированной или разбавленной) германий переходит в германиевую кислоту H2GeO3 (GeO2 nH2O). Германий растворяется в щелочах лишь в присутствии окислителей: Ge + 2KOH + 2H2O2 = K2[Ge(OH)6] Олово существует в виде двух модификаций: - «белое олово» - -модификация, устойчива при температуре выше 13,2оС, серебристо-белый металл; - «серое олово» - -модификация, имеет структуру типа алмаза, является полупроводником. Переход -модификацию сопровождается увеличением удельного объёма на 25,6%, в связи с чем олово рассыпается в порошок. Свинец – это тёмносерый металл, на воздухе покрыт оксидной плёнкой PbO. В обычных условиях германий и олово устойчивы по отношению к воздуху и воде. Свинец на воздухе покрывается синевато-серой оксидной плёнкой. В ряду напряжений олово и свинец находятся непосредственно перед водородом. При повышенной температуре германий, олово, свинец взаимодействуют с большинством неметаллов. Реакции Pb + HCl Pb + H2SO4разб не протекают, так как PbCl2 и PbSO4 нерастворимы в воде. При взаимодействии же с концентрированной серной кислотой образуется кислая соль Pb(HSO4)2. В ряду Ge-Sn-Pb усиливаются металлические свойства, что проявляется в отношении этих металлов к азотной кислоте. Взаимодействие Ge с ней обсуждено выше. Sn при взаимодействии с концентрированной азотной кислотой превращается в оловянную кислоту H2SnO3(SnO2 nH2O). В общем случае: Э + 4HNO3конц = Н2ЭО3 + 4NO2 + H2O (баланс) При взаимодействии с разбавленной азотной кислотой олово ведёт себя как металл: 3Sn + HNO3разб = 3Sn(NO3)2 + 2NO + 4H2O Свинец по отношению к азотной кислоте любой концентрации выступает как металл, то есть образует Pb(NO3)2. В щелочах растворяются олово и свинец (Me=Sn, Pb): Me + 2KOH + 2H2O = K2[Me(OH)4] + H2 Соединения со степенью окисления –4 С менее электроотрицательными элементами, чем он сам, углерод образует карбиды; кремний – силициды; германий – германиды; олово – станниды; свинец- плюмбиды. СН4 – метан – простейший ковалентный карбид водорода; С2Н6 – этан – перкарбид водорода. Большое значение имеют карбиды d-элементов IV-VIII групп, например, Fe3C. Многие из них имеют металлические признаки, обладают высокой твёрдостью, жаропрочностью, тугоплавкостью, высокой коррозионной стойкостью. Карбиды, как и силициды, получают прокаливанием при высоких температурах смеси металлов или их оксидов с порошком угля в электрических печах: V2O5 + 7C = 2VC + 5CO 2Mg + Si = Mg2Si 6MnO + 5Si = 2Mn3Si + 3SiO2 Карбиды подразделяются на: - ионные – s и р- металлы- производные метана Al4C3 или ацетилена СаС2, разлагаются водой или разбавленными кислотами с выделением метана или ацетилена; - ковалентные – карбиды неметаллов, например, карборунд SiC, это тугоплавкие, химически инертные вещества; - металлоподобные –d-элементы - металлы сохраняют свои металлические структуры, атомы углерода внедряются в пустоты, при этом сохраняется электропроводность металлов. У них высокая твёрдость, жаропрочность, химическая стойкость. По структуре и свойствам силициды отличаются от карбидов. Так, силициды s- и d-элементов I-II групп Ca2Si, CaSi, CaSi2 – полупроводники, химически неустойчивы. Аналог метана SiH4 – силан. Существуют также кремневодороды с общей формулой SinH2n+2 (n 8): Si2H6, Si3H8, Si4H10…Si8H18. Кремневодороды чрезвычайно неустойчивы, поскольку связи Si-H и Si-Si слабее 4 связей С-Н и С-С. На воздухе самовоспламеняются, вследствие чего в природе существовать не могут. Германий и его аналоги с магнием образуют соединения состава Mg2Э. В ряду Mg2Ge – Mg2SnMg2Pb увеличивается доля металлической связи, уменьшается температура плавления, энтальпия образования. Также типичны соединения олова и свинца с s-элементами: Na2Sn; NaSn, NaSn2 и эвтектические сплавы. Эвтектическая композиция представляет собой жидкий раствор, кристаллизующийся при наиболее низкой температуре для сплавов данной системы. Соединения со степенью окисления + 2 Для углерода это – CO (угарный газ), CS, HCN. В молекуле СО – тройная связь, поэтому у молекулы высокая энергия диссоциации и сходство с физическими свойствами азота. В обычных условиях СО химически инертен. СО образуется при сгорании угля в недостатке кислорода или в результате взаимодействия СО2 с раскалённым углём: 2С + О2 = 2СО СО2 + С 2CO При нагревании СО проявляет восстановительные свойства, что применяется в металлургии. При 700оС сгорает: 2СО + О2 = СО2 Поэтому его применяют в качестве газообразного топлива. При нагревании окисляется серой с образованием оксосульфида углерода(IV): CO + S = COS. COS легко воспламеняется и ядовит. При облучении или в присутствии катализатора СО взаимодействует с хлором с образованием ядовитого газа фосгена – COCl2. СО взаимодействует со многими металлами, образуя комплексные соединения – карбонилы, например, [Fe(CO)5], [Ni(CO)4]. Роль акцептора выполняют свободные металлы, а роль донора – молекулы СО. Цианид водорода HCN смешивается с водой в любых отношениях. Его водный раствор - очень слабая синильная кислота с Кд = 7,9 10-10, являющаяся очень сильным ядом. Жидкий циановодород постепенно полимеризуется. При нагревании растворы цианидов постепенно окисляются в цианаты: 2CN- + O2 = 2CNOПри кипячении цианидов с серой образуются тиоцианаты (роданиды): CN- + S = CNSПолучение цианида водорода: CO + NH3 = HCN + HOH Его применяют в органическом синтезе, соли – в добыче золота, для получения комплексных солей. При нагревании цианидов малоактивных металлов до 350-450оС образуется дициан – очень реакционноспособный ядовитый газ: Hg(CN)2 = Hg + (CN)2 Дициан по свойствам подобен галогенам: (СN)2 + H2 = 2HCN Для кремния степень окисления +2 неизвестна. Для германия известны лишь немногочисленные бинарные соединения. Оксиды и гидроксиды олова и свинца ЭО и Э(ОН)2 амфотерны: Э(ОН)2 + 2HCl =ЭCl2 + 2HOH Э(ОН)2 + 2КОН = К2[Э(ОН)4] В ряду Ge(OH)2-Sn(OH)2-Pb(OH)2 происходит усиление основных свойств. Соединения со степенью окисления +4 Степень окисления +4 углерод и кремний проявляют в их соединениях с более электроотрицательными неметаллическими элементами: СГ4; СОГ2; СО2; Н2СО3; НСО3-; СО32-; COS; CS2; CSГ2 5 SiГ4; SiO2; SiS2; Si3N4; SiC По химической природе эти соединения являются кислотными. Некоторые из них легко взаимодействуют с водой, образуя кислоты, и с основными соединениями, образуя соли: COCl2 + 2HOH = H2CO3 + 2HCl CaS + CS2 = CaCS3 – тиокарбонат кальция. Тетрагалогениды углерода и кремния: CF4 и SiF4 – газы; CCl4, SiCl4, SiBr4 – жидкости; CBr4, CI4- твёрдые вещества. С ростом длины связи в ряду CF4 – CCl4 – CBr4- CI4 устойчивость соединений снижается и возрастает химическая активность. Тетрафторид полимеризуется с образованием полимера – тефлона. Тетрахлорид – негорючий растворитель органических веществ, жидкость для огнетушителя. Смешанный фторид-хлорид углерода CCl2F2 – фреон – применяется в качестве хладагента в холодильных машинах и установках. В отличие от тетрагалогенидов углерода тетрагалогениды кремния гидролизуются: SiCl4 + 3HOH = H2SiO3 + 4HCl Вследствие гидролиза тетрагалогениды кремния во влажном воздухе дымят. Оксодигалогениды (карбонилгалогениды) углерода(IV) – значительно более реакционноспособны, чем тетрагалогениды, легко гидролизуются: COCl2 + HOH = CO2 + 2HCl Наибольшее применение находит COCl2 – фосген (дихлорангидрид угольной кислоты). Его широко используют в органическом синтезе. Это очень ядовитый газ. Дисульфид углерода (сероуглерод) – летучая бесцветная жидкость. Его получают взаимодействием паров серы с раскалённым углём. Сероуглерод легко окисляется: CS2 + 3O2 = CO2 + 2SO2 В воде не растворяется. Сероуглерод используется как хороший растворитель органических веществ, фосфора, серы, йода. Его основная масса применяется в производстве вискозного шёлка и для борьбы с вредителями в сельском хозяйстве. Он ядовит. При взаимодействии сероуглерода с основными сульфидами образуются сульфидокарбонаты (тиокарбонаты): K2S + CS2 = K2[CS3] K2[CS3] + 2HCl = H2CS3 + 2KCl Тиоугольная кислота – это маслянистая жидкость, относится к разряду слабых кислот, разлагается водой: H2CS3 + 3HOH = H2CO3 + 3H2S Диоксид углерода (углекислый газ) имеет линейную структуру О=С=О, молекула неполярна. Это газ без цвета и запаха, тяжелее воздуха примерно в 1,5 раза, сравнительно легко сжижается. Диоксид углерода, растворяясь в воде, образует слабую угольную кислоту. В растворе устанавливается динамическое равновесие: НОН+ СО2 H2CO3 H+ + HCO-3; K1 = 4,4 10-7 HCO3- H+ + CO32-; K2 = 4,7 10-11 Угольная кислота образует средние (карбонаты) и кислые (гидрокарбонаты) соли. Наибольшее применение имеют: карбонат натрия – сода, карбонат калия - поташ; карбонат кальция – мел, мрамор; гидрокарбонат натрия – питьевая сода. Диоксид кремния – бесцветное твёрдое вещество, имеющее полимерное строение. Ему соответствует ряд кислот, состав которых выражают формулой xSiO2 yH2O, простейшая из них – метакремниевая кислота – SiO2 H2O = H2SiO3. Кислоты, в которых х 2, называются поликремниевыми. Природные силикаты – это соли поликремниевых кислот. Диоксид кремния и соответствующие ему кислоты нерастворимы в воде. Гексафторосиликат водорода H2SiF6 в свободном состоянии не выделен, в водном растворе – сильная (типа серной) гексафторокремниевая кислота. Диоксид олова – амфотерен. Очень активен тетрахлорид олова, с водой гидролиз протекает до образования гидроксида, дымится во влажном воздухе: SnCl4 + 4HOH Sn(OH)4 + 4HCl SnCl4 + 4NH3 + 6HOH = H2[Sn(OH)6] + 4NH4Cl - -оловянная кислота 6 При стоянии -оловянная кислота отщепляет воду и переходит в неактивную форму - оловянную кислоту. Диоксид свинца обладает сильными окислительными свойствами. Свинец образует и смешанные оксиды Pb2O3 и Pb3O4 (сурик - оранжево-красного цвета, краситель, окислитель), которые можно рассматривать как соли свинца (II) с кислотами свинца (IV): Pb2O3 = PbPbO3 Pb3O4 = Pb2PbO4 В разном валентном состоянии можно убедиться реакцией взаимодействия с разбавленной азотной кислотой: Pb2PbO4 + 4HNO3 = 2Pb(NO3)2 + PbO2 + 2HOH Э С Мировое пр-во, 1990, т/год 8 109 Si 480 000 Ge 80 Sn 165 000 Pb 4 100 000 Способ получения Применение Применение добыча полезных ископаемых в виде кокса при выплавке стали, сажи- в полиграфии, активированного угля для очистки в-в, в пр-ве электродов, тиглей; алмазы – в буровых установках, в пр-ве шлифовальной и режущей техники, в ювел. деле SiO2 + C = Si + CO2 в полупроводниках, сплавах, полимерах из побочных продуктов в полупроводниках, сплавах и спец. стёклах переработки руд цветных для инфракрасной оптики металлов получают GeCl4; GeCl4 + 4HOH = H2GeO3 + 4HCl H2GeO3 = GeO2 + HOH GeO2 + 2H2 = Ge + 2HOH SnO2 + C = Sn + 2CO в смазках, сплавах, покрытиях, припоях, как добавка к полимерам и в защитных красочных покрытиях PbS + 3O2 = 2PbO + 2SO2 в аккумуляторах, в пр-ве кабелей, красок, PbO + C = Pb + CO стекла, смазок, бензина, средств защиты от радиации – хорошо задерживает -лучи