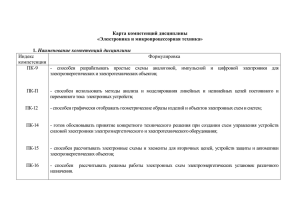
Методические указания по лабораторным работам
advertisement

Электронный учебно-методический комплекс ВВЕДЕНИЕ В БИОТЕХНОЛОГИЮ Учебная программа дисциплины Учебное пособие Методические указания по лабораторным работам Методические указания по самостоятельной работе Банк тестовых заданий в системе UniTest Красноярск ИПК СФУ 2008 УДК 57.01 ББК 30.16 В24 Электронный учебно-методический комплекс по дисциплине «Введение в биотехнологию» подготовлен в рамках реализации в 2007 г. программы развития ФГОУ ВПО «Сибирский федеральный университет» на 2007–2010 гг. по разделу «Модернизация образовательного процесса». Рецензенты: Красноярский краевой фонд науки; Экспертная комиссия СФУ по подготовке учебно-методических комплексов дисциплин В24 Введение в биотехнологию. Версия 1.0 [Электронный ресурс] : метод. указания по лаб. работам / сост. : Т. Г. Волова, Н. А. Войнов, Е. И. Шишацкая, Г. С. Калачева. – Электрон. дан. (2 Мб). – Красноярск : ИПК СФУ, 2008. – (Введение в биотехнологию : УМКД № 143-2007 / рук. творч. коллектива Т. Г. Волова). – 1 электрон. опт. диск (DVD). – Систем. требования : Intel Pentium (или аналогичный процессор других производителей) 1 ГГц ; 512 Мб оперативной памяти ; 2 Мб свободного дискового пространства ; привод DVD ; операционная система Microsoft Windows 2000 SP 4 / XP SP 2 / Vista (32 бит) ; Adobe Reader 7.0 (или аналогичный продукт для чтения файлов формата pdf). ISBN 978-5-7638-1075-2 (комплекса) Номер гос. регистрации в ФГУП НТЦ «Информрегистр» 0320802394 от 01.01.0001 г. (комплекса) Настоящее издание является частью электронного учебно-методического комплекса по дисциплине «Введение в биотехнологию», включающего учебную программу, учебное пособие, методические указания по самостоятельной работе, контрольно-измерительные материалы «Введение в биотехнологию. Банк тестовых заданий», наглядное пособие «Введение в биотехнологию. Презентационные материалы». Методические указания разработаны специалистами Сибирского федерального университета и Института биофизики СО РАН в соответствии с проектом Федерального государственного образовательного стандарта высшего профессионального образования 3-го поколения. Предназначены для студентов направления подготовки бакалавров 020200.62 «Биология» укрупненной группы 020000 «Естественные науки». © Сибирский федеральный университет, 2008 Рекомендовано к изданию Инновационно-методическим управлением СФУ Редактор Н. Ф. Ткачук Разработка и оформление электронного образовательного ресурса: Центр технологий электронного обучения информационно-аналитического департамента СФУ; лаборатория по разработке мультимедийных электронных образовательных ресурсов при КрЦНИТ Содержимое ресурса охраняется законом об авторском праве. Несанкционированное копирование и использование данного продукта запрещается. Встречающиеся названия программного обеспечения, изделий, устройств или систем могут являться зарегистрированными товарными знаками тех или иных фирм. Подп. к использованию 22.09.2008 Объем 2 Мб Красноярск: СФУ, 660041, Красноярск, пр. Свободный, 79 ОГЛАВЛЕНИЕ ПРЕДИСЛОВИЕ ........................................................... 5 МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ» .................................................. 6 Работа 1.1. Планирование эксперимента и построение модели на примере выращивания микроорганизмов....................................... 6 Работа 1.2. Модели роста микроорганизмов ..................................... 10 Работа 1.3. Фазы роста микробиологических культур и расчет кинетических параметров ......................................................................... 14 МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ ................................................... 18 Работа 2.1. Типы ферментационных процессов .............................. 18 Работа 2.2. Периодическое культивирование микроорганизмов и культивирование с подпиткой субстратом .................................... 20 Работа 2.3. Проточные культуры: хемостат, турбидостат ............... 22 Работа 2.4. Проведение процесса ферментации с лимитированием субстрата ..................................................................... 27 Работа 2.5. Определение кинетических параметров культуры по данным эксперимента роста микроорганизмов с лимитированием субстрата ..................................................................... 30 Работа 2.6. Методы выделения и очистки целевого биотехнологического продукта ............................................................... 34 Работа 2.7. Методы анализа содержания основных (общий азот, белок).............................................................. 39 Работа 2.8. Методы анализа запасных (полисахара, биополимеры) клеточных макромолекул........................................... 42 МОДУЛЬ 3. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ ........ 46 Работа 3.1. Выделение ферментов (на примере светящихся белков) .......................................................... 47 Работа 3.2. Методы детекции ферментативной активности ......... 50 МОДУЛЬ 4. ТЕХНОЛОГИЧЕСКАЯ БИОЭНЕРГЕТИКА И БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ ПЕРЕРАБОТКИ МИНЕРАЛЬНОГО СЫРЬЯ ............. 55 МОДУЛЬ 5. БИОТЕХНОЛОГИЯ И ПРОБЛЕМЫ ЗАЩИТЫ ОКРУЖАЮЩЕЙ СРЕДЫ ........................ 56 Введение в биотехнологию. Метод. указания по лабораторным работам -3- ОЛАВЛЕНИЕ. Работа 5.1. Иммобилизация микробных клеток ............................... 56 Работа 5.2. Принцип работы биофильтра с омываемым слоем. Связывание монооксида углерода в реакторе иммобилизированными со-окисляющими бактериями..................... 59 МОДУЛЬ 6. КЛЕТОЧНАЯ И ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ ............................... 64 Работа 6.1. Трансформация клеток E. coli xli-Blue плазмидой pGLO .......................................................................................... 68 Работа 6.2. Экспрессия генов, клонированных в прокариотических системах. Культивирование рекомбинантных клеток E.coli ................................................................ 70 МОДУЛЬ 7. СЕЛЬСКОХОЗЯЙСТВЕННАЯ БИОТЕХНОЛОГИЯ .................................................... 73 Работа 7.1. Депонирование пестицидов в матрикс из разрушаемых биополимеров. Исследование динамики разрушения матрикса в почве ............................................................... 74 МОДУЛЬ 8. ПЕРСПЕКТИВЫ РАЗВИТИЯ БИОТЕХНОЛОГИИ................................ 78 СПИСОК ЛИТЕРАТУРЫ ........................................... 79 Введение в биотехнологию. Метод. указания по лабораторным работам -4- ПРЕДИСЛОВИЕ Биотехнология – новейшее направление, объединяющее достижения комплекса наук биологического и небиологического профиля и имеющее огромное значение для различных сфер хозяйственной деятельности человека – воспроизводства пищевых и лекарственных веществ, минерального сырья и энергетических ресурсов, рационального использования ресурсов биосферы и охраны окружающей среды. Целью настоящего издания, сопровождающего лекционный курс «Введение в биотехнологию», является формирование у студентов представлений о возможностях и уровне биологических технологий и приобретение практических навыков в области основных направлений современной биотехнологии: физиологии микробного роста и развития; промышленной микробиологии, инженерной энзимологии, генетической инженерии и др. В данной работе излагаются принципы и методы освоения студентами теоретических основ биотехнологии, в частности, в промышленной микробиологии, фотогенетической и белковой инженерии и др. В методические указания включены следующие разделы: введение в предмет «Биотехнология»; промышленная микробиология; инженерная энзимология; биотехнология и проблемы защиты окружающей среды; клеточная и генетическая инженерия; сельскохозяйственная биотехнология. Введение в биотехнологию. Метод. указания по лабораторным работам -5- МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ» Цель – дать представление о теоретических и экспериментальных подходах к изучению кинетики микробного роста. Задачи: – обучение методологии теоретико-экспериментального планирования эксперимента, методам построения моделей роста микроорганизмов; – обучение технике культивирования микроорганизмов с регистрацией стадийности роста микроорганизмов. Объект: микробные культуры, лабораторное ферментационное и аналитическое оборудование. Работа 1.1. Планирование эксперимента и построение модели на примере выращивания микроорганизмов Цель работы: приобретение навыков в проведении гетеротрофного культивирования микроорганизмов, в планировании эксперимента и получении модели. Планирование эксперимента применяется для изучения механизмов протекающих биотехнологических процессов и их оптимизации. Задачей планирования является выбор необходимых для эксперимента опытов, методов математической обработки их результатов и принятия решений. Планирование эксперимента предполагает активное вмешательство в процесс и возможность выбора в каждом опыте тех факторов, которые представляют интерес. Все способы воздействия на изучаемый объект обозначаются буквой X и называются факторами. Каждый фактор может принимать в опыте одно из нескольких значений, такие значения называются уровнями. При планировании эксперимента полученные результаты должны быть воспроизводимыми, а объект управляем. Общую схему реализации эксперимента представляют в следущем виде: Введение в биотехнологию. Метод. указания по лабораторным работам -6- МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ» Работа 1.1. Планирование эксперимента и построение модели на примере выращивания микроорганизмов Сбор и анализ данных по культивированию Выбор факторов (критериев оптимизации) Постановка эксперимента по матрице планирования Получение обобщающей зависимости Проверка адекватности модели и значимости коэффициентов Экспериментальная проверка расчетных параметров Оптимизация модели В данной работе в качестве переменного фактора приняты температура рабочей жидкости X1, концентрация фруктозы Х2 и объем рабочей среды X3. Выходным параметром является удельная скорость роста биомассы микроорганизмов Y при гетеротрофном культивировании. Материалы и оборудование: 1. Музейная культура штамма R. eutrophus B-5786; 2. Стерильный раствор базового фосфатного буфера для среды; 3. Маточные стерильные растворы микроэлементов, железа лимоннокислого, сульфата магния и хлористого аммония; 4. Шпатели, спиртовка, мерная посуда, пипетки, колбы для выращивания бактерий, резиновые пробки с микробиологическими фильтрами; 5. Термостатируемая качалка. Ход работы: 1. Рассчитать количество необходимых опытов по формуле N = 2n, где n – количество факторов X1, X2, X3. 2. Построить матрицу планирования в виде табл. 1.1. Введение в биотехнологию. Метод. указания по лабораторным работам -7- МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ» Работа 1.1. Планирование эксперимента и построение модели на примере выращивания микроорганизмов Таблица 1.1 Матрица планирования Эксперимент 1 2 3 4 5 6 7 8 X1 + + + + - X2 + + + + - X3 + + + + - 3. Принять средний (нулевой) уровень и шаг варьирования: температура X10 = 28 0C, шаг h = 2; концентрация фруктозы X20 = 8 г/л, шаг h = 4; объем среды в колбе X30 = 80 мл, шаг h = 20. 4. Согласно требованиям, представленным в табл. 1.1, провести эксперимент: – разделиться на две группы; – каждой группе приготовить питательную среду с заданным значением концентрации фруктозы (12 г/л и 4 г/л); – в микробиологическом боксе к 0,5 л среды в стерильных условиях над спиртовкой добавить 2,5 мл стандартного раствора железа, 1,5 мл раствора микроэлементов, 2 мл раствора сульфата магния и требуемый объем раствора хлорида аммония (в 1 мл которого содержится 100 мг соли); – около 200 мл среды отбросить; – оставшиеся 300 мл среды засеять инокулятом, смыв культуру с одного музейного “косяка”(использовать шпатели); – инокулят разлить в ферментационные колбы требуемого объема (колбы с объемом рабочей жидкости по 100 и 60 мл); – колбы плотно закрыть пробками; – колбы подписать согласно номеру эксперимента; – на ФЭК измерить оптическую плотность (без разведения) каждого инокулята; – колбы установить на качалку. 5. По истечении 15 часов культивирования через каждые 30 мин провести измерения оптической плотности культуры, по калибровочной кривой определить концентрацию биомассы в культуре, рассчитать удельную скорость роста Y, ч-1. 6. Данные занести в табл. 1.2. Введение в биотехнологию. Метод. указания по лабораторным работам -8- МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ» Работа 1.1. Планирование эксперимента и построение модели на примере выращивания микроорганизмов Таблица 1.2 Матрица планирования в размерных параметрах Эксперимент X1 X2 X3 Yi Yср 7. Построить матрицу планирования (табл. 1.3) в безразмерном виде. Таблица 1.3 Матрица планирования в безразмерном виде Эксперимент 1 2 3 4 5 6 7 8 x0 x1 x2 x3 +1 +1 +1 +1 +1 +1 +1 +1 +1 -1 +1 -1 +1 -1 +1 -1 +1 +1 -1 -1 +1 +1 -1 -1 +1 +1 +1 +1 -1 -1 -1 -1 Y ср 8. Рассчитать коэффициенты регрессии принятой модели: по зависимости Y = В0 + B1x1+ B2x2+ B3x3 Bi = 1 N N ∑x y i =1 i , i где N – число опытов. 9. Рассчитать построчные дисперсии параллельных опытов S i2 = 1 m ∑ ( yi − ycp ) 2 , m − 1 i =1 где i – строчка матрицы; m – число экспериментов в каждой строчке. 10. Проверить однородность дисперсии по критерию Кохрена (Gp < Gтабл) Gp = S i2max N ∑ Si2 , ш =1 где S 2 i max − максимальная дисперсия из всех построчных. 11. Определить ошибку опытов S y2 = 1 N N ∑S i =1 2 i . Введение в биотехнологию. Метод. указания по лабораторным работам -9- МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ» Работа 1.1. Планирование эксперимента и построение модели на примере выращивания микроорганизмов 12. Провести расчет дисперсии коэффициентов регрессии: S ki2 = S y2 N . 13. Проверить значимость коэффициентов регрессии: Рассчитать коэффициент Стьюдента t ip = Bi , S ki2 где Bi – коэффициент регрессии: Определить табличный коэффициент Стьюдента tst и проверить условие tip < tst. 14. Провести расчет адекватности дисперсий: 2 S 2 ad m N = ∑ (ycp − y *) , N − m i =1 где уср – среднее значение из всех повторностей в каждой строке; y* – значение, рассчитанное по уравнению регрессии. 15. Провести расчет адекватности модели: расcчитать критерий Фишера Fp= S2ad/S2y; определить табличный критерий Fтаб и осуществить их сравнение. 16. Провести анализ полученной модели. Вопросы: 1. Каков порядок планирования эксперимента? 2. В чем заключаются основные положения метода наименьших квадратов? 3. Каким образом осуществляется проверка адекватности модели? 4. Назовите достоинства и недостатки однофакторного эксперимента. Работа 1.2. Модели роста микроорганизмов Цель работы: построение модели для расчета удельной скорости роста биомассы в условиях сбалансированного субстрата при гетеротрофном культивировании бактерий Ralstonia eutropha. Задача составления уравнения для расчета скорости роста популяции может быть решена на основе анализа механизма протекающих в клетке процессов, основу которых составляют последовательности ферментативных ре- Введение в биотехнологию. Метод. указания по лабораторным работам -10- МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ Работа 1.3. Фазы роста микробиологических культур и расчет кинетических параметров акций. Однако этот путь является практически мало применяемым вследствие того, что исследованных к настоящему времени внутриклеточных реакций много и нет возможности построить математическую модель с большим количеством сложных реакций. Другой путь решения поставленной задачи построения модели, сводится к анализу лишь некоторого числа переменных, характеризующих развитие популяции, или конечного числа обобщенных ферментативных реакций ответственных за эти переменные. В этой связи, разработка математической модели кинетики сводится к объединению групп процессов, протекающих в клетках, анализу влияния факторов среды на протекание процессов и идентификации параметров модели. В качестве низшего уровня при разработке кинетической модели обычно рассматривают исследования, связанные с анализом внутриклеточных процессов. При этом достаточная глубина разработки кинетической модели может быть реализована при рассмотрении кинетики роста микробных популяций с учетом обобщенных ферментативных реакций, возрастной неоднородности клеточной популяции и физиолого-биохимической структуры популяции. На более высоком иерархическом уровне рассматриваются кинетические модели утилизации субстрата, роста клеток и образования продукта (рис. 1.1). Модель популяции микроорганизмов Кинетика утилизации субстрата Кинетика роста клеток Кинетика обобщенных ферментативных реакций Кинетика образования продуктов метаболизма Кинетика с учетом возрастной неоднородности Рис. 1.1. Иерархическая схема разработки кинетической модели популяции микроорганизмов В данной работе рассматривается кинетика утилизации субстрата при гетеротрофном культивировании бактерий. При культивировании водородных бактерий Ralstonia eutropha обычно используется сбалансированный питательный состав, за основу которого принята солевая среда Шлегеля: Na2HPO4·H2O – 9,1; KH2PO4 – 1,5; MgSO4·H2O – 0,2; Fe3C6H5O7·7H2O – 0,025 (г/л). Микроэлементы вводятся по прописи Хоагланда из расчёта 3 мл стандартного раствора на 1 л среды. Стандартный раствор содержит: H3BO3 – 0,288; CoCl2·6H2O – 0,030; CuSO4·5H2O – 0,08; MnCl2·4H2O – 0,008; ZnSO4·7H2O – 0,176; NaMoO4·2H2O – 0,050; NiCl2 – 0,008 (г/л). В качестве субстратов могут быть приняты хлористый аммоний и фруктоза. Из ферментативного катализа известны две принципиально различные простейшие кинетические схемы, приводящие к дискриминируемым зависимостям скорости процесса от концентраций двух субстратов. С учетом авто Введение в биотехнологию. Метод. указания по лабораторным работам -11- МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ Работа 1.3. Фазы роста микробиологических культур и расчет кинетических параметров каталитического процесса микробного роста эти две схемы могут быть представлены в следующем виде: S2 S1+N ↔ S1N ↔ S1S2N → 2N+P ; (1) S1+N ↔ S1N → X+P S2+X ↔ S2X → 2N+P, (2) где S1 и S2 – концентрации субстратов; N – «ненасыщенная» форма клетки; X – «насыщенная» форма клетки, способная к делению; P – продукт. Механизм (1) включает две обратимые равновесные стадии присоединения субстратов (механизм тройного комплекса). Механизм (2) включает стадии присоединения субстратов, которые, по крайней мере, разделены одной необратимой стадией (пинг-понг-механизм). Для механизма группы (2) характерна следующая зависимость от концентрации субстратов: µ= µm , K1 K 2 + 1+ S1 S2 (3) где K1 и K2 – эффективные константы сродства микроорганизма к субстратам S1 и S2. Для механизмов группы (1) уравнение удельной скорости роста может быть записано в виде µ= µm K K K 1+ 2 + 1 2 S2 S1 S 2 . (4) Дальнейшие исследования сводятся к анализу уравнений (3) или (4). Для этого проводят исследования и строят зависимость вида µ = f( S1;S2) (рис. 1.2). Введение в биотехнологию. Метод. указания по лабораторным работам -12- МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ Работа 1.3. Фазы роста микробиологических культур и расчет кинетических параметров µ, ч-1 0.25 0.2 0.15 -1 -2 -3 -4 0.1 0.05 0 0 1 2 3 4 5 6 7 8 S1 , кг/м3 9 Рис.1.2. Изменение удельной скорости роста суммарной биомассы от концентрации фруктозы S1. Экспериментальные точки (1–4): 1 – S2 = 1,2 кг/м3; 2 – 0,6; 3 – 0,4; 4 – 0,2 Обработка экспериментальных данных (рис. 1.3–1.4) позволяет получить значения эффективных констант сродства микроорганизма к субстратам K1 и K2. 1/µ, ч -1 -2 -3 10 tgϕ = K аз µm + K аз K фр µ m X фр 8 6 4 2 0 1 2 3 5 1/Xаз, м3/кг 4 Рис. 1.3. Зависимость удельной скорости роста суммарной биомассы от концентрации субстратов в обратных координатах. Точки (1 – 3, данные рис.1.2): 1 – Xфр = 1кг/м3; 2 – 2,5; 3 – 8. Точки (1 – 3): 1 – Xфр = 1кг/м3; 2 – 2,5; 3 – 8 1/µm, ч 4.5 4 µm = 1/3.6 ; Kаз = µm × tg ϕ = 0.277×0.18 = 0.05 3.5 0 1 3 4 5 1/Xаз,м3/г Рис. 1.4. Зависимость кинетических параметров 1/µm от 1/Xаз Материалы и оборудование: 1. Музейная культура штамма R. eutrophus B-5786; 2. Стерильный раствор базового фосфатного буфера для среды; Введение в биотехнологию. Метод. указания по лабораторным работам -13- МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ Работа 1.3. Фазы роста микробиологических культур и расчет кинетических параметров 3. Маточные стерильные растворы микроэлементов, железа лимоннокислого, сульфата магния и хлористого аммония; 4. Шпатели, спиртовка, мерная посуда, пипетки, колбы для выращивания бактерий, резиновые пробки с микробиологическими фильтрами; 5. Термостатируемая качалка. Ход работы: 1. Разделиться на 4 группы по числу заданных значений концентрации хлористого аммония в среде (0,2; 0,4; 0,6 и 1,2 кг/м3) и концентрации фруктозы (1; 2; 4; 8 кг/м3). 2. Каждой группе приготовить варианты питательной среды для бактерий с заданным значением концентраций фруктозы и азота: – в микробиологическом боксе к 0,5 л среды в стерильных условиях над спиртовкой добавить 2,5 мл стандартного раствора железа, 1,5 мл раствора микроэлементов, 2 мл раствора сульфата магния и требуемый объем раствора хлорида аммония (в 1 мл которого содержится 100 мг соли); – около 200 мл среды отбросить; – оставшиеся 300 мл среды засеять инокулятом, смыв культуру с одного музейного “косяка”(использовать шпатели); – инокулят разлить в ферментационные колбы объемом 100 мл; – колбы плотно закрыть пробками; – колбы подписать согласно номеру эксперимента; – на ФЭК измерить оптическую плотность (без разведения) каждого инокулята; – колбы установить на качалку. 3. По истечении 15 часов культивирования через каждые 30 мин (осуществить четыре повторности) провести измерения оптической плотности культуры и по калибровочной кривой определить концентрацию биомассы в культуре, а затем рассчитать удельную скорость роста µ, ч-1. 4. Данные представить в виде графической зависимости (рис.1.2). 5. Построить зависимости 1/ µ = f (1/S1) и 1/ µ= f (1/S2) и определить вид механизма и константы, входящие в уравнения (3) или (4). 6. Оформить работу и сделать выводы. Вопросы: 1. Какими методами определяют удельную скорость роста микроорганизмов? 2. Периодическое и непрерывное культивирование. 3. Модели роста культуры. Работа 1.3. Фазы роста микробиологических культур и расчет кинетических параметров Цель работы: знакомство с циклом развития микробных культур и спецификой фаз периодической культуры. Введение в биотехнологию. Метод. указания по лабораторным работам -14- МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ Работа 1.3. Фазы роста микробиологических культур и расчет кинетических параметров В простой гомогенной периодической культуре все ее части находятся в одинаковых условиях. Различные фазы роста такой культуры (рис. 1.5) отражают изменения в биомассе и в окружающей среде. Периодическая культура начинается с лаг-фазы, которая является совершенно необязательной фазой роста. Ее возникновение зависит от несоблюдения оптимальных условий для роста посевного материала. Происходит перепад концентраций элементов питания, особенно углеродного, от сниженных – в выросшей культуре, из которой берется посевной материал, к высоким – в свежей среде. Рис 1.5. Фазы на кривой роста периодической культуры: I – лаг-фаза; II – фаза ускорения роста; III – фаза экспоненциального роста; IV – фаза замедления роста; V – стационарная фаза; VI – фаза отмирания Истощенные клетки старого посевного материала должны перейти из состояния голодания или отравления в состояние, соответствующее способности к размножению, которое определяется необходимым количеством и состоянием рибосом, способностью и условиями к репликации хромосом, синтезу клеточной стенки и т. п. Далее следует экспоненциальная фаза, в наибольшей степени характеризующая и выражающая способность культуры к размножению. В этой фазе сведены к минимуму все лимитирующие и ингибирующие влияния. Компоненты питательной среды имеются в избытке, продукты обмена еще не накопились. Рост идет с максимально возможной скоростью, генетически заложенной в клетке. Если же среда по своему начальному составу не оптимальна, то рост будет ограничен неподходящим питанием или неоптимальным значением рН и т. п. В этом случае рост может быть описан более пологой экспонентой или прямой. Эта фаза в лабораторных условиях не может быть длительной, так как даже не очень плотная популяция вскоре начнёт испытывать недостаток в кислороде из-за его быстрого поглощения и слабой растворимости. Введение в биотехнологию. Метод. указания по лабораторным работам -15- МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ Работа 1.3. Фазы роста микробиологических культур и расчет кинетических параметров Фаза замедления роста может быть очень разнообразной и самой сложной. Она может полностью отсутствовать на простых синтетических средах, когда рост сразу останавливается из-за отсутствия одного элемента питания, в особенности – источника углерода и энергии. Рост клеток прекращается, и наступает стационарная фаза, в данном случае – фаза голодания по использованному элементу питания. На сложных средах, содержащих несколько источников углерода, может происходить поочередная их утилизация и постепенное замедление роста. При избытке питания рост замедляется из-за накопления продуктов метаболизма. Токсичные продукты метаболизма у микроорганизмов весьма разнообразны. Возможно одновременное отравление и голодание. В соответствии с этим и стационарная фаза может содержать самые разнокачественные клетки: живые, но голодающие, живые, но ингибированные, отмирающие по причине голодания или отравления. Стационарная фаза не характеризует культуру, так как в этот период состояние клеток может быть самым разнообразным. Только экспоненциальная фаза до некоторой степени характеризует свойства культуры. Таким образом, клетки периодической культуры претерпевают значительные изменения всех свойств по всему периоду роста, обусловленные непрерывными изменениями окружающей среда и быстрой реакцией на них клеток. Тем не менее периодические методы культивирования микроорганизмов широко используются в настоящее время в промышленной биотехнологии и исследовательской практике. Техника периодической культуры позволяет получить исходные данные, и расходные коэффициенты, и кинетические характеристики культуры, необходимые для перехода к проточным системам и масштабированию процесса. Материалы и оборудование: 1. Музейная культура штамма R. eutrophus B-5786; 2. Стерильный раствор базового фосфатного буфера для среды; 3. Маточные стерильные растворы микроэлементов, железа лимоннокислого, сульфата магния и хлористого аммония; 4. Шпатели, спиртовка, мерная посуда, пипетки, колбы для выращивания бактерий, резиновые пробки с микробиологическими фильтрами; 5. Термостатируемая качалка. Ход работы: 1. Приготовить питательную среду для выращивания бактерий: – в микробиологическом боксе к 0,5 л основной среды (фосфатный буфер) в стерильных условиях над спиртовкой добавить 2,5 мл стандартного раствора железа, 1,5 мл раствора микроэлементов, 2 мл раствора сульфата магния и требуемый объем раствора хлорида аммония (в 1 мл которого содержится 100 мг соли); углеродный субстрат ( из расчета 10 г/л фруктозы); – инокулят разлить в 10 ферментационных колб по 100 мл (10 колб для периодической культуры), используя стерильную мерную посуду; Введение в биотехнологию. Метод. указания по лабораторным работам -16- МОДУЛЬ 1. ВВЕДЕНИЕ В ПРЕДМЕТ «БИОТЕХНОЛОГИЯ Работа 1.3. Фазы роста микробиологических культур и расчет кинетических параметров – колбы плотно закрыть ватно-марлевыми пробками; – колбы подписать (например, 1а, 1б, 1в и т. д.); – измерить исходную оптическую плотность культуры. 2. Колбы установить на качалку. 3. Периодически производить отбор проб для измерения оптической плотности культуры на ФЭК и микроскопирования клеток. В колбы, предназначенные для подпитки, через 12, 24 и 36 ч после начала культивирования внести дополнительный субстрат (раствор фруктозы из расчета 10 г/л). 4. Данные занести в табл. 1.4. Таблица 1.4 Показатели роста культуры R.eutropha в ходе развития периодической культуры Группа № 1. Время от начала опыта, ч Исходные Показатели инокулята ОП Х, г/л 1 2 3 4 5 Текущие показатели культуры ОП Х, г/л 5. По результатам эксперимента построить кривые роста культур (по накопления биомассы в культуре) бактерий. Вопросы: 1. Какие исследования позволяет проводить техника периодического культивирования микроорганизмов? 2. В чем «узкие» места периодической культуры? 3. Каковы отличия и преимущества периодического режима культивирования микроорганизмов с подпиткой субстратом, тубулярной культуры и непрерывных культур? Введение в биотехнологию. Метод. указания по лабораторным работам -17- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Цель – продемонстрировать методы и возможности промышленной микробиологии; ознакомить с типами управляемого культивирования микроорганизмов для получения кинетических констант, расчета параметров биотехнологических процессов и получения целевых продуктов. Задачи: – обучение технике культивирования микроорганизмов в проточных режимах; – продемонстрировать возможности методологии теоретикоэкспериментального подхода для нахождения продукционных характеристик и кинетических констант продуцирующей микробной культуры в условиях оптимального и лимитированного по субстрату роста; – обучение методам влияния параметров ферментации и состава питательных сред на биохимическую программу синтеза клеточных основных и запасных макромолекул; – ознакомление с современными методами выделения и очистки целевых продуктов из микробной биомассы; – освоение методов количественного анализа внутриклеточного пула макромолекул (белков, полисахаров, биополимеров). Работа 2.1. Типы ферментационных процессов Цель работы: дать представление о технике и методах культивирования микроорганизмов. Стадия ферментации является основной стадией в биотехнологическом процессе. На этой стадии происходит взаимодействие продуцента с субстратом и образование целевых продуктов (биомасс, эндо- и экзопродуктов). Эта стадия осуществляется в биохимическом реакторе (ферментере) и может быть организована в зависимости от особенностей используемого продуцента и требований к типу и качеству конечного продукта различными способами. Ферментация может проходить в строго асептических условиях или без соблюдения правил стерильности (так называемая «незащищенная» ферментация). Ферментация может осуществляться на жидких (жидкофазная) и на твердых (твердофазная) средах; анаэробно и аэробно. Аэробная ферментация может протекать поверхностно или глубинно (во всей толще питательной среды). Обеспечение процесса ферментации сводится к дозированному поступлению в ферментер потоков (инокулята, воздуха (или газовых смесей), питательных биогенов, пеногасителей) и отвода из него тепла, отработанного воздуха, культуральной жидкости, а также измерению и стабилизации основных параметров процесса на уровне, требуемом для оптимального развития продуцента и образования целевого продукта. Принципиальная технологическая схема ферментационного процесса представлена на рис. 2.1. Введение в биотехнологию. Метод. указания по лабораторным работам -18- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.1. Типы ферментационных процессов , в о р т е м а р а п а кв о н а тс У м я л е д о м . ат м о п .ч .т в ы ой кту нч д ли о р аз П 2 р 2 )М В П ЭТ У ( С Р А А С не ц н о К ы ат р т и н е п е ст и р нт е ц н о к и я и н а в о р и кт с и оч 6 1 3 2 ы с ас м о и Б 2 2 е ), ые ы н ов ы и мв и кц рж о ав к( и ки ч ат д о нз е Т 1 2 ы кту д о р п е ы н аз р б о о аз Г я и ц а м р о ф н И е и н е л в а р п У 9 1 0 2 7 1 4 1 8 1 6 1 к 5 1 ос П Н р ои б ю а и н ц ыа д д о а х р г тО е д 6 1 к 9 8 Н р П ос П В В А П е и н а в и л в а д е р е П 6 1 к р С 0 1 6 1 к с о П В р С 1 1 8 2 1 р С 3 1 7 6 5 4 3 2 м уу к 1 а В Рис. 2.1. Принципиальная схема реализации биотехнологических процессов: 1 – реактор для приготовления сред, 2 – вихревой насос, 3 – аппарат для приготовления твердых сред, 4 – паровая колонка для подогрева сред до температуры стерилизации, 5 – выдерживатель сред при температуре стерилизации, 6 – теплообменник для охлаждения сред, 7 – мерник – сборник питательной среды, 8 – дозатор, 9 – анаэробный ферментер, 10 – глубинный аэробный ферментер, 11 – биокаталитический реактор, 12 – ферментер для поверхностной твердофазной ферментации, 13 – то же для поверхностной жидкостной ферментации, 14 – экстрактор, 15 – сепаратор для отделения биомассы, 16 – система локальной автоматики, 17 – плазмолизатор биомассы, 18 – дезинтегратор биомассы, 19 – выпарная установка, 20 – фракционирование дезинтегратов, 21 – сушилка и другие аппараты для обезвоживания, 22 – аппаратура для расфасовки продукта, 23 – ионообменные колонны, аппараты для химических и мембранных методов выделения, центрифуги, фильтры, кристаллизаторы и др. устройства. Условные обозначения: рН – раствор для коррекции рН, П – компоненты и среды для подпитки, Пос – посевной материал, В – сжатый воздух, ПАВ – пеногаситель, Ср – стерильная питательная среда, БА – биологический агент Введение в биотехнологию. Метод. указания по лабораторным работам -19- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.1. Типы ферментационных процессов Материалы и оборудование: 1. Термостатируемая качалка-шейкер для культивирования микроорганизмов; 2. Лабораторный ферментационный комплекс «Bio- Flo”; 3. Опытное производство биополимеров. Ход работы: Проведение экскурсии и знакомство с типами ферментационных процессов: - периодическим аэробным жидкофазным; - проточным в лабораторном ферментере на гетеротрофном субстрате; - проточном в лабораторном ферментере на газовом субстрате; - посещение опытного производства биополимеров. Работа 2.2. Периодическое культивирование микроорганизмов и культивирование с подпиткой субстратом Цель работы: обучение технике культивирования микроорганизмов в режиме периодического процесса. Культуры микроорганизмов можно подразделять на «открытые» и «закрытые» системы. Закрытой называют такую систему, в которой хотя бы один из существенных компонентов не может ни поступать в систему, ни покидать ее. Простая периодическая культура, содержащая ограниченное первоначальное количество питательного субстрата, служит примером закрытой системы. В закрытой системе скорость роста биомассы должна стремиться к нулю либо из-за недостатка субстрата, либо из-за непереносимости продукта при его дальнейшем накоплении. Такие системы всегда находятся в неустойчивом состоянии. Процесс выращивания микроорганизмов до недавнего времени представлялся довольно простым, идущим через ряд принципиально общих стадий, приводящих к получению из ничтожного количества посевного материала значительного количества биомассы или биомассы и продуктов метаболизма. Кривая роста – это суммарная запись истории роста культуры. Фазы роста не столько изучались, сколько просто описывались. После лаг-периода наблюдается максимальная скорость роста, затем рост прекращается либо из-за недостатка источников питания, либо из-за накопления ингибирующих продуктов, либо из-за некоторых изменений в физических свойствах среды. После того как биомасса достигнет максимума, наступает стационарная фаза, в которой количество биомассы остается постоянным. Затем, раньше или позже, количество биомассы уменьшается в результате метаболических процессов, связанных с поддержанием жизнедеятельности, или автолиза. Продолжительность экспоненциального роста частично зависит от начальной концентрации субстрата, лимитирующего рост. Кажущееся замедление роста, стационарная фаза и фаза отмирания могут наступить, если возникнут некоторые условия, летальные для организ- Введение в биотехнологию. Метод. указания по лабораторным работам -20- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.2. Периодическое культивирование микроорганизмов и культивирование с подпиткой субстратом мов. При этом наблюдаемая скорость роста будет определяться разностью между действительной скоростью роста и скоростью отмирания клеток. Простейшее лабораторное оборудование для выращивания микроорганизмов в периодическом режиме включает термостатируемую качалку или магнитные мешалки, на которые устанавливаются колбы (рис. 2.2). 6 4 3 7 8 1 9 5 2 11 10 12 13 Рис. 2.2. Аппаратурная схема культивирования микроорганизмов в периодическом режиме: 1 – бытовой холодильник; 2 – коллекция штаммов; 3 – бокс-ламинар; 4 – УФ-облучатели; 5 – колба; 6 – фильтр НЕРА; 7 – качалка; 8 – колбы; 9 – платформа для колб; 10 – электродвигатель; 11 – блок термостабилизации; 12 – колбы на магнитных мешалках; 13 – регулятор тока Материалы и оборудование: 1. Музейная культура штамма R. eutrophus B-5786; 2. Стерильный раствор базового фосфатного буфера для среды; 3. Маточные стерильные растворы микроэлементов, железа лимоннокислого, сульфата магния и хлористого аммония; 4. Шпатели, спиртовка, мерная посуда, пипетки, колбы для выращивания бактерий, резиновые пробки с микробиологическими фильтрами; 5. Термостатируемая качалка, газгольдер, вакуумный насос, газовые субстраты (водород, кислород, углекислота). Ход работы: 1. Приготовить питательную среду для выращивания бактерий: в микробиологическом боксе к 0,5 л основной среды (фосфатный буфер) в стерильных условиях над спиртовкой добавить 2,5 мл стандартного раствора железа, 1,5 мл раствора микроэлементов, 2 мл раствора сульфата магния и требуемый объем раствора хлорида аммония (в 1 мл которого содержится 100 мг соли); углеродный субстрат (из расчета 10 г/л фруктозы). 2. Инокулят разлить в три ферментационные колбы по 100 мл (пять биологических повторностей для периодической культуры и 5 – для культуры с подпиткой субстратом), используя стерильную мерную посуду. 3. Колбы плотно закрыть резиновыми пробками; 4. Колбы подписать (например, 1а, 1б, 1в и т.д.); Введение в биотехнологию. Метод. указания по лабораторным работам -21- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.2. Периодическое культивирование микроорганизмов и культивирование с подпиткой субстратом 5. Измерить исходную оптическую плотность культуры; 6. Колбы установить на качалку; 7. В 5 колб для культивирования с подпиткой субстратом через 12, 24 и 36 ч после начала роста культуры внести добавку углеродного субстрата ( из расчета 1-2 г/л л); 8. Периодически производить отбор проб для измерения оптической плотности культуры на ФЭК и микроскопирования клеток. 9. Данные занести в табл. 2.1. Таблица 2.1 Показатели роста культуры R. eutropha в ходе развития периодической культуры Группа №1 Время от начала опыта, ч № 2 ( с подпиткой субстратом) Время от начала опыта, ч кулята ОП Исходные показатели иноХ, г/л Текущие показатели культуры ОП Х, г/л 1 2 3 4 5 1 2 3 4 5 10. По результатам эксперимента построить кривую накопления биомассы культур. Вопросы: 1. Каковы основные требования к организации периодического культивирования микроорганизмов? 2. Какие основные характеристики микробного роста в периодической культуре? 3. Каковы отличия и преимущества периодического режима культивирования микроорганизмов с подпиткой субстратом? Работа 2.3. Проточные культуры: хемостат, турбидостат Цель: дать представление о методах, инструментальном оформлении и возможностях метода проточных культур. Метод проточного культивирования вошел в микробиологию и базируется на процессах химической технологии. Принцип проточного культивиро Введение в биотехнологию. Метод. указания по лабораторным работам -22- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.3. Проточные культуры: хемостат, турбидостат вания состоит в том, что в сосуд, где размножаются микроорганизмы, непрерывно подается свежая питательная среда и одновременно вытекает такой же объем культуры. По такому принципу организуются два различных процесса культивирования: процесс полного вытеснения и процесс полного смешения. В первом случае сосуд для выращивания представляет собой трубку, тубулярный ферментер, в которой втекают среда и посевной материал и вытекает культура. Перемешивание не производится (рис. 2.3). Х0 Х 0 + S0 + P S0 Рис. 2.3. Схема тубулярного биореактора полного вытеснения: s r – концентрация субстрата в поступающей среде; i – то же в вытекающей среде; s 1 – то же в ферментере; плотности: х± – подаваемой популяции, х 2 – вытекающей культуры; х – популяции в ферментере Подобным образом можно культивировать микроорганизмы, не требующие аэрации. У одного конца ферментера, куда подается среда и культура, клетки находятся в начале стадии роста; по мере прохождения клетками трубки культура "стареет", исчерпывается субстрат, накапливаются продукты метаболизма и перед вытеканием культура находится в состоянии, аналогичном стационарной фазе роста периодической культуры. Таким образом, в трубке воспроизводится полная кривая роста, но не во времени, а в пространстве. Непрерывные процессы. В непрерывных процессах биообъект постоянно поддерживается в экспоненциальной фазе роста. Обеспечивается непрерывный приток свежей питательной среды в биореактор и отток из него культуральной жидкости, содержащей клетки и продукты их жизнедеятельности. Фундаментальным принципом непрерывных процессов служит равновесие между приростом биомассы за счет деления клеток и их убылью в результате разбавления свежей средой: μ =D , где μ — удельная скорость роста клеток, D — коэффициент разбавления (скорость убыли концентрации клеток). Различают хемостатный и турбидостатный режимы непрерывного культивирования. В процессе полного смешения рост происходит в емкости – ферментере при интенсивном перемешивании (рис. 2.4). Введение в биотехнологию. Метод. указания по лабораторным работам -23- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.3. Проточные культуры: хемостат, турбидостат 1 2 1 3 2 4 5 6 3 A Б Рис. 2.4. Схемы биореакторов для проточного культивирования микроорганизмов: А – хемостат; Б – турбидостат с автоматической регуляцией оптической плотности; 1 – поступление среды, 2 – мешалка, 3 – сток культуры, 4 – насос, 5 – фотоэлемент, 6 – источник света Перемешивание достигается продуванием воздуха или работой мешалки либо тем и другим способом одновременно. Во всей массе культуры условия должны быть совершенно одинаковыми. Этот метод культивирования называется гомогенно-непрерывным или гомогеннопроточным. В ферментере создаются условия, соответствующие одной точке кривой роста. При быстром протоке среды эти условия близки к быстрому экспоненциальному росту, при медленном – приближаются к условиям стационарной фазы. При таком методе культивирования может быть воспроизведена любая периодическая культура от начала замедления роста после экспоненциальной фазы и до конца стадии замедления роста. В установившемся режиме скорость протока среды равняется удельной скорости роста культуры. При этом культура находится в устойчивом состоянии динамического равновесия и обладает способностью подстраиваться к изменениям условий. При хемостатном режиме культивирования в биореактор с постоянной контролируемой скоростью вливают питательную среду, один из компонентов которой, часто Ог, поступает в количестве, не достаточном для обеспечения максимальной скорости роста культуры. В этом случае реактор с биообъектом приобретает свойства саморегулирующейся системы, автоматически удовлетворяющей равенству μ =D . Если первоначально скорость разбавления и вымывания биомассы превышает скорость роста клеток, то наступает разбавление культуры свежей средой. Это ведет к повышению концентрации компонента, ограничивающего рост, вследствие чего скорость роста культуры увеличивается. Как только μ превысит D, в реакторе начинает концентрироваться биомасса. Увеличивающаяся популяция клеток все активнее «выедает» субстрат, его концентрация падает, что, в свою очередь, ведет к торможению роста культуры. Таким образом, после серии затухающих колебаний скорость роста культуры становится равной скорости ее разбавления. Введение в биотехнологию. Метод. указания по лабораторным работам -24- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.3. Проточные культуры: хемостат, турбидостат Биореактор, работающий в хемостатном режиме культивирования, называют хемостатом. Он включает: 1) устройство для вливания питательной среды; 2) выпускное приспособление для оттока культуральной жидкости с клетками; 3) систему контроля скорости протока (рис. 2.4, А). Один из простейших вариантов хемостата содержит насос, постоянно нагнетающий питательную среду в биореактор, и выпускную трубу, по которой жидкость из биореактора вытекает, как только ее уровень поднимается выше горловины этой трубы. Альтернативный вариант — выпускная труба входит в полость биореактора сверху и нижний обрез ее горловины соответствует уровню, выше которого жидкость не должна подниматься. Если этот уровень превышен, избыток культуральной среды с клетками отсасывается насосом, подсоединенным к выпускной трубе. Турбидостатный режим культивирования основан на прямом контроле концентрации биомассы. Наиболее распространено измерение светорассеяния содержимого биореактора с помощью фотоэлемента. Сигнал от фотоэлемента управляет скоростью протока жидкости, в свою очередь определяющего скорость роста культуры (рис. 2.4, Б). Повышение концентрации клеток и соответственно светорассеяния автоматически приводят к ускорению протока жидкости, разбавляющей культуру, и, наоборот, убыль биомассы компенсируется замедлением протока. Концентрация клеток может оцениваться также по косвенным критериям (по измерению рН, убыли субстрата или накоплению продуктов жизнедеятельности). Непрерывное культивирование, осуществляемое в одном биореакторе, обозначается как одностадийное. Многостадийное культивирование с последовательным или каскадным расположением реакторов позволяет внедрить принцип дифференцированных режимов в непрерывные биотехнологические процессы. Эти дифференцированные режимы не сменяют друг друга во времени, а одновременно осуществляются в последовательно расположенных аппаратах. Например, в первом из биореакторов создают оптимальные условия для роста культуры, а во втором — для биосинтеза целевого продукта. Принципиальная схема лабораторного биореактора (ферментера) представлена на рис. 2.5. Введение в биотехнологию. Метод. указания по лабораторным работам -25- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.3. Проточные культуры: хемостат, турбидостат оборот ный воздух 12 9 10 ВР21 11 пар 15 ВР2 0 8 28 27 ВР21 ВЗ5 4 1 2 30 ВЗ7 ВЗ6 7 23 16 26 ВР2 ВР18 ВР10 вода 13 3 вода воздух ВР3 22 24 25 6 ВР22 5 18 29 19 20 17 14 ВР15 Рис. 2.5. Аппаратурная схема ферментёра-инокулятора: 1 – биореактор; 2 – барботёр; 3 – теплообменная рубашка; 4 – измерительная ячейка; 5 – турбинная мешалка; 6 – термопара; 7 – регулирующий клапан; 8 – контактный термометр; 9 – дифференциальный манометр; 10 – диафрагма; 11 – конденсатор; 12 – сепаратор; 13 – фильтр стерилизации воздуха; 14 – компрессор; 15 – перистальтический насос; 16 – ёмкости для подпитывающих растворов; 17 – электродвигатель; 18 – шкив; 19 – ремень привода; 20 – электро-контактный манометр; 22 – 24, 26 фильтры; 25 – редуктор; 27 – вход и выход воды; 28 – штуцер; 29 – крепёжные гайки; 30 – манометр Материалы и оборудование: 1. Лабораторный ферментационный комплекс «Bio-Flo»; 2. Стерильные растворы для приготовления питательной среды; 3. Инокулят (посевная культура); 4. ФЭК; 5. Стеклянная посуда, колбы, мерные стаканы, пипетки, бюксы. Ход работы: 1. В микробиологическом боксе (или боксе-ламинаре) из маточных стерильных растворов приготовить 1 л питательной среды; 2. В обработанную УФ-облучателями комнату внести необходимое оборудование (среда, инокулят); 3. Склянку со средой соединить с насосом-дозатором, подключенным к ферментеру; 4. В ферментер влить инокулят (1 л); 5. Включить аэропомпу; 6. Включить систему перемешивания и термостабилизации; 7. Замерить исходную оптическую плотность (ОП) инокулята; 8. Фиксировать в рабочем журнале (таблица 2.2) температуру культуры; Введение в биотехнологию. Метод. указания по лабораторным работам -26- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.3. Проточные культуры: хемостат, турбидостат ры; 9. При достижении температуры культуры 30 0С начнется рост культу- 10. Периодически (через 30 мин) отбирать пробы для определения оптической плотности культуры. При оптической плотности культуры 0,1 (без разведения) включить насос-дозатор на минимальную скорость протока (0,1 ч-1); 11. Ежечасно определять ОП культуры; 12. При увеличении ОП постепенно увеличивать скорость протока среды до состояния steady-state ( величина Х, г/л – постоянна); 13. Вычислить значение удельной скорости роста культуры, определить время достижения состояния steady-state, получить культуру (хранить в холодильнике) для последующих занятий. Вопросы: 1. В чем принципиальное отличие проточной культуры от периодической? 2. Каковы основные требования к организации проточной ферментации? 3. Каковы преимущества проточной культуры? 4. Что позволяет техника проточных культур? Работа 2.4. Проведение процесса ферментации с лимитированием субстрата Цель: освоение техники ведения процесса выращивания микроорганизмов с лимитированием субстрата для нахождения условий роста, влияющих на биохимическую программу синтеза макромолекул. Процессы микробного синтеза делятся на два типа: 1). процессы, связанные с ростом биомассы и происходящие параллельно со скоростью размножения клеток, и 2). процессы, происходящие или ускоряющиеся при замедлении скорости роста клеток. Оптимизация обоих типов процессов осуществляется различными путями в зависимости от того, насколько совпадают (или не совпадают) оптимизация скорости роста со скоростью синтеза макромолекул той или иной природы. Процесс роста – это процесс синтеза первичных метаболитов (аминокислот, органических кислот, витаминов, нуклеотидов, промежуточных продуктов катаболизма) и их сборка в основные клеточные макромолекулы (белки, нуклеиновые кислоты, полимеры, образующие клеточную стенку). Рост и синтез этих продуктов максимален, когда клетка максимально обеспечена субстратом. В периодической культуре это имеет место в экспоненциальной – начале линейной фазы роста. Таким образом, оптимизация процесса накопления максимальной биомассы клеток в культуре и синтеза первичных продуктов обмена сводится к оптимизации условий питания и созданию условий сбалансированного роста для культуры. Накопление продуктов обмена, происходящих во второй фазе развития культуры (конец линейной – ста- Введение в биотехнологию. Метод. указания по лабораторным работам -27- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.4. Проведение процесса ферментации с лимитированием субстрата ционарная фаза), – запасных соединений (полифосфатов, полисахаров, липидов) или вторичных продуктов обмена (антибиотиков, терпенов, стероидов), имеет для микробной технологии большое значение. Накопление запасных соединений в клетках имеет место при несбалансированном росте вследствие исчерпания из среды какого-либо биогена и лимитирования процесса синтеза основных макромолекул. Синтез вторичных продуктов обмена (идиолитов) имеет место в случае замедления и остановки роста клеток в конце развития популяции (конец стационарной фазы – фаза отмирания), когда происходит дерепрессия ферментов, катализирующих реакции образования данных соединений и репрессированных на стадии сбалансированного роста. Оптимизация процесса синтеза запасных соединений и вторичных метаболитов более сложна, так как требует специальных знаний о закономерностях образования тех или иных макромолекул и специфических подходов в каждом конкретном случае. При лимитации роста микроорганизмов отдельными элементами минерального питания происходит замедление скорости роста клеток, сопровождающееся значительными изменениями химического состава, главным образом, соотношения основных и запасных макромолекул. Выявление принципиальных закономерностей этих изменений открывает широкие возможности для направленного изменения составом микробной биомассы и целевого получения конкретных продуктов микробиологического синтеза. Более того, помимо изменения направленности биохимической программы синтеза основных и запасных соединений лимитация роста клеток тем или иным минеральным элементом позволяет дополнительно регулировать химическую структуру отдельных соединений, входящих в состав клеток. Отправным моментом является изменение соотношения C/N в питательной среде. Клетки, лимитированные по азоту и не способные синтезировать основные соединения (белки и нуклеиновые кислоты), потребляя углерод, направляют его на образование различных безазотистых соединений углеводной и липидной природы. Качественный состав запасных соединений, синтезируемых при лимитации роста микроорганизмов по азоту на фоне избытка углерода (увеличение отношения C/N), определяется спецификой физиолого-биохимических свойств конкретных микробных видов, а также штаммов. Материалы и оборудование: 1. Музейная культура штамма R. eutrophus B–5786; 2. Стерильный раствор базового фосфатного буфера для среды; 3. Маточные стерильные растворы микроэлементов, железа лимоннокислого, сульфата магния и хлористого аммония; 4. Шпатели, спиртовка, мерная посуда, пипетки, колбы для выращивания бактерий, резиновые пробки с микробиологическими фильтрами; 5. Термостатируемая качалка (или шейкер-инкубатор). Введение в биотехнологию. Метод. указания по лабораторным работам -28- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.4. Проведение процесса ферментации с лимитированием субстрата Ход работы: 1. Приготовить 4 варианта среды с различными концентрациями хлористого аммония в среде (0,8; 0,4; 0,2 и 0,1 г/л): – в микробиологическом боксе к 0,5 л фосфатного буфера над спиртовкой (или в боксе-ламинаре) добавить 2,5 мл стандартного раствора железа, 1,5 мл раствора микроэлементов, 2 мл раствора сульфата магния и требуемый объем раствора хлорида аммония (в 1 мл которого содержится 100 мг соли); раствор углеродного субстрата (из расчета 5 – 10 г/л фруктозы); – около 200 мл среды отбросить; – оставшиеся 300 мл среды засеять инокулятом, смыв культуру с одной музейной пролбикиго (использовать шпатели); – инокулят разлить в три ферментационные колбы по 100 мл (три биологические повторности), используя стерильную мерную посуду; – колбы закрыть ватно-марлевыми пробками; – колбы подписать (например, 1а, 1б, 1в); – на ФЭК измерить оптическую плотность (без разведения) каждого инокулята; – колбы установить на качалку. 2. В течение 3–4 дней проводить измерения оптической плотности культуры и по калибровочной кривой – определить концентрацию биомассы в культуре Х, г/л. 3. Данные занести в табл. 2.3. Таблица 2.3 Показатели роста культуры R. eutropha при различной обеспеченности азотом Группа №1 Время от начала опыта, ч №2 Время от начала опыта, ч №3 Время от начала опыта, ч №4 Время от начала опыта, ч T, 0C Текущие показатели культуры ОП Х, г/л Введение в биотехнологию. Метод. указания по лабораторным работам -29- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.4. Проведение процесса ферментации с лимитированием субстрата Вопросы: 1. В чем специфика метаболизма водородокисляющих хемоавтотрофных микроорганизмов? 2. В чем основные трудности культивирования газоиспользующих микроорганизмов? 3. Что позволяет фиксировать в ходе культивирования водородных бактерий метод Шлегеля? Работа 2.5. Определение кинетических параметров культуры по данным эксперимента роста микроорганизмов с лимитированием субстрата Цель работы: обучение нахождению основных характеристик микробной культуры на основе экспериментальных результатов. Скорость роста является одним из основных показателей, характеризующих адекватность условий ферментации для микроорганизмов. Скорость роста (увеличение биомассы) организмов с бинарным делением в хорошо перемешиваемой среде в периодической культуре будет пропорциональна концентрации микробной биомассы: dX/d t= µX, (1) где dX/dt – скорость роста, Х – биомасса, µ – коэффициент пропорциональности («удельная скорость роста»); параметр аналогичен сложным процентам (например, если удельная скорость роста равна 0,1 ч–1, значит увеличение биомассы равно 10 % в час). Если величина µ постоянна, как это бывает в установившемся режиме культивирования, то интегрирование представленного уравнения дает lnX = lnX0 +µ t, (2) где Х0 – биомасса в начальный период времени t. График зависимости lnX от времени будет иметь вид прямой линии с наклоном µ. Валовая (или общая) скорость роста v характеризуется абсолютным приростом биомассы за единицу времени: v=dX/dt. (3) Введение в биотехнологию. Метод. указания по лабораторным работам -30- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.5. Определение кинетических параметров культуры по данным эксперимента роста . Обе величины, удельная и общая скорость роста, характеризуют данную культуру в данных условиях и не являются количественной характеристикой штамма. Рост культуры µ характеризуется кривой зависимости плотности популяции (биомассы) Х от концентрации субстрата S, обычно имеющей широкое плато (зону независимости величины биомассы от концентрации биогена) (рис. 2.6, а). Когда скорость роста микробной культуры ограничена не дефицитом субстрата, а воздействием ингибитора, кривая зависимости величины биомассы от концентрации ингибитора имеет иной вид (рис. 2.6, б). Рис. 2.6. Зависимость скорости роста микробной культуры от концентрации субстрата: а – зависимость µ от S (концентрации минерального субстрата); б – зависимость µ от I (концентрации ингибитора) Продуктивность процесса микробного роста характеризуется количеством продукта, получаемого на единицу объема биореактора в единицу времени. Продуктивность процесса зависит от многих факторов: активности продуцента, значений коэффициента выхода продукта из потребленного субстрата, количества активной биомассы в ферментере: П = qs Yp/s X, г/л ч, (4) где qs – скорость потребления субстрата (метаболический коэффициент), Yp/s – выход продукта (экономический коэффициент), X – концентрация биомассы, P – продукт, S – субстрат. Выход продукта Y (экономический коэффициент) определяется как количество продукта, получаемого из данного количества субстрата: Y = X/Sо – S, (5) где S и So – конечная и исходная концентрации субстрата. Данный коэффициент выражает эффективность использования субстрата для получения целевого продукта и является очень важной характеристикой, так как непосредственно связан с продуктивностью и позволяет непосредственно влиять на себестоимость конечного продукта. Экономический Введение в биотехнологию. Метод. указания по лабораторным работам -31- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.5. Определение кинетических параметров культуры по данным эксперимента роста . коэффициент имеет четкий физический смысл, характеризующий степень перехода энергии, заключенной в субстрате, в продукт. Данная величина необходима для расчетов и прогнозирования процесса в целом и используется в качестве параметра для контроля и управления ходом различных процессов и сопоставления их эффективности. Основой для изучения кинетики роста микробных культур является метод острых опытов; этим методом определяют основные показатели роста: субстратную константу Ks, константу ингибирования Ki, максимальную скорость роста µmax и влияние на них внешних факторов. Для этого клетки из экспоненциальной фазы роста помещают на короткий промежуток времени в среды с различной концентрацией исследуемого субстрата и через короткий промежуток времени t2 – t1 измеряют плотность культуры и вычисляют удельную скорость роста по уравнению (2). В контроле скорость роста не лимитирована субстратом, в экспериментальных пробах – лимитирована заданной концентрацией исследуемого субстрата. Полученные результаты обрабатываются по методу обратных величин Лайнуевера и Берка, µmax и Ks строится график зависимости 1/ и 1/S, после этого графически находятся величины (рис. 2.7). Рис. 2.7. Схема определения µmax и Ks методом обратных величин (по Лайнуеверу и Берку): а – зависимость µ от S: б – прямая отсекает 1/µmax и 1/Ks Аналогичным способом находят константу ингибирования (Ki), к пробам растущей культуры добавляют различные дозы ингибитора и заменяют скорость роста при различных концентрациях последнего. Далее строится график, по которому графически определяют искомые величины: µmax и Ki (рис. 2.8). Введение в биотехнологию. Метод. указания по лабораторным работам -32- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.5. Определение кинетических параметров культуры по данным эксперимента роста . Рис. 2.8. Схема определения µmax и Ki методом обратных величин (по Лайнуеверу и Берку): а – зависимость µ от I: б – прямая отсекает 1/µmax и 1/ Ki Материалы и оборудование: Персональный компьютер. Ход работы: 1. Используя известные уравнения, определить значения удельной скорости роста при заданных (четырех) концентрациях азота в среде (из результатов табл.1), а также вычислить продуктивность культуры и экономический коэффициент по азоту. Значения занести в табл. 2.4. Таблица 2.4 Влияние концентрации NH4Cl в среде на характеристики культуры R. Еutropha NH4Cl, Средняя (ваУдельная Продук- Экономиг/л ловая) ско- скорость рос- тивность ческий рость роста та R.eutropha культуры, коэффиR.eutropha г/л ч циент Y, г/г 2. Построить график зависимости удельной скорости роста бактерий R.eutropha от концентрации NH4Cl в среде. μ, 1/ч NH4Cl, г/л 3. Используя графоаналитический метод Лайнуевера – Берка построить график зависимости обратных величин удельной скорости роста от обратной величины концентрации азота в среде. Введение в биотехнологию. Метод. указания по лабораторным работам -33- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.5. Определение кинетических параметров культуры по данным эксперимента роста . 1/μ, ч 1/S NH4Cl, л/г 4. Вычислить и записать найденные значения Ks культуры R. eutropha. Вопросы: 1. Каковы основные продукционные и кинетические характеристики микробных культур? 2. Почему нахождение μmax невозможно экспериментальным путем? 3. Чем отличается характер воздействия на клетку факторов лимитирования и ингибирования роста? Работа 2.6. Методы выделения и очистки целевого биотехнологического продукта Цель работы: дать представление об основных методах получения целевого продукта. Завершающая стадия биотехнологического процесса — выделение целевого продукта. Эта стадия существенно различается в зависимости от того, накапливается продукт в клетке, или он выделяется в культуральную жидкость, или же продуктом является сама клеточная масса. Наиболее сложно выделение продукта, накапливающегося в клетках. Для этого клетки необходимо отделить от культуральной жидкости, разрушить (дезинтегрировать) и далее целевой продукт очистить от массы компонентов разрушенных клеток. Выделение продукта облегчается, если он высвобождается (экскретируется) продуцентом в культуральную жидкость. Поэтому понятно стремление биотехнологов получить методами генетической инженерии промышленные штаммы микроорганизмов, экскретирующих возможно большее количество ценных продуктов. Технология выделения и очистки в значительной степени зависит от природы целевого продукта. Так, ферменты (протеазы, целлюлазы и т. д.) выделяют путем осаждения органическими растворителями или сульфатом аммония. Имеется возможность обойтись без их полной очистки, поскольку в народном хозяйстве широко используют смешанные ферментные препараты, содержащие несколько белков, близких по физико-химическим свойствам. В то же время такие ферменты, как эндо- и экзонуклеазы, ли- Введение в биотехнологию. Метод. указания по лабораторным работам -34- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.6. Методы выделения и очистки целевого биотехнологического продукта газы, требуют сложной многоэтапной очистки с применением тонких методов препаративного разделения. Некоторые традиционные биотехнологические процессы вообще не включают этап отделения продукта. Первым этапом на пути к очистке целевого продукта является разделение культуральной жидкости и биомассы — сепарация. Существуют различные методы сепарации: 1) флотация, если клетки продуцента в биореакторе из-за низкой смачиваемости накапливаются в поверхностных слоях жидкости; 2) фильтрация на пористой фильтрующей перегородке; 3) центрифугирование. Метод основан на осаждении взвешенных в жидкости частиц с применением центробежной силы. Ценртрифугирование требует более дорогостоящего оборудования, чем фильтрование. Поэтому оно оправдывает себя, если: а) суспензия фильтруется медленно; б) поставлена задача максимального освобождения культуральной жидкости от содержащихся частиц; в) необходимо наладить непрерывный процесс сепарации в условиях, когда фильтры рассчитаны только на периодическое действие. Центрифугирование и фильтрация в некоторых производственных процессах реализуются в комбинации — речь идет о фильтрационных центрифугах. Широко применяют центрифуги, где разделение жидкой и твердой фаз не связано с фильтрацией и основано лишь на центробежной силе. Следующим этапом получения целевого продукта является разрушение клеток. Разрушение клеток (дезинтеграцию) проводят физическим, химическим и химико-ферментативным методами. Наибольшее индустриальное значение имеет физическое разрушение: ультразвуком; с помощью вращающихся лопастей или вибраторов — метод, обычно используемый в пилотных и промышленных установках; встряхиванием со стеклянными бусами; продавливанием через узкое отверстие под высоким давлением; раздавливанием замороженной клеточной массы; растиранием в ступке; осмотическим шоком; замораживанием — оттаиванием; сжатием клеточной суспензии с последующим резким снижением давления (декомпрессия). За дезинтеграцией клеток следует этап отделения фрагментов клеточных стенок. Используют те же методы, что и при сепарации клеток: центрифугирование или фильтрацию. Однако применяют более высокоскоростные центрифуги и фильтры с меньшим диаметром пор (часто мембранные), чем при сепарации клеток. В большинстве биотехнологических процессов клеточные стенки отбрасывают как балласт, но возможно и промышленное получение компонентов клеточных стенок как целевого продукта. Выделение целевого продукта из культуральной жидкости или гомогената разрушенных клеток проводят путем его осаждения, экстракции или адсорбции. Современные методы разделения веществ включают хроматографию, электрофорез, изотахофорез, электрофокусировку, основанные на принципах экстракции и адсорбции. Разделение веществ путем хроматографии связано с Введение в биотехнологию. Метод. указания по лабораторным работам -35- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.6. Методы выделения и очистки целевого биотехнологического продукта их неодинаковым распределением между двумя несмешивающимися фазами. Различают хроматографию на бумаге, пластинках, колонках. При хроматографии на бумаге или на пластинках одной из несмешивающихся фаз служит движущийся растворитель, например бутанол, а другой, неподвижной фазой – волокна бумаги или частицы покрывающего пластинку силикагеля или другого материала. При колоночной хроматографии подвижная фаза – текущий через колонку растворитель, неподвижная – заполняющий колонку адсорбент, чаще всего гранулированный гель. Разделяемая смесь вводится в контакт с подвижной и неподвижной фазами. Колоночная хроматография допускает масштабирование – увеличение размеров и пропускной способности. Она применяется в промышленных условиях и имеет несколько разновидностей. 1. Ионообменная хроматография (рис. 2.9) – гранулы адсорбента, например карбоксиметилцеллюлозы, несут на себе заряженные группы, катионные (NH4+), анионные (SO3-2), способные к захвату ионов противоположного знака. Она применяется для выделения ионизированных соединений из жидкости, а также для очистки нейтральных соединений от примесей ионной природы. Одной из первых примененных в промышленных масштабах ионообменных колонок была колонка с естественным ионообменником цеолитом для смягчения воды, т. е. удаления из нее Са2+ и Mg2+. Ионообменные колонки с амберлитом широко применяют для отделения витамина В2. Разделяемая смесь смесь с вычетом адсорбированных ионов а б Рис. 2.9. Катионнообменная хроматография (схематизировано: изображено поверхностное электростатическое взаимодействие с частицами): а , б – две стадии процесса 2. Метод «молекулярных сит», гель-хроматография, гель-фильтрация. Введение в биотехнологию. Метод. указания по лабораторным работам -36- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.6. Методы выделения и очистки целевого биотехнологического продукта Хроматография, основанная на разделении веществ с различной молекулярной массой и диаметром. Частицы адсорбента захватывают и удерживают, скажем, только низкомолекулярные соединения, пропуская высокомолекулярные (рис. 2.10). а б Рис. 2.10. Хроматография на основе «молекулярных сит (компоненты, размеры которых соответствуют размерам пор или входов в поры адсорбента, задерживаются на колонке): а, б — две стадии процесса 3. Аффинная хроматография – задерживается компонент, образующий прочный комплекс с лигандом, фиксированным на частицах носителя (рис. 2.11). а б Рис. 2.11. Аффинная хроматография (в виде частиц различной формы изображены молекулы с различными химическими структурами, из которых только одна вступает в специфическое взаимодействие с частицами геля. Показано, что в выемки на частицах геля входят лишь молекулы комплементарной формы): а, б – две стадии процесса Применяют агенты, специфически связывающие одно индивидуальное вещество. Например, фермент очищают путем связывания на колонке, несущей субстрат или специфический ингибитор. Введение в биотехнологию. Метод. указания по лабораторным работам -37- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.6. Методы выделения и очистки целевого биотехнологического продукта Аффинная хроматография может обеспечить полную очистку продукта из сложной многокомпонентной смеси – культуральной жидкости, экстракта клеток – в одну стадию, в то время как более традиционные методы осаждения и ионообменной хроматографии требуют многоэтапной очистки, сопряженной с большими затратами труда и времени. Определенные неудобства вызывает относительная дороговизна материалов для аффинной хроматографии, в частности, веществ, используемых в качестве лигандов. Проблемой является также быстрый выход колонки из строя при пропускании через нее смесей, компоненты которых забивают промежутки между гелевыми частицами. Поэтому в производственных условиях колонки используются в периодическом, а не непрерывном режиме. После пропускания через колонку порции культуральной жидкости, из которой выделяют продукт, частицы геля подвергают очистке. Методы очистки основаны на: а) использовании гелевых частиц, превышающих по плотности конгломераты веществ, закупоривающих колонку: различие в плотности позволяет очистить гель путем его избирательного осаждения или проточной промывки, уносящей только загрязняющие частицы; б) придании частицам геля магнитных свойств, что позволяет провести их очистку в градиентном магнитном поле; в) упаковке частиц геля в виде ленты, покрытой тонкоячеистой оболочкой: лента вращается и проходит попеременно через жидкость с неочищенным продуктом и через буферный раствор, в который переходят загрязняющие примеси. Масштабирование процесса аффинной хроматографии ограничивается разрушением структуры геля и уносом его частиц током жидкости. Это, в частности, обусловлено тем, что в широких колонках для крупномасштабной очистки продуктов стенки колонки уже не служат опорой для частиц геля, увлекаемых жидкостью. Увеличение высоты колонки приводит к пропорциональному возрастанию сил, разрушающих нижние слои геля. Помимо этого, для повышения эффективности и степени разделения близких по свойствам соединений целесообразно применять мелкие частицы геля (менее 1 мкм в поперечнике), но именно такие частицы легче всего увлекаются током жидкости. В последние годы изыскивают средства укрепления гелей для крупномасштабной аффинной хроматографии. Частицы агарозы – наиболее перспективного материала для гелей – предполагают укреплять путем сшивок. Наряду с аффинной хроматографией, называемой также аффинной адсорбцией в геле, для крупномасштабного отделения и очистки продуктов биотехнологических процессов предполагают применять аффинную преципитацию и аффинное разделение. При аффинной преципитации лиганд прикрепляют к растворимому носителю. При добавлении смеси, содержащей соответствующий белок, образуется его комплекс с лигандом, который выпадает в осадок сразу после его формирования или после дополнения раствора электролитом. Аффинное разделение основано на применении системы, содержащей два водорастворимых полимера. Один из полимеров, например полиэтиленгликоль, несет специфические лиганды. Другой полимер, например высокомолекулярный декстран, обладает сродством к остальным, Введение в биотехнологию. Метод. указания по лабораторным работам -38- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.6. Методы выделения и очистки целевого биотехнологического продукта примесным компонентам. Так, содержащиеся в разделяемой смеси белки, нуклеиновые кислоты, фрагменты клеточных структур предпочитают более полярный декстран, тогда как целевой продукт, скажем, фермент, накапливается «в сетях» полиэтиленгликоля, несущего молекулы лиганда (субстрата, кофактора, ингибитора). Аффинное разделение представляет собой наиболее высокоэффективный из аффинных методов очистки. В качестве иллюстрации методов колоночной хроматографии будем использовать метод гель-фильтрации образцов полимера, выделенного из биомассы водородных бактерий. Материалы и оборудование: 1. Полигидроксибутират, выделенный из биомасса R. eutrophus B-5786; 2. Система ВЭЖХ «Бриз» с ручным инжектором и рефрактометрическим детектором для анализа молекулярно-массовых распределений полимеров; 3. Набор полистеролов для калибровки. Ход работы: 1. Приготовить 0,1 % раствор полимера в хлороформе; 2. Приготовить 0,1 % раствор полистерола с разной молекулярной массой; 3. Приготовить элюенты; 4. Включить систему ВЭЖК и задать программу хроматографирования; 5. Ввести через специальный порт 10 мкл стандартного раствора и дать команду «старт» для проведения хроматографирования; 6. После завершения хроматографирования стандартов записать пробу полимера; 7. Провести расчеты хроматограмм в соответствии с заданной калибровкой; 8. Оформить результаты в виде графика распределения молекулярных масс полимера. Вопросы: 1. Какие основные методы сбора биомассы вы знаете? Дайте краткую характеристику этим методам. 2. Как можно разрушить биомассу и отделить осколки клеток от супернатанта? 3. Какие основные приемы выделения целевого продукта? 4. Чем отличается аффинная хроматография от гель-фильтрации? Работа 2.7. Методы анализа содержания основных (общий азот, белок) Цель работы: освоение метода определения общего азота в бактериальной биомассе (на примере штамма R. eutrophus B-5786). Введение в биотехнологию. Метод. указания по лабораторным работам -39- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.7. Методы анализа содержания основных (общий азот, белок) Кривая роста – это суммарная запись истории роста культуры. Этого не всегда достаточно для того, чтобы можно было предвидеть и изменить по желанию состояние клеток. Изменения биохимических свойств клеток по ходу роста представляются не менее важным моментом для оценки возможности получения того или иного продукта с помощью микробных клеток. В фазе активного роста бактерии синтезируют преимущественно азотсодержащие вещества – белки и нуклеиновые кислоты. По мере старения культуры синтез этих веществ замедляется и накапливаются запасные вещества. Поэтому уровень общего азота в клетке отражает степень активности культуры, что делает необходимым определение биохимического состава культуры в процессе роста. Содержание общего азота обычно определяется по Кьельдалю. Так как на долю азота в белке приходится 16 %, то данные, полученные по этому методу, легко пересчитать на белок. Количество белка в клетках можно определить непосредственно по методу Лоури, пользуясь реактивом Фолина, который дает цветную реакцию с тирозином и триптофаном. Материалы и оборудование: - предварительно высушенная биомасса R. eutrophus B-5786, отобранная из фазы активного роста и стационарной фазы роста; - весы аналитические; - электрическая плитка или песочная баня; - термостойкие пробирки диаметром 2 см и высотой 20 см с точной меткой 40 мл; - штативы; - фотоэлектроколориметр; - мерные колбы емкостью 1 л, 100 мл и 50 мл; - градуированные пипетки; - H2SO4 концентрированная; - перекись водорода 30 %-ная; - 50 %-ный раствор сегнетовой соли; - реактив Несслера, лакмусовая бумага; - ГСО для определения азота. Ход работы: 1. На аналитических весах отвешивают 40 мг тонкоразмолотой биомассы и переносят в термостойкую пробирку диаметром около 2 см, высотой 20 см и емкостью 40 мл (с точной меткой). 2. В пробирки приливают по 3 мл концентрированной серной кислоты и по 0,5 мл 30 %-ной перекиси водорода и помещают в баню с песком, установленную на электроплитке. Минерализацию проб проводят при температуре около 400 °С. Для ускорения минерализации органических веществ через 1 ч после начала кипения в пробирки осторожно добавляют еще по 0,5 мл перекиси водорода. Нагревание продолжают до полного обесцвечивания содержимого пробирок. Введение в биотехнологию. Метод. указания по лабораторным работам -40- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.7. Методы анализа содержания основных (общий азот, белок) 3. После окончания озоления пробирки выдерживают еще 15–20 мин для окончания разложения перекиси водорода. Затем в охлажденные пробирки очень осторожно приливают воду – 10 мл. 4. Содержание пробирок нейтрализуют 10 %-ным раствором NaOH. Конец нейтрализации определяют по посинению лакмусовой бумажки, небольшую полоску которой помещают в пробирку. 5. Чтобы избежать появления опалесценции раствора, в колбы добавляют по 1 мл 50 %-ного раствора сегнетовой соли и приливают по 2 мл реактива Несслера. Необходимо строго соблюдать порядок добавления реактивов. Содержимое в пробирках тщательно перемешивают. 6. В результате реакции между аммиаком и реактивом Несслера раствор окрашивается при малом содержании азота в желтый цвет, при более высоком – в оранжевый. Растворы должны быть совершенно прозрачными. Интенсивность окраски растворов определяют на фотоэлектроколориметре с синим светофильтром. 7. Вычисление результатов. Содержание азота рассчитывают по калибровочной кривой, для построения которой используют образцовый раствор NH4CI или ГСО. При приготовлении этого раствора 0,382 г химически чистого (х.ч.) перекристаллизованного NH4C1 растворяют в 1 л бидистиллированной воды и получают исходный раствор с содержанием 0,1 мг азота в 1 мл. Из этого раствора путем десятикратного разведения готовят образцовый раствор с содержанием 0,01 мг азота в 1 мл. Шкалу образцовых растворов готовят со следующими концентрациями (мг азота в колбе емкостью 50 мл): 0,01; 0,02; 0,04; 0,06; 0,08; 0,10; 0,15; 0,20; 0,25. На занятиях используем готовую калибровочную кривую. Находим содержание общего азота в 40 мг биомассы и рассчитываем процент содержания азота в сухой биомассе. Для пересчета на белок, полученный результат умножаем на коэффициент 2,5. Результаты анализов оформляем в виде таблицы. Таблица 2.5 Содержание общего азота и белка в биомассе бактерий, % сухого вещества № пробы Оптическая плотность Результат по калибровке Мг на 40 мг Общий азот % сух. в-ва Белок % сух. в-ва 1 2 3 4 Вопросы: 1. Почему необходимо изучать биохимический состав микроорганизмов? 2. Каковы основные методы определения белковых компонентов клетки? 3. В чем заключаются принципы определения общего азота? Введение в биотехнологию. Метод. указания по лабораторным работам -41- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.7. Методы анализа содержания основных (общий азот, белок) 4. Какие отличия наблюдаются при определении общего азота в клетках бактерий, отобранных в разные фазы роста? Работа 2.8. Методы анализа запасных (полисахара, биополимеры) клеточных макромолекул Цель работы: освоение методов определения полисахаров (А) и биополимеров-полигидроксиалканоатов (Б). (А) Определение полисахаров. Реакция основана на взаимодействии сахаров с антроновым реактивом, который образует синевато-зеленое окрашивание со всеми растворимыми углеводами. Окрашиваемость раствора определяется концентрацией сахаров. Это позволяет при определении углеводов использовать калибровочную кривую, составленную по глюкозе для определения всех углеводов. Метод дает возможность определять полисахара типа крахмала в небольших концентрациях и пригоден для анализа бактериальных клеток. Материалы и оборудование: 1. Антроновый реактив (0,2 %-ный раствор антрона в концентрированной серной кислоте (200 мг в 100 см 3 H 2 SO 4 ); 2. 3 %-ный раствор HCl; 3. Насыщенный раствор уксуснокислого свинца; 4. Насыщенный раствор сернокислого натрия; 5. Термостойкие пробирки; 6. Мерные колбы на 100 мл; 7. Пипетки на 1, 5, 10 мл; 8. Водяная баня; 9. Фотоколориметр. Ход работы: 1. Взвесить на аналитических весах 100 мг измельченной высушенной биомассы и поместить в пробирку. 2. Залить биомассу 20 мл 3 % соляной кислотой и гидролизовать на кипящей водяной бане в течение 3 ч. 3. После гидролиза остудить пробирки и добавить 3 мл насыщенного раствора уксусного кислого свинца для осаждения белков и 9 мл насыщенного раствора сернокислого натрия для осаждения свинца. 4. Перенести содержимое пробирки в мерную колбу на 100 мл, сполоснуть пробирки несколькими порциями дистиллированной воды, собрать в мерную колбу и довести объем колбы водой до метки. 5. В отдельную пробирку отфильтровать раствор через фильтр «синяя лента» и отобрать для анализа 1 мл раствора в чистую пробирку. 6. К 1 мл отфильтрованного раствора осторожно по стенке пробирки добавить 5 мл антронового реактива (пробирки с пробой предвари- Введение в биотехнологию. Метод. указания по лабораторным работам -42- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.8. Методы анализа запасных (полисахара, биополимеры) клеточных макромолекул тельно поставить в стакан с холодной водой или на лед) и провести реакцию на кипящей водяной бане в течение 15 мин. 7. После окончания реакции пробирки остудить под струей холодной воды и провести замер оптической плотности на фотоколориметре в сантиметровой кювете при красном светофильтре против холостой пробы. Холостая проба готовится так: к 1 мл дистиллированной воды добавляется 5 мл антронового реактива и кипятится вместе с пробами на водяной бане. 8. Расчет содержания общих углеводов проводится по калибровочному графику. Для построения калибровочной кривой используют глюкозу. Исходный раствор – 100 мг глюкозы на 1 л воды. Из него делается серия разведений от 10 до 100 мкг глюкозы в 1 мл. Вычисления производят по формуле Х = a x v x 100/н, где а – количество сахара, найденное по калибровочной кривой; ν – объем экстракта; н – навеска. Результаты анализа оформить в виде табл. 2.6. Таблица 2.6 Содержание полисахаров в биомассе бактерий, % сухого вещества № пробы Оптическая плотность Результат по калибровке Мг на 100 мг Полисахара % сух. в-ва 1 2 3 4 (Б) Определение полигидроксиалканоатов (биополимер) хромато-массспектрометрией. Полигидроксиалканоаты относятся к резервным (запасным) макромолекулам и образуются прокариотами при несбалансированном росте или в стационарной фазе роста. В отличие от матричного синтеза белков ПГА синтезируются в ходе сложного многоступенчатого биосинтетического процесса, каждую стадию которого катализируют специфические ферменты. Синтез ПГА в общих чертах сходен у различных микроорганизмов (Alcaligenes, Azotobacter, Pseudomonas). Условия, обеспечивающие изменение направления анаболизма клеток с белковой программы на синтез ПГА, определяются окислительно-восстановительным состоянием цитоплазмы, внутриклеточной концентрацией пирувата и свободного КoA. Содержание этого запасного полимера можно определить двумя методами: взвешиванием выделенного из клеток полимеры – весовой метод; и хроматографическим методом после гидролиза биомассы. Введение в биотехнологию. Метод. указания по лабораторным работам -43- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.8. Методы анализа запасных (полисахара, биополимеры) клеточных макромолекул Материалы и оборудование: 1. H2SO4 концентрированная; 2. Абсолютный спирт; 3. Раствор бензойной кислоты в хлороформе (0,5 мг/мл); 4. Чистый полимер; 5. Аналитические весы; 6. Колбы со шливом; 7. Обратный холодильник; 8. Водяная баня с регулирующей системой нагрева; 9. Роторный испаритель; 10. Газовый хроматограф с масс-спектрометром и капиллярной колонкой; 11. Газ-носитель гелий с чистотой 99,999 %. Ход работы: 1. На аналитических весах взвешиваем 4–5 мг высушенной и растертой биомассы бактерий и помещаем в колбочку со шлифом. Параллельно с пробой берем навеску чистого полимера (4–5 мг) и переносим ее в другую колбу. 2. К навескам биомассы и полимера приливаем 1 мл раствора бензойной кислоты в хлороформе, 0,85 мл спирта и 0,15 мл серной кислоты. 3. Прикрепляем колбы к обратному холодильнику, открываем кран с холодной водой, который соединен с холодильником, опускаем колбы в водяную баню, нагретую до 90 0С. Гидролиз полимера проводим в течение 140 минут. 4. После того, как колбы остынут, снимаем их с холодильника, доливаем 0,5 мл дистиллированной воды, закрываем колбы стеклянными крышками и оставляем в холодильнике для расслоения фаз. Нижнюю хлороформную фазу используем для анализа. 5. Метиловые эфиры жирных кислот анализируем на газовом хроматографе с масс-спектрометром (GCD Plus, Hewlett Packard, USA). Отбираем микрошприцем 1 мкл нижней фазы и через специальный порт вводим пробу в колонку газового хроматографа. Условия хроматографирования: газноситель – гелий, скорость – 1 мл/мин; температура ввода пробы – 220 0С ; начальная температура хроматографирования – 80 0С, подъем температуры до 230 0С со скоростью 8 0С в минуту; температура интерфейса – 250 0С; колонка капиллярная НР-FFAP, длина 30 м, диаметр – 0,25 мм. Получаем хроматограмму, которую распечатываем, а результаты используем для подсчета содержания полимера. 6. Рассчитываем содержание полимера в биомассе по соотношению площадей пиков внутреннего стандарта (0,5 мг бензойной кислоты) и мономера – гидроксибутирата, вводя коэффициент пересчета. Коэффициент пересчета (К) получаем из хроматограммы чистого полимера. Обычно он колеблется от 5,85 до 6,3. Пусть А – площадь пика внутреннего стандарта, Б – площадь пика мономера полимера, составляем пропорцию: А – 0,5 мг; Б – В мг, тогда В = К х Б х 0,5/А мг полимера в навеске (Н). Введение в биотехнологию. Метод. указания по лабораторным работам -44- МОДУЛЬ 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ Работа 2.8. Методы анализа запасных (полисахара, биополимеры) клеточных макромолекул Находим содержание полимера в % к сухому веществу из пропорции: В – Х %; Н – 100 %, тогда Х % = В х 100/Н. Результаты оформляем в табл. 2.7. Таблица 2.7 Содержание полимера в биомассе бактерий, % сухого вещества № пробы 1 2 3 Навеска, мг Полимер, % сух. в-ва Вопросы: 1. В каких условиях роста микроорганизмы синтезируют запасные вещества? 2. Какие основные запасные вещества содержат микроорганизмы? 3. В чем заключается принцип антронового метода? 4. К какому классу органических соединений относятся полигидроксиалканоаты? 5. Каковы основные этапы газо-хроматографического определения содержания полимера в бактериях? Перечислите их. Введение в биотехнологию. Метод. указания по лабораторным работам -45- МОДУЛЬ 3. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ Цель – практическое освоение основных методов работы по выделению и очистке ферментных препаратов из бактериальных клеток. Инженерная энзимология — новое научно-техническое направление, основанное на принципах целого ряда областей современного естествознания, в первую очередь химической энзимологии, биохимии, химической технологии, а также инженерно-экономических дисциплин. Основная задача инженерной энзимологии – разработка биотехнологических процессов, в которых используется каталитическое действие ферментов, как правило, выделенных из состава биологических систем или находящихся внутри клеток, искусственно лишенных способности расти. К инженерной энзимологии относятся соответствующие научно-исследовательские и инженерные разработки, если они ставят своей целью: а) получение нового продукта; б) получение известного продукта, но лучшего качества; в) улучшение техникоэкономических показателей процесса по сравнению с аналогичными процессами. Ферменты и ферментативные системы традиционно применяются в самых различных областях практической деятельности: в пищевой, фармацевтической, текстильной, кожевенной и других отраслях промышленности, в медицине, сельском хозяйстве, органическом синтезе, химическом анализе и т. д. Благодаря своей высокой специфичности ферменты давно применяются в области аналитической химии. Применение иммобилизованных ферментов способствует созданию методов «без-реагентного» анализа, позволяющих проводить практически непрерывный анализ водных растворов органических (а в ряде случаев и неорганических) соединений. Ферментные электроды применяются в быстром автоматическом анализе многокомпонентных систем. Наконец, разработаны чувствительные ферментативные методы с использованием термисторов, в том числе и с «ферментными термисторами». Инженерная энзимология относится к разряду новейших и высоких биотехнологических процессов. Для работы с ферментами необходимо наличие специальной дорогостоящей аппаратуры и реагентов, а также квалифицированных специалистов. Особые трудности связаны с необходимостью применения сложных процедур для выделения ферментов из биологического материала (микробных биомасс, природных материалов растительного и животного происхождения), последующей очистки и стабилизации ферментативной активности. Введение в биотехнологию. Метод. указания по лабораторным работам -46- МОДУЛЬ 3. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ Работа 3.1. Выделение ферментов (на примере светящихся белков) Цель работы: знакомство с методами выделения и очистки ферментов из различных источников; выделение рекомбинантных апообелина и зеленого флюоренцентного белка (GFP) из биомассы E.сoli. Процедура получения препаратов различных ферментов включает в себя две основных стадии – выделение и очистку. Под выделением подразумевают получение обогащенного экстракта целевого белка из клеток (бактериальных, растительных или животных). Как правило, эти экстракты содержат достаточно много различных примесей. Для получения препарата фермента высокой чистоты производят дополнительную очистку с использованием различных, в основном хроматографических, методов. На стадии выделения проводят разрушение клеточной стенки, и методы, которые для этого применяют, естественно, зависят от природы клеток, а также локализации целевого фермента в клетке. Так, животные и растительные клетки чаще всего разрушают механически гомогенизаторами с металлическими ножами. Бактериальные клетки разрушают механически (на специальной установке – френчпрессе – клеточная паста продавливается под высоким давлением через микронную щель, образованную стальными лезвиями), с помощью ультразвуковой обработки, процедурой замораживания – оттаивания, ферментативной обработкой (например, лизоцимом). Для разрушения дрожжевых клеток эффективнее всего использовать кратковременную тепловую обработку в щелочных условиях. Экстракцию белков из полученного гомогената проводят водой, но чаще всего – буферными растворами, содержащими необходимые добавки и имеющими значения рН, которые обеспечивают максимальную стабильность целевого белка. Полученный экстракт наряду с интересующим ферментом всегда содержит ряд примесей белковой и небелковой природы. Чтобы избавиться от балластных примесей, используют различные способы фракционирования, выбор которых зависит от свойств целевого белка. Например, если фермент термостабилен, даже слабая термообработка позволит избавиться от всех термолабильных белков в смеси; если фермент устойчив в кислой среде – подкисление раствора поможет избавиться от балластных белков, денатурирующих при этих условиях и т. д. Очень часто для обогащения экстракта целевым ферментом используют такие приемы, как солевое осаждение, осаждение органическими растворителями, избирательную абсорбцию. Следует заметить, что изменения параметров среды производят очень постепенно, не используя сильных кислот и щелочей. Все процедуры проводят на холоде. Результаты очистки рекомендуется суммировать в табл. 3.1. Введение в биотехнологию. Метод. указания по лабораторным работам -47- МОДУЛЬ 3. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ Работа 3.1. Выделение ферментов (на примере светящихся белков) Таблица 3.1 Объем раствора Активность в 1 мл Общая активность Белок, мг Удельная активность Степень очистки Выход, % активности от исх. Процедура выделения целевых ферментов существенно упрощается, когда речь идет о получении рекомбинантных белков. Используемые в настоящее время экспрессирующие системы на базе бактериальных клеток E.coli позволяют получать большие количества целевого белка – иногда его содержание достигает более 50 % от всех клеточных белков. При такой высокой экспрессии рекомбинантных белков, как правило, клетки-хозяева «пакуют» их в виде нерастворимых частиц, так называемых «телец-включений». Выделение белков из телец-включений имеет ряд преимуществ: а) в них рекомбинантный белок находится практически в чистом виде; б) находясь в нерастворенном виде, он практически не подвергается протеолизу; в) после разрушения клеток целевой белок отделяется от остального клеточного содержимого простым центрифугированием. Из телец-включений рекомбинантные белки переводят в раствор с помощью высоких концентраций хаотропных агентов – мочевины или гуанидин-хлорида и при необходимости дополнительно очищают. Однако следует иметь в виду, что при выделении белка из телец-включений часто возникают проблемы его посттрансляционного фолдинга (т. е. формирования правильной, функционально активной третичной структуры). Дело в том, что молекулы белка в тельцахвключениях не обладают определенной третичной структурой и специфической активностью. Особенно остро эта проблема может возникнуть, например, когда целевой белок должен образовывать правильные S-S мосты. При экспрессии рекомбинантного белка в цитоплазму современная биотехнология предлагает системы, позволяющие проводить и выделение, и очистку белка в одну стадию. Для этого конструируют плазмиды, в которых рядом с геном целевого белка находится последовательность, кодирующая дополнительный признак. Получаемые при этом химерные белки за счет этого признака обладают аффинностью к определенным белкам или гаптенам, иммобилизованным на твердом инертном носителе. Грубый необогащенный клеточный экстракт пропускают через такой носитель, и из всей смеси на нем сорбируется только целевой рекомбинантный белок. После промывок его элюируют в специальных условиях в практически индивидуальном состоянии. Ярким примером такой системы является так называемая металлхелатная хроматография. В ее основе лежит способность ионов двухвалентных переходных металлов (Ni2+, Co2+, Zn2+ и др.) образовывать комплексные соединения, в частности с молекулами имидазола. Белки, обогащенные гистидиновыми остатками, обладают повышенным сродством (аффинностью) к сорбентам, на поверхности которых иммобилизованы ионы этих металлов Введение в биотехнологию. Метод. указания по лабораторным работам -48- МОДУЛЬ 3. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ Работа 3.1. Выделение ферментов (на примере светящихся белков) (металл-активированная матрица). Это обогащение можно произвести искусственно, закодировав полигистидиновые фрагменты на С- или N-концах молекулы целевого белка. (Какие кодоны кодируют гистидин?). При контакте с металл-активированной матрицей из всех белков клеточного лизата на ней абсорбируются только рекомбинантный белок с искусственным поли-His фрагментом. Для элюции этого белка используют либо растворы имидазола, либо растворы с пониженным значением рН (4–5). Если необходимо избавиться от поли-His фрагмента, в генетическую конструкцию между геном белка и геном этого фрагмента «вшивают» участки, кодирующие специфические протеазные сайты. После инкубации раствора целевого белка с соответствующей протеазой отщепленный фрагмент отделяют повторным пропусканием полученной смеси через металл-активированную матрицу. Широко известны и используются в нашей лаборатории для выделения рекомбинантных светящихся белков подобные системы фирм Clontech и Qiagen. В рамках данной работы предлагается провести выделение двух рекомбинантных белков – апообелина и зеленого флуоресцентного белка (GFP). Материалы и оборудование: 1. Биомасса двух видов трансформированных клеток E. coli; 2. Буферные растворы для промывки телец-включений: а) 20 мМ раствор Трис-HCl, рН 7,0 – 100 мл; б) 0,9 % раствор NaCl в а) –20 мл; в) 0,1 % раствор Triton X-100 в а) –20 мл; г) 5 мМ раствор CaCl2 в а) –20 мл; д) 6М мочевина, 20 мМ Трис-HCl, рН 7,0, 5 мМ CaCl2 – 20 мл; (Все перечисленные растворы студенты готовят из соответствующих концентрированных растворов.) 3. Ультразвуковой дезинтегратор; 4. Центрифуга и пробирки к ней; 5. Весы для уравновешивания центрифужных стаканов; 6. Набор автоматических пипеток и наконечники к ним. Ход работы: 1. Ресуспендировать клетки в пятикратном объеме 20 мМ раствора Трис-HCl, рН 7,0 (вес/объем) и разрушить с помощью УЗ-дезинтегратора (5х20 сек при охлаждении льдом). 2. Полученную смесь центрифугировать (4-5 тыс. об./мин, 20 мин). Опишите, как выглядят полученные вами супернатанты и осадки. 3. Супернатант отделить, а осадок ресуспендировать в таком же объеме раствора б) и вновь отцентрифугировать. Введение в биотехнологию. Метод. указания по лабораторным работам -49- МОДУЛЬ 3. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ Работа 3.1. Выделение ферментов (на примере светящихся белков) 4. Повторить процедуру 3, используя для промывки осадка последовательно растворы в) и г). 5. Полученный осадок ресуспендировать в том же объеме раствора д) и оставить при перемешивании на ночь при 4 оС. Вопросы: 1. Проанализируйте выделение природного и рекомбинантного обелинов на основании предложенных результатов (таблицы по результатам выделения и данные гель-электрофореза прилагаются отдельно). 2. Какие методы используют для разрушения бактериальных клеток? 3. Что такое “тельца-включения”? Какие преимущества и недостатки они имеют при выделении рекомбинантных белков? 4. Для чего промывают тельца-включения каждым из растворов а)-г)? 5. Как переводят белки из телец-включений в раствор? 6. Сравните составы полученных фракций по данным (прилагаются отдельно) гель электрофореза. Почему апообелин выделяется из осадка телецвключений, а GFP из супернатанта? 7. Как предлагается проводить одностадийное выделение и очистку рекомбинантных белков металл-хелатной хроматографией по данным руководств фирм Clontech и Qiagen? Работа 3.2. Методы детекции ферментативной активности Цель работы: знакомство с методами детекции ферментативной активности; спектрофотометрическое определение активности щелочной фосфатазы; определение биолюминесцентной активности Са2+ – активируемого фотопротеина обелина. Для того чтобы успешно проводить работы с ферментами и, в частности, их выделение и очистку, необходимо уметь эффективно (быстро, просто и наглядно) определять их специфическую активность или скорость ферментативной реакции. Её определяют как количество превращенного субстрата или количество образовавшегося продукта в единицу времени. Скорость реакции следует определять в начальный промежуток времени и следить за поддержанием температуры, значения рН, избытка субстратов и кофакторов в реакционной смеси. Все эти правила и закономерности изучались студентами в курсе биологической химии. Чтобы убедиться в том, что измеренная активность ферментного препарата определяется только его концентрацией, его содержание увеличивают или уменьшают в два раза. Если при этом активность также меняется в два раза, это означает, что в данных условиях активность фермента определяется только его содержанием. Методы детекции ферментативной активности связаны с природой реакции, которую данный фермент катализирует. Когда в процессе ферментативной реакции образуются или поглощаются газообразные продукты, для Введение в биотехнологию. Метод. указания по лабораторным работам -50- МОДУЛЬ 3. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ Работа 3.2. Методы детекции ферментативной активности измерения активности используют манометрические методы с использованием аппарата Варбурга. Примером таких реакций являются реакции окисления (поглощение кислорода), декарбоксилирования (выделение CO2) и т.д. Когда в процессе реакции образуются кислые продукты, ее скорость можно определить титрованием: количество образующейся кислоты определяют по количеству щелочи, пошедшему на ее нейтрализацию. Особое место занимают спектрофотометрические методы детекции ферментативной активности. Они применимы, когда в результате ферментативной реакции происходит образование продукта или расход субстрата, которые поглощают свет определенной длины волны, как в видимом, так и в ультрафиолетовом диапазоне спектра. Эти методы имеют ряд преимуществ – не требуют много времени для проведения анализа, обладают высокой чувствительностью, позволяют использовать для измерений малые количества образца и проводить непрерывное наблюдение за ходом реакции. Они получили широкое применение при изучении окислительных ферментов, в реакции которых задействованы никотинамидные коферменты (НАД или НАДФ). В восстановленном состоянии они имеют полосу поглощения при 340 нм, в окисленном этой полосы нет. Таким образом, по скорости уменьшения (или увеличения) интенсивности этого поглощения определяют скорость ферментативной реакции. Спектрофотометрию можно использовать не только когда непосредственно изучаемая реакция сопровождается изменением оптической плотности. Часто не обладающие оптическим поглощением продукты являются субстратами для сопряженных ферментативных реакций, конечный продукт которых имеет характерное поглощение на определенной длине волны. Таким образом, активность исследуемого фермента определяется опосредованно – по продукту реакции сопряженного фермента. Сопряженные ферменты, естественно, не должны лимитировать скорость реакции исследуемого фермента. Очень просто определять активность ферментов, одним из продуктов реакции которых является квант света. Это так называемые биолюминесцентные и хемилюминесцентные реакции. Для измерения генерируемого светового потока используют фотометры. Есть ферменты, определение активности которых можно проводить разными методами. Например, пероксидаза хрена катализирует реакцию пероксидазного окисления разлиных субстратов. Продукты окисления обладают поглощением в видимой области, причем в зависимости от строения молекулы продукта они поглощают в разных областях спектра (например, окисленный о-фенилендиамин – при 490 нм, 5-аминосалициловая кислота – при 450 нм и т.д.). Известны и используются субстраты пероксидазы, в результате окисления которых образуется квант света. В этом случае имеет место принципиально другой – хемилюминесцентный сигнал – и активность фермента определяют по уровню генерируемого светового потока. В рамках данной работы предлагается провести: А) спектрофотометрическое определение активности щелочной фосфатазы и Б) определение биолюминесцентной активности Са2+ – активируемого фотопротеина обелина. Введение в биотехнологию. Метод. указания по лабораторным работам -51- МОДУЛЬ 3. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ Работа 3.2. Методы детекции ферментативной активности Щелочная фосфатаза – это фермент, катализирующий гидролиз сложноэфирной связи в фосфомоноэфирах. Одним из его субстратов является пнитрофенилфосфат, который гидролизуется по схеме. щел. фосфатаза O2N O O - P O O- + H2O п-нитрофенилфосфат O2N OH + O HO P OO- п-нитрофенол Раствор п-нитрофенилфосфата не имеет окраски, а получаемый при гидролизе п-нитрофенол поглощает свет в видимой области спектра (400–420 нм). Это позволяет определять кинетические параметры реакции спектрофотометрическим методом. Са2+ – активируемый фотопротеин обелин представляет собой устойчивый фермент-субстратный комплекс из апобелка и субстрата – пероксицелентеразина. В присутствии ионов кальция практически мгновенно развивается реакция декарбоксилирования, одним из продуктов которой является квант света. А) Материалы и оборудование: 1. Два раствора щелочной фосфатазы (в 0,05 М глициновом буфере рН 10, содержащем 5х10-4 М MgSO4) с разной концентрацией. (Хранить в ванночке со льдом); 2. 0,005 М раствор п-нитрофенилфосфата в 0,05 М глициновом буфере с рН 10, содержащем 5х10-4 М MgSO4 (раствор «А»); 3. 0,02 М раствор NaOH; 4. Термостат; 5. Секундомер; 6. Спектрофотометр и кварцевые кюветы; 7. Стеклянные пробирки; 8. Набор автоматических пипеток и наконечники к ним; 9. Ванночка со льдом для хранения фермента. Ход работы: 1. В пробирку внести 4,5 мл раствора «А» и поместить ее в термостат о (30 С) на 5–10 мин (реакционная смесь). Приготовить 4 пробирки с 9 мл 0,02 М раствора NaOH. Пометить пробирки надписями – 2, 5, 10, 15 мин. 2. В реакционную смесь внести 0,5 мл раствора фермента, одновременно включив секундомер. Смесь инкубировать в термостате о (30 С). Введение в биотехнологию. Метод. указания по лабораторным работам -52- МОДУЛЬ 3. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ Работа 3.2. Методы детекции ферментативной активности 3. Через 2, 5, 10, 15 мин из реакционной смеси отбирать аликвоты по 1 мл и вносить их в пробирки со щелочью с соответствующей маркировкой. Тщательно перемешать эти растворы. Замерить оптическую плотность (D400) полученных щелочных растворов с помощью спектрофотометра в кюветах с толщиной слоя 1 см. Измерения проводить против контрольного раствора (содержит все компоненты реакционной смеси без фермента, т.е. 0,5 мл раствора «А» и 4,5 мл 0,02 М NaOH). 4. Построить график изменения оптической плотности от времени и определить скорость ее изменения в начальный момент времени. Скорость реакции V подсчитать по формуле, учитывая коэффициент молярной экстинкции п-нитрофенола при 400 нм, равный 15,2⋅103: V = 10 ⋅ D1400 / t1 , 15,2⋅103 где 10 – коэффициент разбавления реакционной смеси раствором щелочи при остановке реакции. Б) Материалы и оборудование: 1. Два раствора фотопротеина обелина разной концентрации; 2. Раствор для измерения активности обелина (50 мМ Трис HCl pH 8,8, 10 мМ ЭДТА); 3. Раствор CaCl2 (100 мМ, в 50 мМ Трис HCl pH 8,8); 4. Биолюминометр и кюветы для измерений к нему; 5. Самописец для регистрации сигнала; 6. Пластиковые пробирки Эппендорф (1,5 мл); 7. Набор автоматических пипеток и наконечники к ним. Ход работы: 1. Поместить в кювету для измерений 500 мкл раствора для измерений. 2. Внести 5 мкл раствора обелина и поместить кювету в люминометр, закрыть кюветный блок. 3. Внести в кювету 250 мкл раствора CaCl2 коротким впрыском. 4. Определить величину сигнала, учитывая настройки люминометра и самописца. 5. Определить концентрацию фотопротеина в предложенных растворах (в мг/мл), используя следующие данные: 1мВ = 107 кванта/сек; удельная активность 1 мг обелина = 6,6 х 1015 кванта/сек. Примечание. Если при измерении активности наблюдается зашкаливание прибора даже при самой грубой чувствительности, рекомендуется развести белок раствором для измерений и затем учесть это разведение при проведении расчетов. Введение в биотехнологию. Метод. указания по лабораторным работам -53- МОДУЛЬ 3. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ Работа 3.2. Методы детекции ферментативной активности Вопросы: 1. Какие методы детекции ферментативной активности вы знаете? От чего зависит их выбор? 2. Что необходимо учитывать при измерении активности фермента в сыром экстракте спектрофотометрическими методами? 3. Если активность фермента определяется спектрофотометрически и имеется возможность использовать несколько различных субстратов – какими критериями руководствуются при выборе того или иного субстрата? 4. Какие преимущества имеют биолюминесцентные методы измерения активности? 5. Каким образом надо проводить измерения активности в разных образцах, чтобы ее значения отражали, прежде всего, содержание фермента? 6. Что может означать резкое (непропорциональное) увеличение активности фермента после проведения очередной стадии фракционирования? Введение в биотехнологию. Метод. указания по лабораторным работам -54- МОДУЛЬ 4. ТЕХНОЛОГИЧЕСКАЯ БИОЭНЕРГЕТИКА И БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ ПЕРЕРАБОТКИ МИНЕРАЛЬНОГО СЫРЬЯ Лабораторные работы не предусмотрены. Введение в биотехнологию. Метод. указания по лабораторным работам -55- МОДУЛЬ 5. БИОТЕХНОЛОГИЯ И ПРОБЛЕМЫ ЗАЩИТЫ ОКРУЖАЮЩЕЙ СРЕДЫ Цель – дать представление о возможностях и границах биотехнологии для защиты окружающей среды. Задачи: 1. Ознакомление с возможностями биотехнологии для решения задач детоксикации ксенобиотиков; 2. Дать основные понятия и принципы конструирования экологически безопасных для биосферы биопрепаратов. Работа 5.1. Иммобилизация микробных клеток Цель работы: обучение принципам иммобилизации клеток микроорганизмов методом механического захвата (включения в гели разных типов). Иммобилизация – это процесс прикрепления биологических агентов (ферментов, клеток) к поверхности природных или синтетических материалов, включение их в полимерные материалы, полые волокна и мембранные капсулы, поперечная химическая сшивка. Принципы этих технологий в настоящее время получили широкое развитие в связи с новым направлением биотехнологии «Инженерная энзимология». При иммобилизации ферментов происходит стабилизация каталитической активности, иммобилизованный фермент, имеющий ограниченную возможность для конформационных перестроек, быстрее растворимого находит кратчайший путь к функционально активной конформации. Это позволяет организовывать на базе иммобилизованных ферментов эффективные биотехнологические процессы многократного периодического, а также непрерывного действия с использованием принципа взаимодействия подвижной и неподвижной фаз. Принципы иммобилизации ферментов все более широко используются в настоящее время для иммобилизации клеток, предназначенных для ряда биотехнологических процессов, – биоорганического синтеза, детекции ряда соединений, деградации и связывания токсикантов. Известны различные методы иммобилизации: адсорбционные методы и методы химического связывания на поверхности, методы механического включения или захвата, методы химического присоединения (рис. 5.1). Введение в биотехнологию. Метод. указания по лабораторным работам -56- МОДУЛЬ 5. БИОТЕХНОЛОГИЯ И ПРОБЛЕМЫ ЗАЩИТЫ ОКРУЖАЮЩЕЙ СРЕДЫ Работа 5.1. Иммобилизация микробных клеток A Б Д B Г Рис. 5.1. Основные методы иммобилизации: А – абсорбция на крупнопористом носителе; Б – ковалентное связывание; В – адсорбция; Г – поперечная сшивка; Д – включение в гель Методы иммобилизации путем адсорбции основаны на фиксировании фермента на поверхности различных материалов – неорганических (силикагель, пористое стекло, керамика, песок, обожженная глина, гидроокиси титана, циркония, железа) и органических (хитин, целлюлоза, полиэтилен, ионообменные смолы, вспененная резина, полиуретан с ячеистой структурой). Адсорбция – это самый простой метод иммобилизации ферментов на поверхности нерастворимых носителей. Процедура иммобилизации состоит в смешивании в определенных условиях фермента с носителем и инкубации смеси. Затем при помощи фильтрования и центрифугирования проводят отделение нерастворимого компонента смеси от растворимого. Адсорбция – мягкий метод иммобилизации; недостаток данного метода – непрочность связей. Поэтому при незначительном изменении условий среды (рН, температуры, ионной силы, концентрации продукта) возможна десорбция клеток с поверхности носителя. Наиболее распространенным методом иммобилизации клеток является включение в полимерную структуру (метод механического захвата). Для этого применяют различные материалы: альгинат, желатину, каррагинан, коллаген, хитин, целлюлозу, полиакриламид. Взвесь клеток смешивают с раствором мономеров носителя. Далее создают условия для процесса полимеризации, в ходе которого происходит механическое включение клеток в структуру носителя. Важным моментом является равномерность распределения клеток в объеме носителя и однородность получаемых агрегатов. Техника включения зависит от природы и свойств используемого материала, образуемые при этом биосистемы имеют вид гранул, волокон, полимерных сеток, пленок и т.п. На практике для иммобилизации клеток широко применяют полиакриламидный гель (ПААГ), клетки вносят в раствор мономера (N, N1метилендиакриламида). Далее формируется гель в виде блока. Монолитный гель измельчают, придавая частицам форму кубиков желаемого размера. При использовании желатины или агар-агара вначале подогревают их растворы, затем охлаждают и вносят фермент. В процессе последующего охлаждения происходит формирование геля. Полимеризация альгината происходит в присутствии некоторых катионов. Поэтому на первом этапе смешивают растворы Введение в биотехнологию. Метод. указания по лабораторным работам -57- МОДУЛЬ 5. БИОТЕХНОЛОГИЯ И ПРОБЛЕМЫ ЗАЩИТЫ ОКРУЖАЮЩЕЙ СРЕДЫ Работа 5.1. Иммобилизация микробных клеток фермента и мономеров этих полисахаридов, далее смесь с помощью дозирующего устройства вносят в раствор, содержащий ионы Ca2+ или Ba2+ (для альгината) или Al3+, Fe3+, K+ или Mo2+ (для каррагинана), при этом образуются сферические полимерные частицы в виде гранул. Гели в зависимости от природы используемого полимерного материала отличаются по ряду показателей. Например, гели ПААГ недостаточно прочные, но этого можно избежать при использовании ПААГ, содержащего жесткую арматуру из керамики. При увеличении степени сшивки с целью придания большей прочности гелю возникают проблемы диффузионных затруднений. Альгинатные гели отличаются высокой прочностью и хорошими гидродинамическими свойствами, что не создает препятствий для притока к активным центрам молекул ферментов субстрата и оттока образуемого продукта. При работе с альгинатом кальция важно отсутствие в иммобилизационной системе хелатирующих агентов (фосфатов, цитратов), которые, связывая кальций, разрушают структуру геля. Клетки, иммобилизованные на поверхности или в порах носителя или включенные в полимерный матриксы, используются в ряде процессов, прежде всего для очистки сточных вод, газовоздушных выбросов и т. п. Материалы и оборудование: 1. Биомасса СО-окисляющих микроорганизмов Seliberia carboxydohydrogena; 2. Лабораторная центрифуга, бокс-ламинар (или микробиологический бокс); 3. Альгинат, раствор MgSO4, акриламид в наборе с компонентами для полимеризации и образования полиоакриламида (ПААГ), физиологический раствор, стерильная среда Шлегеля; 4. Перистальтический насос-дозатор, магнитная мешалка ММ-3; 5. Колбы объемом 1 л, стаканы, шпатели, чашки Петри, скальпель; 6. Термостатируемая качалка (или лабораторная мешалка); 7. Газгольдер, газовая смесь «воздух:монооксид углерода= 80:20 %об; 8. Газоанализатор для детекции концентрации газов (CO, N2, O2). Ход работы: 1. Провести включение клеток с использованием двух матриксов: альгината и ПААГ: бактериальную пасту ресуспендировать в 0,2 калий-фосфатном буфере при рН 7,0. 2. Приготовить 7 % раствор ПААГ. 3. В раствор ПААГ внести клетки в концентрации 0,1; 0,2; 0,4 и 0,6 г/мл (по сырому веществу) и хорошо перемешать клетки и охладить до 1 0С. 4. Охлажденную смесь клеток и раствора носителя разлить в чашки Петри слоем 2 мм и выдерживать в течение 30 мин. 5. Сформированный гель измельчить, используя скальпель, получая частицы в виде кубиков размером 2 x 2 x 2 мм. Введение в биотехнологию. Метод. указания по лабораторным работам -58- МОДУЛЬ 5. БИОТЕХНОЛОГИЯ И ПРОБЛЕМЫ ЗАЩИТЫ ОКРУЖАЮЩЕЙ СРЕДЫ Работа 5.1. Иммобилизация микробных клеток 6. Полученный препарат иммобилизованных клеток хранить в фосфатном буфере в бытовом холодильнике. 7. Включение клеток в альгинат: смешать раствор мономера альгината с клетками (0,5 г сырых клеток/мл). 8. Для формирования геля приготовить 0,1 М трис-HCl буфер при рН 7,0 с добавлением 0,01 М раствора CaCl 2. 9. Смесь, содержащую раствор мономера альгината и бактериальные клетки, при постоянном перемешивании на магнитной мешалке с помощью перистальтического насоса дозировать в приемную ванную (стеклянный стаканчик с раствором CaCl 2).По мере прохождения капель через толщу раствора под воздействием ионов магния происходит полимеризация альгната и формируются гранулы диаметром 2,0–2,5 мм. 10. Полученный препарат иммобилизованных клеток хранить в фосфатном буфере в бытовом холодильнике. Вопросы: 1. В чем специфика конструкции и методов применения биопрепаратов и биотехнологий для детоксикации ксенобиотиков? 2. Каковы особенности техники иммобилизации микробных клеток, предназначенных для связывания токсикантов? 3. В чем заключаются «узкие» места применения биопроцессов и биообъектов для защиты окружающей среды от токсинных стоков и газовоздушных выбросов? Работа 5.2. Принцип работы биофильтра с омываемым слоем. Связывание монооксида углерода в реакторе иммобилизированными со-окисляющими бактериями Цель: обучение принципам использования иммобилизованных микробных клеток в биосистеме (биофильтр с омываемым слоем) для связывания токсикантов. Проблема борьбы с загрязнением воздушного бассейна в условиях возрастающей технологической деятельности приобретает все большую остроту. В воздухе больших промышленных городов содержится огромное количество вредных веществ. При этом концентрация многих токсикантов превышает допустимые уровни. Основной вклад в загрязнение атмосферы вносят предприятия нефтеперерабатывающей, химической, пищевой и перерабатывающей промышленности, а также большие сельскохозяйственные комплексы, отстойники сточных вод, установки по обезвреживанию отходов. Среди этих веществ – органические (ароматические и непредельные углеводороды, азот-, кислород-, серо- и галогенсодержащие соединения) и неорганические вещества (сернистый газ, сероуглерод, окислы углерода, аммиак, хлорводород, галогены). В воздушных бассейнах больших промышленных Введение в биотехнологию. Метод. указания по лабораторным работам -59- МОДУЛЬ 5. БИОТЕХНОЛОГИЯ И ПРОБЛЕМЫ ЗАЩИТЫ ОКРУЖАЮЩЕЙ СРЕДЫ Работа 5.2. Принцип работы биофильтра с омываемым слоем. городов присутствуют десятки различных соединений, в том числе дурнопахнущие, способные даже в незначительных концентрациях представлять угрозу для здоровья, а также вызывать у людей чувство дискомфорта. Для очистки воздуха применяют различные методы – физические, химические и биологические, однако уровень и масштабы их использования в настоящее время чрезвычайно далеки от требуемых. Среди применяемых физических методов – абсорбция примесей на активированном угле и других поглотителях, абсорбция жидкостями. Наиболее распространенными химическими методами очистки воздуха являются озонирование, прокаливание, каталитическое дожигание, хлорирование. Биологические методы очистки газовоздушных выбросов начали применять сравнительно недавно и пока в ограниченных масштабах. Биологические методы очистки воздуха базируются на способности микроорганизмов разрушать в аэробных условиях широкий спектр веществ и соединений до конечных продуктов, СО2 и Н2О. Для биологической очистки воздуха применяют три типа установок: биофильтры, биоскрубберы и биореакторы с омываемым слоем. Рабочим телом биореактора с омываемым слоем являются иммобилизованные микроорганизмы. Биослой реактора представляет собой гранулы с иммобилизованными микробными клетками. Этот слой омывается водой, содержащей необходимые для развития клеток минеральные вещества. Загрязненный воздух проходит через него, при этом вещества, подлежащие деструкции, диффундируют в водную пленку, покрывающую частицы биокатализатора, и далее окисляются микроорганизмами. Скорость деструкции может лимитироваться скоростью диффузии веществ из газовой фазы в жидкую, а также скоростью протекания реакций в микробных клетках. Скорость диффузии, в свою очередь, зависит от природы токсических веществ и их концентраций. Стационарный режим биореактора с омываемым слоем после его запуска наступает через 5–10 дней. При использовании заранее адаптированных к очищаемым веществам микроорганизмов этот срок может быть сокращен до нескольких часов. Периодически, обычно раз в несколько месяцев, биослой очищают от избытка биомассы и наполняют свежими гранулами. Эти установки наиболее перспективны для очистки воздуха. Они характеризуются более высокой удельной производительностью (несколько тысяч кубометров очищаемого воздуха в час). Такие малогабаритные установки очень эффективны для очистки воздуха предприятий интенсивного животноводства. Степень очистки воздуха в реакторе с иммобилизованными на активированном угле микроорганизмами от ацетона, бутанола, пропионового альдегида, этилацетата достигает 90 % при удельной производительности установки 10 000 ч–1. Способность микроорганизмов усваивать для роста субстраты токсической природы важна для понимания механизмов устойчивости биологических объектов к воздействию токсикантов, а также представляет большой интерес в экологическом плане. Биокаталитический потенциал Введение в биотехнологию. Метод. указания по лабораторным работам -60- МОДУЛЬ 5. БИОТЕХНОЛОГИЯ И ПРОБЛЕМЫ ЗАЩИТЫ ОКРУЖАЮЩЕЙ СРЕДЫ Работа 5.2. Принцип работы биофильтра с омываемым слоем. микроорганизмов, утилизирующих разнообразные токсические соединения — загрязнители атмосферы с образованием безвредных продуктов, в последние годы стали использовать и в биологических системах очистки газовоздушных выбросов металлургических, химических и других производств, а также крупных животноводческих комплексов. Окись углерода является одним из наиболее токсичных загрязнителей атмосферы. Карбоксидобактерии, обладающие специфической ферментной системой окисления окиси углерода, СО-оксидазой (СОХ), широко распространены в природе и являются мощным агентом удаления СО из атмосферы. Это позволяет рассматривать данные микроорганизмы в качестве потенциального реагента для применения в биосистемах связывания и детоксикации окиси углерода. Материалы и оборудование: 1. Препараты с иммобилизованными клетками СО-окисляющих бактерий в виде полимерных гранул; 2. Колбы объемом 1 л, стеклянный цилиндр, лабораторные штативы; 6. Лабораторная мешалка ММ-3, лабораторный мини-компрессор; 7. Газгольдер, газовая смесь «воздух:монооксид углерода= 80:20 %об.; 8. Газоанализатор для детекции концентрации газов (CO, N2, O2). Ход работы: 1. Препарат иммобилизованных в альгинате кальция клеток карбоксидобактерий использовать в качестве наполнителя в лабораторных макетах биофильтров для исследования возможности утилизации окиси углерода из воздуха. 2. Первый тип биореактора (рис. 5.2, а): навеску альгинатных гранул диаметром 2,5 мм внести в колбу 1 л объемом 100–150 мл 0,1 М трис-HCl буфер при рН 7,0; в буфер для стабилизации гранул добавить 10 мМ раствор хлорида кальция. 3. Собрать второй тип биореактора (рис. 5.2, б): взять стеклянный цилиндр диаметром 64 мм, высотой 190 мм, в который помещали 150 см 3 гранул и 250 мл буфера. 4. Собрать макет биофильтра, представляющий собой замкнутую по газу систему, состоящую из реактора с омываемым слоем (колба, приготовленная по п. 2, или цилиндр п. 3, содержащие иммобилизованные клетки в жидкой фазе), газометра, заполненного смесью воздуха с окисью углерода, а также компрессора, с помощью которого газовая смесь непрерывно прокачивается через биореактор. Введение в биотехнологию. Метод. указания по лабораторным работам -61- МОДУЛЬ 5. БИОТЕХНОЛОГИЯ И ПРОБЛЕМЫ ЗАЩИТЫ ОКРУЖАЮЩЕЙ СРЕДЫ Работа 5.2. Принцип работы биофильтра с омываемым слоем. а б Рис. 5.2. Лабораторные макеты биофильтра с омываемым слоем 5. С помощью газоанализатора проанализировать состав газовой смеси в газгольдере. 6. Из колбы откачать воздух, соединить с газгольдером. 5. С помощью компрессора непрерывно в течение нескольких часов прокачивать газовую смесь через омываемый слой биофильтров. 7. Периодически производить отбор проб газовой смеси и замерять состав. 8. Внести данные в табл. 5.1. 9. Построить график связывания СО в биофильтре, рассчитать скорость связывания СО. Таблица 5.1 Изменение состава газовой смеси, циркулирующей через биофильтр Время, ч N2 Состав газовой смеси, % об O2 CO CO2 Динамика связывания СО в биофильтре СО, мг Время, ч Вопросы: 1. Каков принцип действия биореактора с омываемым слоем? 2. Каким фактором лимитируется длительность функционирования биореактора с омываемым слоем? 3. Какие примеры использования микроорганизмов для связывания токсикантов, загрязняющих атмосферу городов, вы можете привести? Введение в биотехнологию. Метод. указания по лабораторным работам -62- МОДУЛЬ 5. БИОТЕХНОЛОГИЯ И ПРОБЛЕМЫ ЗАЩИТЫ ОКРУЖАЮЩЕЙ СРЕДЫ Работа 5.2. Принцип работы биофильтра с омываемым слоем. 4. Дайте сравнительные характеристики эффективности функционирования биореактора с омываемым слоем, реактора с биоскруббером и биофильтра. Введение в биотехнологию. Метод. указания по лабораторным работам -63- МОДУЛЬ 6. КЛЕТОЧНАЯ И ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ Цель – ознакомление с методами и возможностями новейших направлений биотехнологии. Задачи: 1. Ознакомление с методами и приемами генетической инженерии. 2. Овладение методами проведения трансформации биологического объекта. 3. Техника регистрации проведения трансформации, детекция встроенных генов и их экспрессии. Быстрое внедрение новейших фундаментальных достижений в практику и существенное влияние последних на уровень теоретических исследований, свойственные биотехнологии, наиболее наглядно проявляются на примере развития клеточной и генетической инженерии. Традиционно для получения более активных биологических агентов применяли селекцию и мутагенез. Традиционные методы отбора в свое время сыграли важную роль в развитии различных технологий с использованием микроорганизмов. Были отобраны штаммы пивных, винных, пекарских, уксуснокислых и других микроорганизмов. Ограничения метода селекции связаны с низкой частотой спонтанных мутаций, приводящих к изменению в геноме. Генетическое конструирование in vivo (клеточная инженерия) включает получение и выделение мутантов и использование различных способов обмена наследственной информацией живых клеток. Основой клеточной инженерии является слияние неполовых клеток (гибридизация соматических клеток) с образованием единого целого. Современную биотехнологию характеризуют как биотехнологию на основе генетической инженерии. Различают следующие уровни генетической инженерии: 1) генную – прямое манипулирование рекомбинантными ДНК, включающими отдельные гены; 2) хромосомную – манипуляции с большими группами генов или целыми хромосомами и 3) геномную – перенос всего или большей части генетического материала от одной клетки к другой. Генетическая инженерия включает технологию рекомбинантных ДНК. Работы в области генетической инженерии включают четыре основных этапа: 1) получение нужного гена; 2) его встраивание в генетический элемент (вектор), способный к репликации; 3) введение гена, входящего в состав вектора, в организм-реципиент; 4) идентификация (скрининг и селекция) клеток, которые приобрели желаемый ген (гены). С помощью методов генетической инженерии в настоящее время успешно конструируют по определенному плану новые формы микроорганизмов, способных синтезировать самые различные продукты, в том числе продукты животного и растительного происхождения. С помощью генетической инженерии успешно решена проблема получения эукариотных белков на Введение в биотехнологию. Метод. указания по лабораторным работам -64- МОДУЛЬ 6. КЛЕТОЧНАЯ И ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ базе рекомбинантных бактериальных штаммов: инсулина, интерферонов, гормона роста и др. Методы генетической инженерии 5’ Плазмида G С A T T A A A T G T Клонирование С Эндонуклеаза Плазмиды Хромосома гена CT T A A G A A Эндонуклеаза T T C G G A A T T C C T T A A G 3’ Техника генетического конструирования in vitro включает несколько последовательных процедур (рис. 6.1): 1) получение нужного гена; 2) встраивание его в генетический элемент, способный к репликации (вектор); 3) введение гена, входящего в состав вектора, в организм-реципиент; 4) идентификацию (скрининг) и отбор клеток, которые приобрели желаемый ген или гены. С T T A A С A A T T Расщепленная плазмида + AA T T T T AA Чужеродный ген (ДНК) AA TT T T AA Введение рекомбинантной плазмиды в кишечную палочку AA TT T T AA 3’ 5’ Лигаза ДНК ДНК T AT A A A T T T AT A A A T T Рекомбинантная плазмида Рис. 6.1. Введение гена в плазмиду E. coli и клонирование рекомбинантной ДНК в клетках. Плазмида E.coli расщепляется рестриктазой в обеих частях ДНК с образованием на концах неспаренных нуклеотидов (ТТАА или ААТТ). Ген выщеплен с помощью этой же рестриктазы с образованием на концах, комплиментарных плазмиде, последовательностей (ААТТ и ТТАА). Обе ДНК (гена и плазмиды) сшивают с помощью лигазы. Гибридную плазмиду вводят в E. coli, которая при размножении образует клон, все клетки которого содержат рекомбинантную плазмиду и чужеродный ген. Ген клонирован в бактериальной клетке и индуцирует в ней синтез белка Получение генов возможно несколькими путями: выделением из ДНК, химико-ферментным синтезом и ферментным синтезом. Выделение генов из ДНК проводят с помощью рестриктаз, катализирующих расщепление ДНК на участках, имеющих определенные нуклеотидные последовательности (4–7 нуклеотидных пар). Расщепление можно проводить по середине узнаваемого участка нуклеотидных пар; при этом обе нити ДНК «разрезаются» на одном уровне. Образующиеся фрагменты ДНК имеют так называемые «тупые» концы. Возможно расщепление ДНК со сдвигом, при этом одна из нитей выступает на несколько нуклеотидов. Образуемые при этом «липкие» концы в силу своей комплементарности вступают во взаимодействие. Введение в биотехнологию. Метод. указания по лабораторным работам -65- МОДУЛЬ 6. КЛЕТОЧНАЯ И ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ Нуклеотидную последовательность с липкими концами можно присоединить к вектору (предварительно обработанному той же рестриктазой), превратить в кольцевую в результате сшивания лигазами взаимно комплиментарных концов. Метод имеет существенные недостатки, так как достаточно трудно подобрать действие ферментов для строгого вычленения нужного гена. Вместе с геном захватываются «лишние» нуклеотиды или, наоборот, ферменты отрезают часть гена, превращая его в функционально неполноценный. Химико-ферментный синтез применяют в том случае, если известна первичная структура белка или пептида, синтез которого кодирует ген. Необходимо полное знание нуклеотидной последовательности гена. Этот метод позволяет точно воссоздать нужную последовательность нуклеотидов, а также вводить в гены участки узнавания рестриктаз, регуляторных последовательностей и пр. Метод состоит из химического синтеза одноцепочечных фрагментов ДНК (олигонуклеотидов) за счет поэтапного образования эфирных связей между нуклеотидами, обычно 8–16-звенных. Ферментный синтез гена на основе выделенной матричной РНК (мРНК) является в настоящее время наиболее распространенным методом. Сначала из клеток выделяют матричные РНК, среди которых присутствует мРНК, кодируемая геном, который требуется выделить. На выделенной из клетки мРНК, как на матрице, с помощью обратной транскриптазы (ревертазы) синтезируется нить ДНК, комплиментарная мРНК (кДНК). Полученная (кДНК) служит матрицей для синтеза второй нити ДНК с использованием ДНК-полимеразы или ревертазы. Затравкой при этом служит олигонуклеотид, комплиментарный 3’-концу мРНК; новая цепь ДНК образуется из дезоксинуклеозидтрифосфатов в присутствии ионов магния. Метод с большим успехом применен для получения в 1979 г. гена гормона роста человека (соматотропина). Полученный тем или иным способом ген содержит информацию о структуре белка, но сам не может ее реализовать. Поэтому нужны дополнительные механизмы для управления действием гена. Перенос генетической информации в клетку реципиента осуществляется в составе вектора. Вектор – это, как правило, кольцевая молекула ДНК, способная к самостоятельной репликации. Ген вместе с вектором образует рекомбинантную ДНК. При обычном введении в бактериальную клетку ДНК подвергается ферментативной атаке, в результате которой разрушается. Чтобы этого не происходило, используют векторные молекулы ДНК, способные при введении в клетку существовать автономно, а при делениях клетки – реплицироваться. Вектор также несет в своем составе генетический признак, необходимый для последующего распознавания и отбора трансгенных организмов. Обычно в качестве маркерных генов используют гены устойчивости к антибиотикам. Конструирование рекомбинантных ДНК осуществляется in vitro с изолированными ДНК при помощи эндонуклеаз рестрикции, которые расщепляют вектор в одном участке, превращая его из кольцевой формы в линей Введение в биотехнологию. Метод. указания по лабораторным работам -66- МОДУЛЬ 6. КЛЕТОЧНАЯ И ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ ную с образованием липких концов, комплиментарных концам вводимой ДНК. Комплиментарные концы вектора и вводимого гена сшиваются лигазой. Полученную рекомбинантную ДНК с помощью той же ДНК-лигазы замыкают с образованием кольцевой молекулы. В качестве векторов используют плазмиды и вирусы. Вирусы быстро транспортируются из клетки в клетку, за короткое время способны быстро заразить весь организм. Важной проблемой при их использовании является аттеньюация – ослабление патогенности для хозяина; таким образом, не очевидно, что зараженные вирусом клетки выживут и смогут передавать потомству измененную генетическую программу. Наиболее распространенными векторами являются многокопийные плазмиды с молекулярной массой 3–10 кб. Первые плазмиды были выделены из бактерий, впоследствии их стали конструировать методами генной инженерии. Перенос рекомбинантных ДНК осуществляется путем трансформации или конъюгации. Трансформация – это процесс изменения генетических свойств клетки в результате проникновения в нее чужеродной ДНК. К трансформации способны лишь некоторые, так называемые «компетентные», клетки (способные включать чужеродную ДНК и синтезирующие особый трансформирующий белок). Компетентность клетки определяется также факторами внешней среды. Этому может способствовать обработка клеток полиэтиленгликолем или хлоридом кальция. После проникновения в клетку одна из нитей рекомбинантной ДНК деградирует, а другая за счет рекомбинации с гомологичным участком реципиентной ДНК может включиться в хромосому или внехромосомную единицу. Трансформация является наиболее универсальным способом передачи генетической информации и имеет наибольшее значение для генетических технологий. После переноса сконструированных ДНК, как правило, лишь небольшая часть реципиентных клеток приобретает необходимый ген. Поэтому очень важным этапом является идентификация клеток, несущих ген-мишень. На первой стадии идентифицируют и отбирают клетки, несущие вектор, на основе которого осуществлен перенос ДНК. Отбор проводят по генетическим маркерам, которыми помечен вектор. Главным образом маркерами являются гены устойчивости к антибиотикам. Поэтому отбор проводят высевом клеток на среды, содержащие конкретный антибиотик. После высева на этих средах вырастают только клетки, в составе которых находится вектор с генами антибиотиковой устойчивости. На второй стадии отбирают клетки, несущие вектор и ген-мишень. Для этого используют две группы методов: 1) основанные на непосредственном анализе ДНК клеток-реципиентов и 2) основанные на идентификации признака, кодируемого геном-мишенью. При использовании первой группы методов из клеток, предположительно содержащих нужный ген, выделяют векторную ДНК, и в ней проводится поиск участков, несущих данный ген. Далее проводят секвенирование части нуклеотидной последовательности гена. Возможен другой метод – гибридизация выделенной из клеток ДНК с зондом (искомый ген или соответствующая ему мРНК); выделенную ДНК переводят в одноцепочечное состояние и вводят ее Введение в биотехнологию. Метод. указания по лабораторным работам -67- МОДУЛЬ 6. КЛЕТОЧНАЯ И ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ во взаимодействие с зондом. Далее определяют наличие двуцепочечных гибридных молекул ДНК. Во втором варианте возможен непосредственный отбор клеток, синтезирующих белок – продукт транскрипции и трансляции гена-мишени. Применяются также селективные среды, поддерживающие рост только клеток, приобретших ген-мишень. Работа 6.1. Трансформация клеток E. coli xli-Blue плазмидой pGLO Цель работы: дать представление о процедуре генетической трансформации. Провести эксперимент по трансформации клеток E. сoli, продемонстрировать связи ДНК→РНК→БЕЛОК→СВОЙСТВО организма В рамках данной работы бактериальные клетки E. coli (XL1-Blue) трансформируют плазмидой с геном, кодирующим зеленый флюоресцентный белок (GFP, green fluorescent protein), выделенным из биолюминесцирующей медузы Aequorea victoria. Трансформированные бактериальные клетки, экспрессирующие ген GFP, продуцируют зеленый флюоресцентный белок и флюоресцируют зеленым цветом при облучении ультрафиолетовой лампой. Бактериальные клетки помимо одной большой хромосомальной ДНК часто содержат одну или несколько небольших циклических ДНК, называемых плазмидами. В последних есть дополнительные к хромосомальным гены, экспрессия которых обеспечивает клетке дополнительные свойства. В данной работе клетки трансформируются плазмидой pGLO, в состав которой входят ген, кодирующий зеленый флюоресцентный белок (GFP); ген, кодирующий белок β -лактамазу (bla), этот белок обеспечивает клетке устойчивость к антибиотику – ампициллину; участок специальной генетической регуляции арабинозный оперон (araC), позволяющей контролировать экспрессию флюоресцентного белка в трансформированных клетках. Материалы и оборудование: 1. Компетентные клетки E. coli (XL1-Blue); 2. Раствор плазмидной ДНК (pGLO); 3. Трансформационный буфер; 4. Агар на LB-среде; 5. Ампициллин, р-р 200 мг/мл; 6. Арабиноза, 20 % раствор; 7. Чашки Петри; 8. Пипетки, стерильные типсы; 9. Пластиковые пробирки Eppendorf; 10. Стеклянные петли; 11. Центрифуга; Введение в биотехнологию. Метод. указания по лабораторным работам -68- МОДУЛЬ 6. КЛЕТОЧНАЯ И ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ Работа 6.1. Трансформация клеток E. coli xli-Blue плазмидой pGLO 12. Контейнер со льдом, водяная баня (42 оС), термостат (37 оС); 13. Микробиологический бокс; 14. UV-лампа. Ход работы: 1. Подписать две пластиковые пробирки +ДНК и –ДНК. 2. В боксе стерильно отобрать по 100 мкл суспензии компетентных клеток в трансформационном буфере в каждую пробирку. Поместить пробирки в ледяную баню. 3. В пробирку +ДНК внести 1 мкл раствора плазмидной ДНК. В пробирку –ДНК внести такое же количество буфера без ДНК. Выдержать обе смеси на льду не менее 20 мин. 4. Чашки Петри подписать на дне следующим образом: LB-ДНК, LB/аmp-ДНК, LB/аmp+ДНК, LB/amp/ara-ДНК, LB/amp/ara+ДНК. 5. Расплавить агар в микроволновой печи, перенести его в бокс. 6. На дно соответствующих чашек поместить растворы ампициллина (0,25 мл, конечная конц. 200 мкг/мл и арабинозы (0,25 мл, конечная конц. 0,2 %). Залить в чашки агар (по 25 мл), осторожно перемешать и оставить полимеризоваться в боксе под UV-облучением. 7. Провести процедуру теплового шока. Для этого обе пробирки поместить в водяную баню (42 оС) на 25 сек (строго!), после чего быстро перенести их опять на лед. Выдержать 2-3 мин. 8. Пробирки вынуть изо льда, добавить по 500 мкл свежей LB-среды (стерильно!) и инкубировать при 37 оС в течение 30 мин. 9. Высеять полученные клетки на соответствующие чашки с агаром. Для этого отобрать по 100 мкл клеточной суспензии и перенести ее на поверхность агара. Растереть стерильной стеклянной петлей досуха, закрыть чашки, перевернуть и поместить в термостат (37 оС) на ночь. Анализ полученных результатов: 1. Пронаблюдайте полученные результаты посева на чашках Петри при нормальном освещении и при облучении чашек ультрафиолетовой лампой. Внесите свои наблюдения в табл. 6.1, отвечая на следующие вопросы: - как много колоний выросло на чашке (сравнительно)? - какого они цвета? - что наблюдали при облучении чашек ультрафиолетом? Таблица 6.1 +DNA, LB/amp +DNA, LB/amp/ara -DNA, LB/amp Введение в биотехнологию. Метод. указания по лабораторным работам -69- МОДУЛЬ 6. КЛЕТОЧНАЯ И ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ Работа 6.1. Трансформация клеток E. coli xli-Blue плазмидой pGLO -DNA, LB 2. Опишите, какие новые свойства приобрели трансформированные бактерии. Благодаря чему? 3. Определите эффективность трансформации по формуле Эфф. трансф. = число колоний на чашке / кол-во ДНК на чашку (мкг) 1. Определите число колоний, выросшее на чашках (+DNA, LB/amp) и (+DNA, LB/amp/ara). 2. Количество ДНК определите исходя из концентрации раствора ДНК и его количества, взятого для трансформации. Запишите проведенные расчеты и полученные результаты. Вопросы: 1. Что такое генетическая трансформация? 2. Что такое компетентные клетки? Как вы себе представляете процесс проникновения плазмидной ДНК внутрь клеток в момент температурного шока? 3. Почему для проведения генетических модификаций чаще всего используют клетки E.coli? Какие еще организмы используются в биотехнологии? 4. Какова эффективность проведенной вами трансформации? От чего она зависит? Почему клетки на чашке +DNA, LB/amp выросли, но не флюоресцируют? 5. Как вы думаете, о чем бы свидетельствовала флюоресценция клеток, выросших на чашке +DNA, LB/amp? Работа 6.2. Экспрессия генов, клонированных в прокариотических системах. Культивирование рекомбинантных клеток E.coli Цель работы: культивирование рекомбинантных клеток E.coli BL21(DE3) с контролируемой экспрессией двух различных белков: рекомбинантного белка апообелина (плазмида рЕТ-OL8) и химерного белка proZZObe (плазмида pTZZO2). В работе используется штамм E.coli BL21(DE3). Помимо жесткой регуляции экспрессии этот штамм лишен ряда протеолитических ферментов, что способствует уменьшению протеолитического расщепления рекомбинантных белков в клетке-хозяине. Материалы и оборудование: 1. Трансформированные клетки; Введение в биотехнологию. Метод. указания по лабораторным работам -70- МОДУЛЬ 6. КЛЕТОЧНАЯ И ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ Работа 6.2. Экспрессия генов, клонированных в прокариотических системах. 2. Стерильная LB среда; 3. Стерильные колбы объемом 100 мл – 2 шт.; 1 л – 2 шт.; 4. Ампициллин (р-р , 200 мг/мл); 5. ИПТГ (изопропил –β-D-тиогалактопиранозид); 6. Микробиологический бокс; 7. Термостатированный шейкер; 8. Фотоэлектроколориметр (ФЭК) и кюветы к нему; 9. Центрифуга с охлаждением и центрифужные стаканы к ней; 10. Весы для уравновешивания центрифужных стаканов; 11. Набор автоматических пипеток и наконечников к ним. Ход работы: 1. Подписать колбы для культивирования «Obe» и «proZZ-Obe». 2. В стерильных условиях внести в 100 мл колбы по 20 мл стерильной LB-среды, раствор ампициллина до конечной концентрации 200 мкг/мл и 2–3 среднего размера колонии соответствующих бактерий. Инкубировать при 37 оС при активном перемешивании до плотности Д590 = 0,5–0,6. Оптическую плотность измерять через каждые 45–60 мин с помощью ФЭКа против исходной среды. Пробу отбирать стерильными наконечниками. 4. Полученную культуру поместить в холодильник до следующего утра. Отцентрифугировать клетки с помощью центрифуги К-23 (3–4 тыс. об/мин, 5 оС, 15 мин). 5. В колбы объемом 1 л с 200 мл стерильной LB-среды внести раствор ампициллина до конечной концентрации 200 мкг/мл. Стерильно перенести клетки в эти колбы, суспендируя их свежей стерильной LB-средой. 6. Инкубировать при 37 оС при активном перемешивании. Следить за ростом клеток, измеряя оптическую плотность ОД590 против исходной среды через каждый час. 7. При плотности ОД590 = 0,6–0,8 отобрать по 1 мл культуры и отцентрифугировать на микроцентрифуге. Хранить образец клеток до индукции при –20 оС. Провести индукцию транскрипции рекомбинантного белка. Для этого в колбы добавить сухую навеску ИПТГ (до концентрации 100 мг/л). 8. Продолжить культивирование еще в течение трех часов, следить за ростом как описано в п. 3. Отобрать аликвоту клеточной суспензии, равную количеству клеток до индукции, отцентрифугировать и хранить образец, как описано в п. 4. 9. Построить кривую роста оптической плотности Д590 от времени. 10. Бактерии отделить центрифугированием, как описано в п.1. 11. Промыть клетки, ресуспендируя физраствором (0,9 % NaCl), и вновь отцентрифугировать. Взвесить полученную клеточную пасту. Вопросы: 1. Для чего нужна регуляция экспрессии рекомбинантных белков? Введение в биотехнологию. Метод. указания по лабораторным работам -71- МОДУЛЬ 6. КЛЕТОЧНАЯ И ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ Работа 6.2. Экспрессия генов, клонированных в прокариотических системах. 2. Какие регуляторные участки должны присутствовать в экспрессируемой плазмиде? 3. Ген экспрессируемого в Е.coli белка находится под промотором РНК полимеразы фага Т7. Какие гены должны присутствовать в клетке-хозяине, чтобы экспрессия была эффективной? 4. Каковы свойства клеток Е.coli BL21(DE3), которые вы использовали для экспрессии рекомбинантных белков? 5. Опишите регуляторные механизмы экспрессии в системе рЕТ, пользуясь рис.11. Нарисуйте схематически плазмиды для экспрессии апообелина и химерного белка. 6. Что такое ИПТГ? Что происходит в трансформированных клетках после его добавления в питательную среду? 7. В каких условиях производится культивирование трансформированных клеток Е.coli BL21(DE3)? Введение в биотехнологию. Метод. указания по лабораторным работам -72- МОДУЛЬ 7. СЕЛЬСКОХОЗЯЙСТВЕННАЯ БИОТЕХНОЛОГИЯ Цель – формирование представлений о границах применимости и эффективности биотехнологий для повышения продуктивности сельского хозяйства. Задачи: на примере освоения техники конструирования безопасных форм пестицидов, включенных в резорбируемый полимерный матрикс, дать основы методологии и техники сельскохозяйственной биотехнологии. Биотехнология вносит большой вклад в повышение эффективности сельскохозяйственного производства. Разработаны и успешно применяются биотехнологические методы защиты растений от вредителей и возбудителей болезней полезной биоты. Это различные подходы, влючающие: 1) выведение сортов растений, устойчивых к неблагоприятным факторам; 2) химические средства борьбы (пестициды) с сорняками (гербициды), грызунами (ратициды), насекомыми (инсектициды), нематодами (нематоциды), фитопатогенными грибами (фунгициды), бактериями, вирусами; 3) биологические средства борьбы с вредителями, использование их естественных врагов и паразитов, а также токсических продуктов, образуемых живыми организмами. Биотехнология решает задачи повышения продуктивности сельскохозяйственных культур, их пищевой (кормовой) ценности, задачу создания сортов растений, растущих на засоленных почвах, в засушливых и заболоченных районах. Важное место в выведении новых сортов растений занимает метод культивирования растительных клеток in vitro. Регенерируемая из таких клеток «молодая поросль» состоит из идентичных по генофонду экземпляров, сохраняющих ценные качества избранного клеточного клона. Клонирование клеток с последующим их скринингом и регенерацией растений из отобранных клонов рассматривают как важный метод сохранения и улучшения древесных пород умеренных широт, в частности хвойных деревьев. Растения-регенеранты, выращенные из клеток или тканей меристемы, используют ныне для разведения спаржи, земляники, брюссельской и цветной капусты, гвоздик, папоротников, персиков, ананасов, бананов. С клонированием клеток связывают надежды на устранение вирусных заболеваний растений. Разработаны методы, позволяющие получать регенеранты из тканей верхушечных почек растений. В дальнейшем среди регенерированных растений проводят отбор особей, выращенных из незараженных клеток, и выбраковку больных растений. Раннее выявление вирусного заболевания, необходимое для подобной выбраковки, может быть осуществлено методами иммунодиагностики, с использованием моноклональных антител или методом ДНК/РНК-проб. Предпосылкой для этого является получение очищенных препаратов соответствующих вирусов или их структурных компонентов. Клонирование клеток – перспективный метод получения не только новых сортов, но и промышленно важных продуктов. При правильном под Введение в биотехнологию. Метод. указания по лабораторным работам -73- МОДУЛЬ 7. СЕЛЬСКОХОЗЯЙСТВЕННАЯ БИОТЕХНОЛОГИЯ боре условий культивирования, в частности при оптимальном соотношении фитогормонов, изолированные клетки более продуктивны, чем целые растения. Иммобилизация растительных клеток или протопластов нередко ведет к повышению их синтетической активности. Биологические удобрения применяют для обогащения почвы связанным азотом. Большое распространение получили препараты нитрагин и азотобактерин – клетки клубеньковых бактерий и азотобактера, к которым добавляют стабилизаторы (мелассу, тиомочевину) и наполнитель (бентонит, почву). Азотобактерин обогащает почву не только азотом, но и витаминами и фитогормонами, гиббереллинами и гетероауксинами. Препарат фосфобактерин из Bacillus megaterium превращает сложные органические соединения фосфора в простые, легко усвояемые растениями. Фосфобактерин также обогащает почву витаминами и улучшает азотное питание растений. Большое значение биотехнология уделяет профилактике инфекционных заболеваний сельскохозяйственных животных с применением рекомбинантных живых вакцин и генно-инженерных вакцин-антигенов, ранней диагностике этих заболеваний с помощью моноклональных антител и ДНК/РНК-проб. Биологические методы и препараты занимают все более значимое место не только для повышения плодородия почв, но также и для борьбы с вредителями сельскохозяйственного производства и возбудителями болезней культурных растений и домашних животных. Работа 7.1. Депонирование пестицидов в матрикс из разрушаемых биополимеров. Исследование динамики разрушения матрикса в почве Цель работы: конструирование экологически безопасных форм пестицидов с применением биоразрушаемых полимеров (полигидроксиалканоатов, ПГА); исследование разрушаемости полимерного матрикса в почве. Бурное развитие химии и переход сельского хозяйства на интенсивные технологии привели к появлению и применению огромного разнообразия химических веществ для борьбы с вредителями, сорняками и возбудителями болезней культивируемых видов. В отличие от других загрязняющих веществ (радионуклиды, тяжелые металлы и др.) реальная опасность пестицидов не полностью осознана. Это объясняется тем, что пестициды – это сотни действующих веществ и десятки тысяч препаратов. Методы анализа их в окружающей среде сложны и не всегда надежны. Отсутствие информации об экотоксикологических свойствах пестицидов – главная причина их опасности, при этом долговременные экологические последствия применения пестицидов не изучены. Используемые в большинстве случаев в виде порошков, суспензий и эмульсий пестициды зачастую не обеспечивают адресную доставку препаратов, что ведет к их рассеиванию и последующей аккумуляции в Введение в биотехнологию. Метод. указания по лабораторным работам -74- МОДУЛЬ 7. СЕЛЬСКОХОЗЯЙСТВЕННАЯ БИОТЕХНОЛОГИЯ Работа 7.1. Депонирование пестицидов в матрикс из разрушаемых биополимеров. биосфере. Широкое применение пестицидов, к сожалению, не обеспечило полную защиту сельскохозяйственных культур. Большое число насекомых и сорняков остаются неконтролируемыми. Они продолжают наносить огромный вред сельскому хозяйству. Одним из серьезных недостатков современных препаратов является аккумуляция в биосфере и приобретение нежелательными организмами резистентности к ним. Пестициды, обладающие мутагенным и канцерогенным действием, попадая в организм человека с продуктами питания, представляют угрозу для здоровья. Традиционное применение пестицидов вступило в противоречие с глобальной проблемой защиты окружающей среды. Это вызывает необходимость поиска более эффективных средств и методов защиты полезной биоты, не оказывающих отрицательного воздействия на человека и окружающую среду в целом. Новейшим направлением исследований, ориентированных на снижение риска неконтролируемого распространения ксенобиотиков в биосфере, является разработка экологически безопасных препаратов нового поколения с адресным и контролируемым выходом активного начала за счет использования специальных покрытий и/или матриксов из биоразрушаемых материалов. В последние годы стали появляться работы по получению препаратов из полимерных материалов, нагруженных пестицидами. Ключевым звеном для создания препаратов такого типа является наличие адекватного материала, обладающего специальными свойствами, среди которых обязательные: экологическая совместимость с окружающей средой и глобальными биосферными круговоротными циклами, то есть разрушаемость, безопасность для живой и неживой природы, длительная (недели и месяцы) сохраняемость в природной среде и контролируемая деструкция с образованием нетоксичных продуктов; химическая совместимость с пестицидами, возможность переработки доступными способами, совместимыми с технологиями изготовления этих препаратов. Материалы и оборудование: 1. Образец полимера; 2. Образец модельного пестицида (минеральная соль); 3. Шаровая мельница; 4. Весы; 5. Фарфоровая ступка; 6. Лабораторный пресс; 7. Микроскоп с фотоаппаратом; 8. Образцы почвы; 9. Пластиковые контейнеры; 10. Термостат. Ход работы: 1. Навеску полимера (5 г) подвегнуть размалыванию в шаровой мельнице. 2. Измельченный порошкообразный полимер развешать на 10 образцов массой 20 мг. Введение в биотехнологию. Метод. указания по лабораторным работам -75- МОДУЛЬ 7. СЕЛЬСКОХОЗЯЙСТВЕННАЯ БИОТЕХНОЛОГИЯ Работа 7.1. Депонирование пестицидов в матрикс из разрушаемых биополимеров. 3. Приготовить 10 навесок модельного препарата (NH4Cl) по 20 мг. 4. В фарфоровой ступке тщательно перемешать оба компонента. 5. Из полученной смеси на лабораторном прессе с использованием пресс-формы спрессовать компакты в виде таблетки. 6. Произвести взвешивание образцов. 7.Определить рН и влажность почвы. 8. Приготовить навески почвы по 100 г и разместить в пластиковые контейнеры. 9. В почве разместить полученные формы препаратов в виде таблетки. 10. Разместить приготовленные образцы (контейнеры с почвой с образцами препаратов) в термостате при заданной температуре (25 0С). 11. Ежедневно измерять и корректировать влажность почвы. 12. Периодически (еженедельно) в ходе занятий изымать на 3 контейнера для анализа состояния образцов препаратов (внешний вид, остаточная масса), фиксировать фотографированием. 13. Результаты заносить в табл. 6.1. 14. По завершении эксперимента построить график изменения массы формы (рис. 6.1), определить скорость разрушения полимерного матрикса (рис. 6.2) и период полураспада полимера в данных условиях: V = Mисх/М1… М2…М3 и т. д., где V – скорость разрушения полимера (мг/сутки), Мисх, М1 и т. д. – масса образцов. Таблица 6.1 Дата Длительность этапа, сут Масса образца Скорость разрушения полимера, г/сут Период полураспада Введение в биотехнологию. Метод. указания по лабораторным работам -76- МОДУЛЬ 7. СЕЛЬСКОХОЗЯЙСТВЕННАЯ БИОТЕХНОЛОГИЯ Работа 7.1. Депонирование пестицидов в матрикс из разрушаемых биополимеров. % от исходного Сутки Рис. 7.1. Динамика уменьшения массы полимерных образцов V, мг/сут Сутки Рис. 7.2. Динамика скорости биодеградации полимерного матрикса как платформы адресной доставки пестицидов Вопросы: 1. В чем принципиальное отличие по способам применения и эффективности действия биопестицидов и биоинсектицидов от химических препаратов? 2. Почему биоинсектициды исключают залповые выбросы препаратов в среду? 3. Что является ключевым моментом для успеха конструирования и применения биоинсектицидов и биогербицидов? Введение в биотехнологию. Метод. указания по лабораторным работам -77- МОДУЛЬ 8. ПЕРСПЕКТИВЫ РАЗВИТИЯ БИОТЕХНОЛОГИИ Лабораторные работы не предусмотрены. Введение в биотехнологию. Метод. указания по лабораторным работам -78- СПИСОК ЛИТЕРАТУРЫ К разделу 1 1. Биотехнология : в 8 сборниках / под ред. Н. Егорова, Н. Самуилова. – М. : Высшая школа, 1987. 2. Биотехнология: принципы и применение / под ред. И. Хиггинса, Д. Беста и Дж. Джонса. – М. : Мир, 1988. 3. Варфоломеев, С. Д. Биотехнология: Кинетические основы микробиологических процессов : учеб. пособие для биол. и хим. спец. вузов / С. Д. Варфоломеев, С. В. Калюжный. – М. : Высшая школа, 1990. 4. Волова, Т. Г. Биосинтез на водороде / Т. Г. Волова. – Новосибирск : Изд-во СО РАН, 2004. 5. Волова, Т. Г. Биотехнология / Т. Г. Волова. – Новосибирск : Изд-во СО РАН, 2002. 6. Гусев, М. В. Микробиология / М.В. Гусев, Л. А. Минеева. – 3-е изд. – М. : Изд-во МГУ, 1992. 7. Перт, С. Дж. Основы культивирования микроорганизмов / С. Дж. Перт. – М. : Мир, 1978. 8. Шлегель, Г. Г. Общая микробиология / Г. Г. Шлегель. – М. : Наука, 1984. К разделу 2 1. Биотехнология : в 8 сборниках / под ред. Н. Егорова и Н. Самуилова. – М. : Высшая школа, 1987. 2. Биотехнология: принципы и применение / под ред. И. Хиггинса, Д. Беста и Дж. Джонса. – М. : Мир, 1988. 3. Варфоломеев, С. Д. Биотехнология: Кинетические основы микробиологических процессов : учеб. пособие для биол. и хим. спец. вузов / С. Д. Варфоломеев, С. В. Калюжный. – М. : Высшая школа, 1990. 4. Волова, Т. Г. Биотехнология / Т. Г. Волова. – Новосибирск : Изд-во СО РАН, 2002. 5. Гапонов, К. П. Процессы и аппараты микробиологических производств / К. П. Гапонов. – М. : Легкая и пищевая промышленность, 1981.– 240 с. 6. Гусев, М. В. Микробиология / М. В. Гусев, Л. А. Минеева. – 3-е изд. – М. : Изд-во МГУ, 2001. 7. Методы биохимического исследования растений. – Л. : Колос, 1972. 8. Перт, С. Дж. Основы культивирования микроорганизмов / С. Дж. Перт. – М. : Мир, 1978. 9. Плешиков, Б. П. Практикум по биохимии растений / Б. П. Плешиков. – М. : Колос, 1976. 10. Скоупс, Р. Методы очистки белков / Р. Скоупс. – М. : Мир, 1985. Введение в биотехнологию. Метод. указания по лабораторным работам -79- СПИСОК ЛИТЕРАТУРЫ 11. Соколов, В. Н. Аппаратура микробиологической промышленности / В. Н. Соколов, М. А. Яблокова – Л. : Машиностроение, 1988. – 278 с. К разделу 3 1. Биотехнология : в 8 сборниках / под ред. Н. Егорова и Н. Самуилова. – М. : Высшая школа, 1987. 2. Иммобилизованные клетки и ферменты (Методы) / под ред. Дж. Вудворда. – М. : Мир, 1988. 3. Иммобилизованные ферменты / под ред. И. В. Березина, В. К. Антонова, К. Мартинека. – М. : Изд-во МГУ, 1976. 4. Скоупс, Р. Методы очистки белков / Р. Скоупс. – М. : Мир, 1985. 5. Химическая энзимология / под ред. И. В. Березина, К. Мартинека. – М. : Изд-во МГУ, 1983. – 278 с. К разделу 4 1. Бутенко, Р. Г. Клеточная инженерия / Р.Г. Бутенко, М. В. Гусев, А. Ф. Киркин. – М. : Высшая школа, 1987. 2. Глик, Б. Молекулярная биотехнология. Принципы применения / Б. Глик, Дж. Пастернак. – М. : Мир, 2002. 3. Клонирование ДНК (методы) / под ред. Д. Гловера. – М. : Мир, 1988. 4. Скоупс, Р. Методы очистки белков / Р. Скоупс. – М. : Мир, 1985. 5. Maxam, A. M. A new method of sequencing DNA / A. M. Maxam, W. Gilbert // Proc. Natl. Acad. Sci. USA. – 1977. – V. 74. – P. 560–564. 6. Sanger, F. DNA sequencing with chain-terminating inhibitors / F. Sanger, S. Niclein, A.R. Coulson // Proc. Natl. Acad. Sci. USA – 1977. – V. 74. – P. 5463–5467. К разделу 5 1. Волова, Т. Г. Экологическая биотехнология: учеб. пособие для университетов / Т. Г. Волова. – Новосибирск : Хронограф, 1997. – 141 с. 2. Волова, Т. Г. Биотехнология / Т. Г. Волова. – Новосибирск : Изд-во СО РАН, 1999. – 252 с. 3. Кузнецов, А. Е. Научные основы экобиотехнологии / А. Е. Кузнецов, Н. Б. Градова. – М. : Мир, 2006. 4. Экологическая биотехнология / под ред. К. Форстера и Д. Вейза. – Л. : Химия, 1990. К разделу 6 1. Волова, Т. Г. Экологическая биотехнология: учеб. пособие для университетов / Т. Г. Волова. – Новосибирск : Хронограф, 1997. – 141 с. Введение в биотехнологию. Метод. указания по лабораторным работам -80- СПИСОК ЛИТЕРАТУРЫ 2. Волова, Т. Г. Биотехнология / Т. Г. Волова. – Новосибирск : Изд-во СО РАН, 1999. – 252 с. 3. Лабораторно-практические занятия по сельскохозяйственной биотехнологии : метод. указания / сост. Г. М. Артамонова, С. И. Герасимова, С. В. Дегтярев, Е. З. Кочиева, Д. В. Калашников, И. К. Блиновский, Л. И. Хрусталева ; под ред. акад. ВАСХНИЛ В.С. Шевелухи. – М. : Изд-во МСХА, 1991. 4. Муромцев, Г. С. Основы сельскохозяйственной биотехнологии / Г. С. Муромцев, Р. Г. Бутенко, Т. И. Тихоненко, М. И. Порофьев. – М. : Наука, 1990. Введение в биотехнологию. Метод. указания по лабораторным работам -81-