У А. И. Артемьев*, Д. В. Баурин, М. Г. Гордиенко, И. В....
advertisement
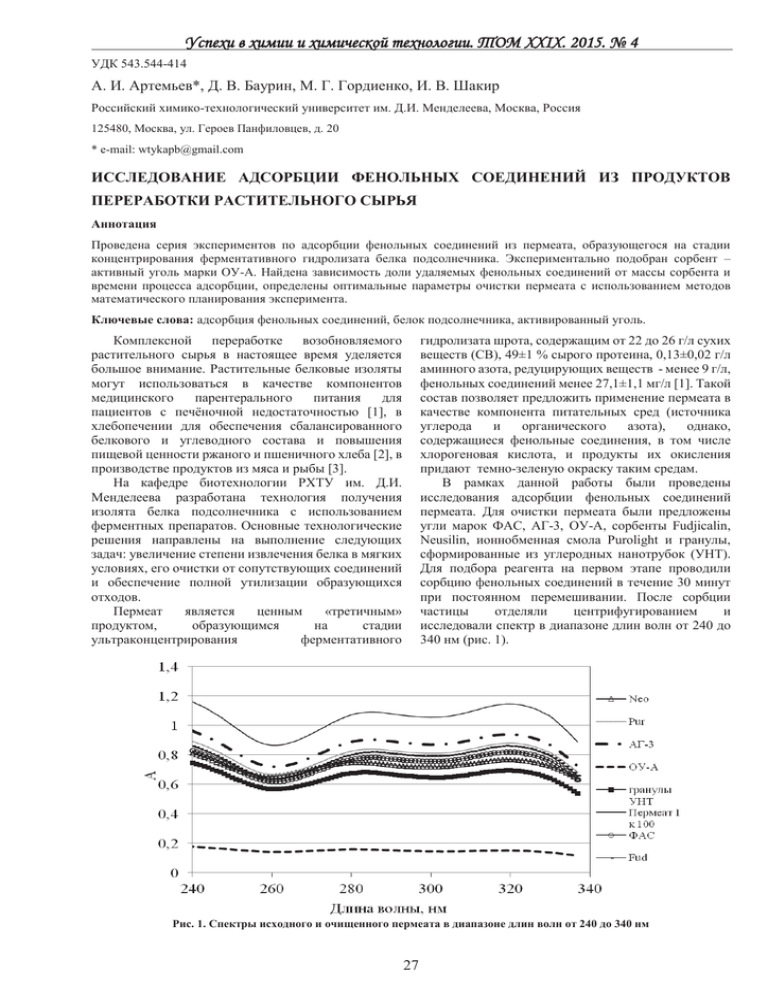
Успехи в химии и химической технологии. ТОМ XXIX. 2015. № 4 УДК 543.544-414 А. И. Артемьев*, Д. В. Баурин, М. Г. Гордиенко, И. В. Шакир Российский химико-технологический университет им. Д.И. Менделеева, Москва, Россия 125480, Москва, ул. Героев Панфиловцев, д. 20 * e-mail: wtykapb@gmail.com ИССЛЕДОВАНИЕ АДСОРБЦИИ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ ИЗ ПРОДУКТОВ ПЕРЕРАБОТКИ РАСТИТЕЛЬНОГО СЫРЬЯ Аннотация Проведена серия экспериментов по адсорбции фенольных соединений из пермеата, образующегося на стадии концентрирования ферментативного гидролизата белка подсолнечника. Экспериментально подобран сорбент – активный уголь марки ОУ-А. Найдена зависимость доли удаляемых фенольных соединений от массы сорбента и времени процесса адсорбции, определены оптимальные параметры очистки пермеата с использованием методов математического планирования эксперимента. Ключевые слова: адсорбция фенольных соединений, белок подсолнечника, активированный уголь. гидролизата шрота, содержащим от 22 до 26 г/л сухих веществ (СВ), 49±1 % сырого протеина, 0,13±0,02 г/л аминного азота, редуцирующих веществ - менее 9 г/л, фенольных соединений менее 27,1±1,1 мг/л [1]. Такой состав позволяет предложить применение пермеата в качестве компонента питательных сред (источника углерода и органического азота), однако, содержащиеся фенольные соединения, в том числе хлорогеновая кислота, и продукты их окисления придают темно-зеленую окраску таким средам. В рамках данной работы были проведены исследования адсорбции фенольных соединений пермеата. Для очистки пермеата были предложены угли марок ФАС, АГ-3, ОУ-А, сорбенты Fudjicalin, Neusilin, ионнобменная смола Purolight и гранулы, сформированные из углеродных нанотрубок (УНТ). Для подбора реагента на первом этапе проводили сорбцию фенольных соединений в течение 30 минут при постоянном перемешивании. После сорбции частицы отделяли центрифугированием и исследовали спектр в диапазоне длин волн от 240 до 340 нм (рис. 1). Комплексной переработке возобновляемого растительного сырья в настоящее время уделяется большое внимание. Растительные белковые изоляты могут использоваться в качестве компонентов медицинского парентерального питания для пациентов с печёночной недостаточностью [1], в хлебопечении для обеспечения сбалансированного белкового и углеводного состава и повышения пищевой ценности ржаного и пшеничного хлеба [2], в производстве продуктов из мяса и рыбы [3]. На кафедре биотехнологии РХТУ им. Д.И. Менделеева разработана технология получения изолята белка подсолнечника с использованием ферментных препаратов. Основные технологические решения направлены на выполнение следующих задач: увеличение степени извлечения белка в мягких условиях, его очистки от сопутствующих соединений и обеспечение полной утилизации образующихся отходов. Пермеат является ценным «третичным» продуктом, образующимся на стадии ультраконцентрирования ферментативного Рис. 1. Спектры исходного и очищенного пермеата в диапазоне длин волн от 240 до 340 нм 27 Успехи в химии и химической технологии. ТОМ XXIX. 2015. № 4 Степень удаления фенольных соединений оценивали по изменению оптической плотности при 285 нм и 320 нм, что соответствует максимумам поглощения растворов хлорогеновой кислоты. Наиболее эффективное удаление обеспечивалось применением активированного угля марки ОУ-А, который изготавливается из древесины березы, активируется водяным паром при температуре 800900 °С с последующим измельчением. Удельная поверхность угля Sуд = 400-500 м2/г, объем пор 0,7-0,8 см3/г [3,4]. Для определения оптимальных условий обработки (сорбции) была поставлена серия опытов в соответствии с центральным композиционным рототабельным планом (ЦКРП) эксперимента. В ходе процесса сорбции варьировали два фактора: X1 – масса угля, X2 – время обработки. В таблице 1 представлены факторы и уровни их варьирования и приведены экспериментальные значения для обработки 30 мл пермеата. В соответствии с планом было проведено 13 опытов. Матрица планирования с указанием результатов опытов представлена в таблице 2. Таблица 1. Факторы и уровни варьирования Факторы Масса угля на 30 мл пермеата, мг Время сорбции, мин (-1,414) 0,07 8,5 (-1) 0,15 15 Уровни варьирования (0) 0,38 30 (+1) 0,60 45 (+1,414) 0,69 50 Таблица 2. Матрица планирования и результаты эксперимента № 1 2 3 4 X1 1 -1 1 -1 X2 1 1 -1 -1 Y 0,68 0,40 0,71 0,25 № 5 6 7 8 X1 0 0 0 0 X2 0 0 0 0 Был проведен регрессионный анализ полученных данных. Получено уравнение (1), описывающее долю адсорбированного вещества: Y=0,67+0,15X1 – 0,08 X12 – 0,05 X22. Y 0,66 0,69 0,69 0,69 № 9 10 11 12 13 X1 0 1,414 -1,414 0 0 X2 0 0 0 -1,414 1,414 Y 0,68 0,71 0,37 0,64 0,58 Не значимыми оказались линейный эффект для Х2 и эффект парного взаимодействия. Анализ уравнения регрессии показал, что оптимальными условиями являются: концентрация угля – 0,08 г/мл и время сорбции – 45 минут. Спектры пермеата после очистки углем представлены на рисунке 2. (1) Рис.2. Спектры исходного и очищенного активированным углем марки ОУ-А пермеата в диапазоне длин волн от 240 до 340 нм Полученный очищенный пермеат сушили распылением на установке Mini Spray Dyer B-290 Buchi и использовали в качестве компонента питательной среды для культивирования Lactobacillus casei и Bacillus cereus в качестве единственного источника органического азота. 28 Успехи в химии и химической технологии. ТОМ XXIX. 2015. № 4 Минеральный состав среды соответствовал среде MRS. Результаты культивирования представлены в таблице 3. Из представленных результатов видно, что возможно применения очищенного и высушенного пермеата в качестве компонента питательной среды. Работа выполнена при финансовой поддержке Министерства образования и науки РФ в рамках базовой части государственного задания. Таблица 3. Основные показатели процесса культивирования в средах, содержащих аминотон и пермеат Источник азота Длительность лаг-фазы, ч Титр клеток, млн. КОЕ/мл pH Lactobacillus casei аминотон пермеат 2,75 4 22 18 3,5 3,7 Bacillus cereus аминотон пермеат 2 2,5 87 56 - Артемьев Артём Ильич, студент 5 курса факультета Информационных технологий и управления РХТУ им. Д. И. Менделеева, Россия, Москва. Баурин Дмитрий Витальевич, м.н.с. кафедры Биотехнологии РХТУ им. Д.И. Менделеева, Россия, Москва. Гордиенко Мария Геннадьевна, в.н.с. НИЧ РХТУ им. Д.И. Менделеева, Россия, Москва. Шакир Ирина Васильевна, доцент кафедры Биотехнологии РХТУ им. Д.И. Менделеева, Россия, Москва. Литература 1. Sunflower protein hydrolysates for dietary treatment of patients with liver failure / Bautista J. [et al.]. Journal of the American Oil Chemists’ Society. - 2000. - V. 77. - № 2. - P. 121-126. 2. Влияние белкового изолята подсолнечного шрота на аминокислотный состав хлеьа / Щеколдина Т.В. [и др.]. Техника и технология пищевых производств. - 2009. - Т. 1. 3. Заверская Ю.Г., Антипова Л.В. Проектирование рецептур рыборастительных колбасок для питания женщин во время беременности // Современные наукоемкие технологии. - 2010. - № 3. - С. 62–63. 4. Баурин Д.В. Комплексная технология переработки шрота подсолнечника с получением изолята белка и углеводно-белкового корма // Диссертация. - М.: РХТУ им. Д.И.Менделеева, 2014. - 160 с. 5. Сорбенты – Химические системы [Электронный ресурс]. - Режим доступа: http://www.chemsystem.ru/sorbents/ (дата обращения 14.04.2015). 6. Уголь активированный марки ОУ-А (уголь ОУ-А) [Электронный ресурс]. - Режим доступа: http://www.mtksorbent.ru/ugol-aktivnyj-aktivirovannyj/ugli-aktivnye-na-drevesnoj-osnove/ugol-aktivnyj-ou-v-detail (дата обращения 14.04.2015). 7. Активные угли. Эластичные сорбенты. Катализаторы, осушители и химические поглотители на их основе: Каталог / Мухин В.М. [и др.]. М.: Издательский дом "Руда и металлы", 2003. 280 с. Artemev Artem Ilich*, Baurin Dmitry Vitalevich, Gordienko Mariia Gennadievna, Shakir Irina Vasilevna D. Mendeleev University of Chemical Technology of Russia, Moscow, Russia. * e-mail: wtykapb@gmail.com STUDY THE ADSORPTION OF PHENOLIC COMPOUNDS FROM THE PRODUCTS OF PLANT RAW MATERIALS Abstract A series of experiments on the adsorption of phenolic compounds from the permeate formed in the enzymatic hydrolysate concentration step was held. Activated Charcoal AC-A grade was selected as a sorbent in the experiment. The equation, describing the dependence of the amount of the phenolics removed on the sorbent mass and adsorption time was found with the use of factorial design. Key words: adsorption of phenolics, sunflower protein, activated charcoal. 29






