ЛЕКЦИЯ № 8 План лекции: 1. Разрушение комплексных
advertisement

1
ЛЕКЦИЯ № 8
План лекции:
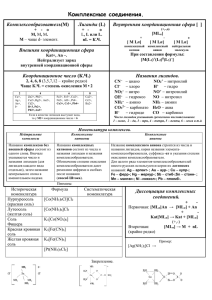
1. Разрушение комплексных соединений.
2. Влияние комплексообразования на растворимость осадков.
3. Применение комплексных соединений в качественном анализе.
Разрушение комплексных соединений.
В водном растворе комплексного соединения устанавливается равновесие диссоциации, сдвиг которого вправо приводит к разрушению комплекса. Сдвинуть равновесие
вправо, то есть разрушить комплекс, можно связывая продукты диссоциации в другие более прочные соединения. Например, свободные ионы металла можно перевести в малорастворимое соединение или в более прочный комплекс, а лиганд связать в слабую кислоту:
разрушение
MLn
↔
+X
MX↓
осадок
M
+
nL
+ L'
+ Н+
ML’n
более прочный
комплекс
HL
слабая
кислота
1. Образование малорастворимых соединений. Разрушение комплекса в этом случае
происходит в результате вытеснения лиганда из внутренней сферы комплекса ионом, образующим с центральным атомом малорастворимое соединение:
MLn + X ↔
MX↓ + nL
При этом устанавливается равновесие, константа которого имеет вид:
K
[L]n
[MLn ][X]
[L]n
[M]
[MLn ][X] [M]
1
βn (MLn ) K S (MX)
где: βn – константа устойчивости комплекса
KS – произведение (константа) растворимости
Если константа равновесия K >> 1, то реакция идет практически до конца, комплекс разрушается и образуется осадок малорастворимого соединения; если K << 1, то реакция не
идет и комплекс не разрушается. При этом, чем менее устойчив комплекс MLn (меньше
константа устойчивости βn) и менее растворимо образующееся малорастворимое соединение MX (меньше произведение растворимости KS), тем больше константа равновесия K и
легче идѐт процесс разрушения комплекса.
2
Например, при добавлении к раствору аммиаката серебра иодида калия имеем:
[Ag(NH3)2]+ + I- ↔ AgI↓ + 2NH3
K
[NH3 ]2
[Ag + ]
[Ag(NH3 )2+ ][I- ] [Ag + ]
1
β2 (Ag(NH3 )2+ ) K S (AgI)
1
1,7 10 1,3 10
7
16
4,5 108
1
Расчет показывает, что при действии иодида калия аммиачный комплекс серебра разрушается и в результате реакции образуется желтый осадок иодида серебра.
Эту реакцию используют при обнаружении ионов серебра в ходе систематического
анализа катионов V аналитической группы, когда осадок хлоридов ртути(I) и серебра обрабатывают раствором аммиака и на полученный раствор действуют иодидом калия. Образование желтого осадка AgI указывает на наличие ионов серебра в анализируемом растворе:
(AgCl, Hg2Cl2)↓ + 2NH4OH → [Ag(NH3)2]Cl + 2H2O (раствор)
[Ag(NH3)2]Cl + KI → AgI↓ + 2NH3 + KCl (желтый осадок)
2. Перевод в более прочный комплекс. Разрушение комплекса в этом случае происходит в результате вытеснения лиганда из внутренней сферы комплекса другим лигандом,
образующим с центральным атомом более прочный комплекс:
MLn + nL’ ↔ ML’n + nL
n(ML’n)
>
n(MLn)
Константа установившегося равновесия имеет вид:
K
[ML'n ][L]n
[MLn ][L' ]n
[ML'n ][L]n [M]
[MLn ][L' ]n [M]
βn (ML'n )
βn (MLn )
Если константа равновесия K >> 1, то реакция идет практически до конца, исходный комплекс разрушается и образуется более прочное комплексное соединение; если K << 1, то
реакция не идет и комплекс не разрушается. При этом, чем менее устойчив исходный
комплекс MLn (меньше его константа устойчивости βn) и более устойчив образующийся
комплекс ML’n (больше его константа устойчивости βn), тем больше константа равновесия
K и легче идѐт процесс разрушения комплекса.
Такой прием связывания ионов металла в более прочное соединение называется
маскировка и широко применяется в качественном анализе для устранения мешающего
действия ионов.
Например, при добавлении к раствору роданидного (тиоцианатного) комплекса железа фторида аммония имеем:
[Fe(SCN)6]3- + 6F- ↔ [FeF6]3- + 6SCN-
K
[FeF63- ][SCN- ] [Fe3+ ]
[Fe(SCN)3-6 ][F- ] [Fe3+ ]
β6 (FeF63- )
β6 (Fe(SCN)3-6 )
1,3 1016
1,7 103
7,6 1012
1
3
Расчет показывает, что при действии фторида аммония мало устойчивый роданидный
комплекс железа ( 6 = 1,7 103), окрашенный в ярко красный цвет, разрушается и в результате реакции образуется более прочный бесцветный фторидный комплекс ( 6 = 1,3 1016).
Добавление фторида аммония (или фторида калия) используют для маскировки ионов железа(III), мешающих обнаружению ионов кобальта по реакции с роданидом аммония:
Co2+ + 4SCN- → [Co(SCN)4]2- (синий в ИАС)
При этом ионы кобальта не реагируют с фторид-ионами и образуют синий роданидный
комплекс, а ионы железа связываются в прочный бесцветный фторидный комплекс и с
роданид-ионами не взаимодействуют.
3. Действие сильных кислот. Разрушение комплекса в этом случае происходит в результате связывания лиганда в слабую кислоту, что приводит к его удалению из внутренней сферы комплекса:
MLn + nH+ ↔ M + nHL
Константа установившегося равновесия имеет вид:
K
[M][HL]n
[MLn ][H+ ]n
[M][HL]n [L]n
[MLn ][H+ ]n [L]n
1
βn (MLn ) Kan (HL)
где: βn – константа устойчивости комплекса
Kа – константа кислотной диссоциации слабой кислоты
Если константа равновесия K >> 1, то реакция идет практически до конца, исходный комплекс разрушается; если K << 1, то реакция не идет и комплекс не разрушается. При этом,
чем менее устойчив комплекс MLn (меньше константа устойчивости βn) и слабее образующаяся кислота (меньше константа кислотной диссоциации Kа), тем больше константа
равновесия K и легче идѐт процесс разрушения комплекса.
Например, при добавлении к раствору аммиаката серебра азотной кислоты имеем:
[Ag(NH3)2]+ + 2H+ ↔ Ag+ + 2NH4+
K
[NH3 ]2
[Ag + ][NH+4 ]2
[Ag(NH3 )2+ ][H+ ]2 [NH3 ]2
1
β2 (Ag(NH3 )+2 ) Ka2 (NH+4 )
(1,75 10 5 )2
1,7 107 (10 14 )2
1,8 1011
Kb2 (NH3 )
β 2 (Ag(NH3 ) +2 ) KW2
1
Расчет показывает, что при действии азотной кислоты аммиачный комплекс серебра разрушается.
Эту реакцию используют при обнаружении ионов серебра в ходе систематического
анализа катионов V аналитической группы, когда осадок хлоридов ртути(I) и серебра обрабатывают раствором аммиака и на полученный раствор действуют раствором азотной
кислоты. Образование белого осадка AgCl (в результате разрушения аммиаката серебра и
взаимодействия ионов Ag+ с хлорид-ионом) указывает на наличие ионов серебра в анализируемом растворе:
4
(AgCl, Hg2Cl2)↓ + 2NH4OH → [Ag(NH3)2]Cl + 2H2O (раствор)
[Ag(NH3)2]Cl + HNO3 → AgCl↓ + 2NH4NO3
(белый осадок)
Следует отметить, что комплексы, лигандами в которых являются анионы сильных
кислот, при действии кислот не разрушаются.
Влияние комплексообразования на растворимость осадков.
Комплексообразование часто используется в химическом анализе для растворения
осадков, нерастворимых в воде, кислотах и щелочах. При этом важно уметь проводить
расчеты, позволяющие оценить влияние комплексообразования на растворимость малорастворимых соединений. В основном применяют способы расчета растворимости через
константу равновесия реакции растворения (при большом избытке комплексообразующего реагента) и с учетом мольных долей (общий способ расчета).
1. Расчет растворимости через константу равновесия. Растворение малорастворимого соединения в комплексообразующем реагенте (лиганде) протекает по уравнению:
MX↓ + nL ↔ MLn + X
Константа равновесия этой реакции имеет вид:
K
[ML n ][X]
[L]n
[ML n ][X] [M]
[M]
[L]n
β n (ML n ) K S (MX)
Если молярная растворимость малорастворимой соли МХ равна S, то равновесные концентрации [MLn ] = [X] = S, и тогда:
K
[MLn ][X]
[L]n
S S
[L]n
S2
[L]n
βn (MLn ) KS (MX)
Откуда:
S
K [L]n
βn (MLn ) K S (MX) [L]n
где: βn – константа устойчивости комплекса
KS – произведение (константа) растворимости
Например, растворимость хлорида серебра в 1 М растворе аммиака равна:
AgCl↓ + 2NH3 ↔ [Ag(NH3)2]+ + ClЕсли растворимость AgCl равна S, то [Ag(NH3)2+] = [Cl-] = S, тогда:
K
S
[Ag(NH3 )2+ ][Cl- ] [Ag + ]
[NH3 ]2
[Ag + ]
β2 (Ag(NH3 )2+ ) K S (AgCl) [NH3 ]2
β2 (Ag(NH3 )2+ ) K S (AgCl)
1,7 107 1,8 10
10
12
S2
[NH3 ]2
5,5 10 2 моль/л
5
Растворимость AgCl в воде:
S
KS
1,8 10
1,3 10 5 моль/л
10
Присутствие аммиака в данном случае приводит к увеличению растворимости хлорида серебра примерно в 4000 раз:
Sв воде
Sв 1 М NH
=
3
5,5 10
1,1 10
-2
-5
= 4230
Таким образом, присутствие комплексообразующего реагента приводит к значительному увеличению растворимости малорастворимых соединений, способных к образованию комплексов.
2. Расчет растворимости с учетом мольной доли. В этом случае расчет проводится
с использованием условного произведения растворимости, учитывающего протекание
конкурирующей реакции комплексообразования:
MX
↔
+L
M + X
↕
ML ↔ ML2 ↔ . . . . ↔ MLn
+L
+L
+L
Если молярная растворимость малорастворимой соли МХ равна S, то равновесные концентрации [X] = S, а [M] = S∙α (M) и тогда:
K S (MX)
[M][X]
S
S α(M) S
KS
α(M)
S 2 α(M)
K S'
где: α(М) – мольная доля свободных ионов металла
KS’ – условное произведение растворимости малорастворимой соли
Общая концентрация ионов металла в растворе равна сумме равновесных концентраций
всех частиц, в состав которых он входит:
CM = [M] + [ML] + [ML2] + . . . . + [MLn] = S
Тогда:
α(M)
[M]
CM
[M]
[M]
S
β1[M][L]
[M]
[M] + [ML] + [ML 2 ] + . . . + [ML n ]
[M]
β 2 [M][L]2
...
β n [M][L]n
6
1
β1[L]
1
β 2 [L]2
...
β n [L]n
где: β1, β2 . . . βт – суммарные константы устойчивости комплексов
Например, растворимость хлорида серебра в 1 М растворе аммиака равна:
AgCl ↔ Ag+ + Cl+NH3 ↕
[AgNH3]+ ↔ [Ag(NH3)2]+
+NH3
Если растворимость AgCl равна S, то [Ag+] = S∙α (Ag+), a [Cl-] = S, тогда:
K S (AgCl)
CAg
α(Ag + )
[Ag + ][Cl- ]
S α(Ag + ) S
S 2 α(Ag + )
[Ag+ ] + [AgNH3+ ] + [Ag(NH3 )2+ ]
[Ag + ]
CAg
[Ag + ]
[Ag + ] + [AgNH3+ ] + [Ag(NH3 )2+ ]
[Ag + ]
[Ag + ] + β1[Ag + ][NH3 ] + β 2 [Ag + ][NH3 ]2
1
1 + β1[NH3 ] + β 2 [NH3 ]2
1
1 + 2,1 10 1 + 1,7 107 12
5,9 10
3
8
Отсюда:
S
K S (AgCl)
α(Ag + )
K S0 (AgCl)
α(Ag + )
1,8 10 10
5,9 10 8
5,5 10
2
моль/л
Полученный результат совпадает с расчетом, проведенным с использованием константы равновесия реакции растворения хлорида серебра в аммиаке.
Применение комплексных соединений в качественном анализе.
Комплексные соединения широко используются в качественном химическом анализе для обнаружения и разделения ионов, маскировки мешающих ионов, растворения осадков. В данном разделе приведены примеры их аналитического применения.
1. Обнаружение ионов. При этом комплексы могут выступать в реакции обнаружения как в качестве реагента, так и в качестве продукта реакции, обладающего характерной
окраской.
Например, катионы железа(II) и железа(III) можно открыть по образованию темносиних осадков комплексов «турнбулевой сини» Fe3[Fe(CN)6]2 и “берлинской лазури»
Fe4[Fe(CN)6]3 (продукты реакций) по реакциям с феррицианидом (K3[Fe(CN)6]) и ферроцианидом (K4[Fe(CN)6]) калия соответственно (реагенты):
7
3Fe2+ + 2Fe(CN)6]3- → Fe3[Fe(CN)6]2↓
4Fe3+ + 3Fe(CN)6]4- → Fe4[Fe(CN)6]3↓
В качестве реагента используется кобальтинитрит натрия Na3[Co(NO2)6], который с
ионами калия образует желтый осадок смешанной калиево-натриевой комплексной соли:
2K+ + Na+ + [Co(NO2)6]3- → K2Na[Co(NO2)6]↓
Окрашенные комплексы могут получаться и в реакциях ионов металлов с реагентами, способными образовывать комплексные соединения.
Так, ионы кобальта(II) обнаруживают по реакции с роданидом аммония NH4SCN , в
результате которой образуется роданидный комплекс кобальта (NH4)2[Co(SCN)4], имеющий устойчивую синюю окраску при экстракции в слой изоамилового спирта:
Co2+ + 4SCN- → [Co(SCN)4]2Аналогичные примеры можно привести и при обнаружении ионов меди и висмута:
Cu2+ + 4NH3 → [Cu(NH3)4]2+ (синий)
Bi3+ + 3SC(NH2)2 → [Bi{SC(NH2)2}3] (желтый)
Здесь окрашенные в синий и желтый цвет комплексы меди и висмута образуются в
реакциях с аммиаком и тиомочевиной.
Особый случай представляет собой взаимодействие ионов металлов с органическими реагентами, в результате чего образуются внутрикомплексные соединения (ВКС), обладающие рядом особенностей. Они характеризуются высокой прочностью (за счет образования хелатных циклов), яркой окраской и селективностью взаимодействия, что позволяет их широко использовать для проведения дробного анализа.
Примерами таких определений могут служить следующие реакции:
Обнаружение ионов Ni2+ с диметилглиоксимом (реактив Чугаева)
0
O
O...H
CH3
N
C
OH
Ni2+ + 2
CH3
C
+ 2NH3
CH3
N
C
OH
CH3
C
N
N
+ 2NH4+
Ni
CH3
C
N
CH3
C
N
O
H...O
(ярко-красный)
Обнаружение ионов Zn2+ с дифенилтиокарбазоном (дитизон)
2
C6H5
NH
C6H5
N
NH
N
C
S + Zn2+ + 2OH-
C6H5
NH
C6H5
N
0
N
N
C
S
Zn + 2H2O
2
(малиново-красный)
8
Обнаружение ионов Hg2+ с дифенилкарбазидом
0
C6H5
Hg2+ + 2
NH
NH
C6H5
C
C6H5
O
NH
NH
NH
NH
N
NH
C
Hg
+ 2H+
O
2
C6H5
(сине-фиолетовый)
2. Маскировка мешающих ионов. Это прием, позволяющий связать мешающие ионы
в прочные комплексы, не мешающие обнаружению определяемого иона.
Например, обнаружению ионов Со2+ по реакции с роданидом аммония, в результате
чего получается синий комплекс кобальта [Co(SCN)4]2-, мешают ионы железа(III), которые
с роданид-ионами образуют красный комплекс [Fe(SCN)6]3-:
Fe3+ + 6SCN- → [Fe(SCN)6]3Добавление к реакционной смеси фторида аммония приводит к образованию более прочного бесцветного комплекса железа [FeF6]3- (ионы кобальта с фторид-ионами не взаимодействуют), что устраняет его мешающее действие:
[Fe(SCN)6]3- + 6F- → [FeF6]3- + 6SCNОбнаружению ионов Cd2+ по реакции со щелочью, в результате чего получается белый осадок гидроксида кадмия Cd(OH)2, мешают ионы меди(II), которые с ОН--ионами
образуют сине-зеленый осадок Cu(OH)2. Избежать мешающего действия ионов Cu2+ можно, добавив к реакционной смеси глицерин, который образует с ионами меди прочный
комплекс синего цвета (ионы кадмия с глицерином не взаимодействуют):
CH2
Cu2+ + 2 CH
CH2
HO
H2C
O
HC
O
H2C
OH
CH2
O
OH + 4OHOH
Cu
CH
O
CH2
OH
2-
+ 2H2O
В результате при действии щелочи гидроксид меди не образуется и на фоне синего раствора комплекса меди с глицерином наблюдают белый осадок гидроксида кадмия.
3. Растворение осадков. Реакции комплексообразования широко применяют для
растворения осадков малорастворимых в воде веществ.
Для растворения осадка хлорида серебра AgCl используют реакцию образования
растворимого аммиаката серебра:
AgCl↓ + 2NH4OH → [Ag(NH3)2]+ + Cl- + 2H2O
Сульфид ртути(II) HgS, практически не растворимый ни в кислотах (за исключением
«царской водки»), ни в щелочах, переводят в раствор, используя способность ионов ртути
образовывать прочный комплекс с иодид-ионами. Реакция протекает при действии на
сульфид ртути избытка иодида калия в кислой среде:
9
HgS↓ + 4I- + 2H+ → [HgI4]2- + H2S↑
Ряд малорастворимых соединений может быть переведен в раствор обработкой избытка щелочи, приводящей к образованию растворимых гидроксокомплексов:
Al(OH)3↓ + OH- → [Al(OH)4]PbSO4↓ + 4OH- → [Pb(OH)4]2- + SO424. Разделение ионов. Использование комплексообразования для разделения ионов
широко применяется в ходе систематического анализа катионов.
Например, в ходе анализа катионов III аналитической группы перекисным методом
ионы кобальта и никеля отделяют от ионов железа и марганца действием раствором аммиака в присутствии пероксида водорода:
Раствор:
Co2+, Ni2+, Fe2+, Fe3+, Mn2+
NH4OH + H2O2
Осадок:
Раствор:
Fe(OH)3, MnO(OH)2
[Co(NH3)6]3+, [Ni(NH3)2]2+
Действием концентрированной хлороводородной кислоты на сульфиды катионов IV
аналитической группы можно отделить кадмий и сурьму, переведя их в раствор в виде
хлоридных комплексов:
Осадок:
CuS, CdS, Bi2S3, HgS, As2S3, As2S5, Sb2S3, Sb2S5
HCl (конц)
Осадок:
Раствор:
CuS, Bi2S3, HgS, As2S3, As2S5
[CdCl4]2-, [SbCl6]3-, [SbCl6]-
Дополнительные примеры применения комплексообразования в качественном анализе студент должен подобрать самостоятельно, используя материалы лабораторного
практикума по качественному химическому анализу катионов.