Химические свойства алканов
advertisement
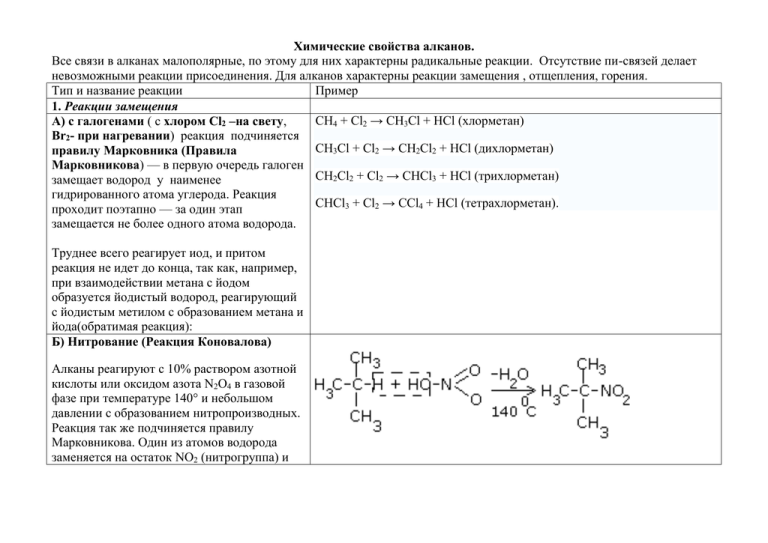
Химические свойства алканов. Все связи в алканах малополярные, по этому для них характерны радикальные реакции. Отсутствие пи-связей делает невозможными реакции присоединения. Для алканов характерны реакции замещения , отщепления, горения. Тип и название реакции Пример 1. Реакции замещения CH4 + Cl2 → CH3Cl + HCl (хлорметан) А) с галогенами ( с хлором Cl2 –на свету, Br2- при нагревании) реакция подчиняется CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан) правилу Марковника (Правила Марковникова) — в первую очередь галоген CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан) замещает водород у наименее гидрированного атома углерода. Реакция CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан). проходит поэтапно — за один этап замещается не более одного атома водорода. Труднее всего реагирует иод, и притом реакция не идет до конца, так как, например, при взаимодействии метана с йодом образуется йодистый водород, реагирующий с йодистым метилом с образованием метана и йода(обратимая реакция): Б) Нитрование (Реакция Коновалова) Алканы реагируют с 10% раствором азотной кислоты или оксидом азота N2O4 в газовой фазе при температуре 140° и небольшом давлении с образованием нитропроизводных. Реакция так же подчиняется правилу Марковникова. Один из атомов водорода заменяется на остаток NO2 (нитрогруппа) и выделяется вода 2. Реакции отщепления А) дегидрирование –отщепление водорода. Условия реакции катализатор –платина и CH3- CH3→ CH2= CH2 + Н2 температура. Б) крекинг процесс термического C6H14 C2H6 + C4H8 разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью. При температуре 450–700 oС алканы распадаются за счет разрыва связей С–С (более прочные связи С– Нпри такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов В) полное термическое разложение СН4 C + 2H2 3. Реакции окисления А) реакция горения При поджигании (t = СnН2n+2 + O2 ––>CO2 + H2O + Q o 600 С) алканы вступают в реакцию с кислородом, при этом происходит их СН4 + 2O2 ––>CO2 + 2H2O + Q окисление до углекислого газа и воды. Б) Каталитическое окисление- при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–Спримерно в середине молекулы и С–Н и используется для Например, при неполном окислении бутана (разрыв связи С2–С3) получения ценных продуктов: карбоновых получают уксусную кислоту кислот, кетонов, альдегидов, спиртов. 4. Реакции изомеризациих арактерны не для всех алканов. Обращается внимание на С4Н10 C4H10 возможность превращения одних изомеров в другие, наличие катализаторов. 5.. Алканы с основной цепью в 6 и более атомов углерода также вступают в реакцию дегидроциклизации, но всегда образуют 6членный цикл (циклогексан и его производные). В условиях реакции этот цикл подвергается дальнейшему дегидрированию и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода (арена). Способы получения алканов. Алканы в больших количествах получают из природного газа и нефти. Из простых веществ в электрическом разряде: Гидролиз карбида алюминия Нагревание моногалогеноалканов с металлическим натрием(реакция Вюрца) Если разные галогеноалканы, то результатом будет смесь трех продуктов: 5. Декарбоксилирование. Сплавление ацетата натрия со щелочью. Полученный этим способом алкан будет иметь на один атом углерода меньше. 6. Гидролиз реактива Гриньяра: 7. Алканы симметричного строения могут быть получены в результате электролиза солей карбоновых кислот. (реакция Кольба) 1. 2. 3. 4.


















