Опыт лечения детей и подростков с медуллярным раком
advertisement

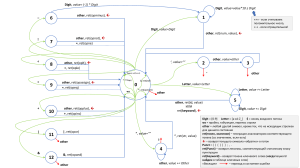
ОПЫТ ЛЕЧЕНИЯ МЕДУЛЛЯРНОГО РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПРОФИЛАКТИЧЕСКИХ ТИРЕОИДЭКТОМИЙ У ДЕТЕЙ И ПОДРОСТКОВ С МУТАЦИЕЙ В ГЕНЕ RET •Р.В. Шишков2,1, Н.В. Иванова1, Р.И. Пименов1, А.И. Павловская3, В.М. Козлова4,3, Ф.А. Амосенко4,3, Л.Н. Любченко3, Т.П. Казубская3, Н.А. Кошечкина 1,2, И.И. Матвеева3, Н.Ю. Калинченко5,1, В.Г. Поляков1,2 •1НИИ детской онкологии и гематологии РОНЦ им. Н.Н. Блохина, Москва, Россия •2ГБОУ ДПО РМАПО, Москва, Россия •3НИИ клинической онкологии РОНЦ им. Н.Н. Блохина, Москва, Россия •4ФГБНУ МГНЦ, Москва, Россия •5Эндокринологический научный центр МЗ РФ, Москва, Россия СТРУКТУРА ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ГОЛОВЫ И ШЕИ У ДЕТЕЙ 15% 11% 22% 7% 3% 3% 4% 35% мягкие ткани щитовидная железа глаз и орбита носоглотка слюнные железы полость рта и глотка гортань и гортаноглотка прочие РЩЖ у детей составляет: от 1 до 3 % от общего количества злокачественных новообразований от 8 до 22 % злокачественных солидных опухолей головы и шеи до 40% - злокачественных эпителиальных опухолей Клеточный состав ЩЖ • Фолликулярные, или А-клетки, вырабатывающие гормон тироксин (Т4) и трийодтиронин (Т3) (гистогенетически связанные с эпителием третьей жаберной дуги) • В-клетки, или оксифильные клетки, описанные Ашкинази, но носят имя другого исследователя Гюртле. Эти клетки относятся к онкоцитам, они богаты митохондриями и являются вариантом фолликулярного эпителия, т.е. А-клеток • Парафолликулярные или С-клетки ЩЖ не участвуют в обмене веществ, а синтезируют кальцитонин (влияет на остеокласты и регулирует высвобождение кальция из костей) и целый ряд биологически активных веществ (пептиды). С-клетки имеют нейроэндокринную природу и относятся к дисперсной периферической нейроэндокринной системе и несмотря на их близкое соседство к фолликулярным клеткам у них отсутствует с ними анатомическое и гормональное взаимодействие Медуллярный РЩЖ у детей и подростков • МРЩЖ - это злокачественная опухоль ЩЖ, имеющая признаки С-клеточной дифференцировки (синонимами этой опухоли являются: солидный рак, солидный рак с амилоидозом стромы и С-клеточный рак) • МРЩЖ возникает, как спорадически, так и при семейном эндокринном синдроме и чаще составляет от 6 до 8 % (данные НИИ ДОГ 4,6 %) • МРЩЖ имеет наихудший прогноз у детей и подростков, среди всех форм и вариантов РЩЖ! Медуллярный РЩЖ • Для МРЩЖ характерен клинический полиморфизм выраженный разными типами заболевания: - Спорадический медуллярный рак (50-70%) - Наследственный медуллярный рак (30-50%) включает три доминантно наследуемые формы: 1. МЭН 2А (синдром Сиппла) – медуллярный рак, феохромоцитома (10-60%), гиперпаратиреоз (10-30%); болезнь Гиршпрунга, амилоидный кожный лихениоз (более 90% всех МЭН 2 синдромов) 2. МЭН 2Б (синдром Горлина) – медуллярный рак, феохромоцитома (60%), невриномы слизистых оболочек, ганглионевромы (95%), марфаноидный фенотип (толстые губы, высокий рост, астеническое телосложение, длинные конечности относительно туловища, арахнодактилия) , нейрофиброматоз Реклингхаузена , болезнь Гиршпрунга, мальформация мочевого пузыря , ганглионейромы конъюнктивы, миелинизация роговичного нерва, пигментные пятна на лице • 3. Семейный MРЩЖ, без любой другой эндокринопатии. Пациенты НИИ ДОГ с МРЩЖ • С 1971 года по июнь 2015 года в НИИ ДОГ был пролечен 21 пациент с подтвержденным на основании комплексного клинико-генетического обследования, до оперативного лечения, МРЩЖ • Все дети были в возрасте от 5 до 15 лет (9 мальчиков и 12 девочек) • Из 21 больных у 9 (42,9 %) пациентов были установлены спорадические случаи МРЩЖ, у 7 (33,3 %) - был установлен синдром МЭН типа 2Б, у 3 (14,3 %) - МЭН типа 2А, у 2 (9,5 %) семейные случаи заболевания Характеристика опухолевого процесса у больных МРЩЖ • У 14 (66,7%) из 21 больных с первично диагностированным МРЩЖ, преобладали одиночные опухоли больших размеров (10-30 мм.), не выходящие за пределы капсулы щитовидной железы (ЩЖ) • Из 21 больных МРЩЖ у 8 (38 %) были выявлены метастазы в лимфатические узлы (ЛУ) шеи • Из 8 больных с метастазами МРЩЖ в ЛУ шеи у 5 (62,5 %) – метастазы выявлены до оперативного лечения, у 3 (37,5 %) больных обнаружены скрытые макроскопические и микроскопические метастазы после операции Хирургическое лечение пациентов с МРЩЖ • До 1999 года в НИИ ДОГ допускалось проведение органосохраняющих операций на ЩЖ при МРЩЖ, но только при спорадическом МРЩЖ и отсутствии регионарных метастазов • Гемитиреоидэктомии (ГТЭ) проведены у 5 (23,8%) из 21 пациентов, только при спорадическом МРЩЖ, локализованном, одностороннем процессе, без экстратиреоидного роста. Мы получили хорошие отдаленные результаты в данной группе, так в 4-х случаях, в дальнейшем, были проведены повторные операции, в 2-х из 4-х случаев остаточная или рецидивная опухолевая ткань обнаружена не была • После 1999 года мы проводим, всем больным МРЩЖ, только ТЭ с удалением паратрахеальной, претрахеальной и ларингеальной клетчатки, согласно общепризнанным международным подходам в лечении МРЩЖ Хирургическое и лучевое лечение пациентов с МРЩЖ • Во время операций, по показаниям, нами проводились интраоперационные биопсии различных групп ЛУ, при выявленном поражении - односторонние или двусторонние лимфодиссекции • У 5 больных, с наследственными формами МРЩЖ (МЭН2А и МЭН2Б) нами были проведены превентивные вмешательства на лимфатическом коллекторе шеи, в 3-х случаях были выявлены скрытые метастазы в ЛУ шеи! Тиреоидэктомия и профилактическое ФФИ с обеих сторон шеи у мальчика 9 лет с синдромом МЭН 2Б Тиреоидэктомия и профилактическое ФФИ с обеих сторон шеи у мальчика 9 лет с синдромом МЭН 2Б Тиреоидэктомия и профилактическое ФФИ с обеих сторон шеи у мальчика 9 лет с синдромом МЭН 2Б Рузультаты хирургического и лучевого лечения пациентов с МРЩЖ • У 4 больных, после ТЭ при экстратиреоидном распространении опухоли и метастазах в ЛУ шеи, в сроки от двух до 5 лет, были выявлены отдаленные метастазы. • Всем 8 больным, с экстратиреоидным распространении опухоли и метастазами в ЛУ шеи, после оперативного лечения была проведена дистанционная лучевая терапия (ДЛТ) на область шеи в СОД=40-54 Гр. • Из 8 больных с метастазами в ЛУ шеи - 4 (50 %) погибли от прогрессирования заболевания в различные сроки после лечения, 3 (37,5 %) пациентов находятся под динамическим наблюдением без признаков прогрессирования заболевания, 1 больная выбыла из наблюдения. • Из 21 пациентов с МРЩЖ живы без признаков заболевания 16 (76,2 %), одна больная выбыла из наблюдения, 4 (19 %) больных с отдаленными метастазами МРЩЖ погибли вследствие прогрессирования заболевания. Выживаемость больных при МРЩЖ Стадия 5 лет 10 лет I (T1N0M0) 100% 100% II (T1-3N0M0) 93% 93% III (T1-4N1M0) 77,8% 69% IV (T1-4N0-1M1) 25% 0% Алгоритм лечения больных МРЩЖ Тиреоидэктомия с лимфодиссекцией в объёме: Удаление центральной клетчатки шеи (уровень VI) Стадия Т1N0М0 Удаление центральной клетчатки шеи (уровень VI), ФФИ клетчатки шеи (II-V) уровень с обеих сторон, при N1в удаление VII уровня Стадия Т2-3N1а/в, Стадия рТ4 Заместительная гормональная терапия тироксином: 2 мкг. на кг. веса у детей Контрольное обследование: УЗИ шеи+брюшная полость, , рентгенография или КТ грудной клетки и средостения анализ крови: кальцитонин, РЭА Причиной наследственных форм МРЩЖ являются мутации в протоонкогене RET • Ген RET (RE-arranged during Transfection) картирован в центромерном участке длинного плеча хромосомы 10 (10q11.2), состоит из 21 экзона и кодирует тирозинкиназы рецепторного типа, которые участвуют в контроле пролиферации, миграции и/или дифференцировке клеток разных органов • Скрининговое обследование родственников больных МРЩЖ, с использованием одних клинических методов, позволяет выявить только уже манифестировавшие случаи заболевания. • Скрининг, с использованием молекулярно биологического исследования, позволяет выявлять носителей RET мутаций ТОЧКИ RET МУТАЦИЙ ПРИ МРЩЖ RET Экстрацеллюлярная часть Точки RET мутаций при МРЩЖ R600Q K603E Y606C C609R/G/S/Y C611R/G/F/S/W/Y C618R/G/F/S/Y C620R/G/F/S/W/Y Экзон 1 2 3 4 5 6 7 C630R/F/S/Y C634R/G/F/S/W/Y S649L K666E 8 Последовательность экзонов 9 10 11 E768D N777S V778I Q781R L790F Y791F Киназная часть V804L/M I852M 12 13 14 15 16 17 A883F S891A 18 R912P M918T 20 Adapted from de Groot JW et al. Endocr Rev 2006;27:535–560 Wells SA, Jr. et al. J Clin Oncol 2012;30:134–141 M918T 19 21 ARMS assay Тактика ведения носителей мутаций гена RET Современная тактика ведения бессимптомных носителей патологических мутаций гена RET, подразумевает хирургическое удаление щитовидной железы до развития в ней злокачественной опухоли! Тактика ведения носителей мутаций гена RET • С 1993 года стало возможным выявление наследуемых мутаций и проведение хирургического лечения до манифестации МРЩЖ, благодаря прямому генетическому анализу RET-протоонкогена • Большинство специалистов рекомендуют проводить операцию - тиреоидэктомию исходя от установленных уровней агрессивности МРЩЖ (типа герминальной мутации) • В случае семейного МРЩЖ вопрос об оперативном вмешательстве решается индивидуально Классификация наследственного МРЩЖ/МЭН2 по степени агрессивности клинического течения в зависимости от типа герминальной мутации (Seventh International workshop on MEN, NIH 2001) Уровень агрессивности МРЩЖ Уровень 3 Уровень 2 Уровень 1 Наивысшая агрессивность Высокая агрессивность Наименьшая агрессивность Кодон Рекомендуемые сроки для превентивной тиреоидэктомии 883, 918, 922 В течение 6 месяцев после рождения (предпочтительно в первый месяц жизни) 611, 618, 620, 634 До 5 летнего возраста, при мутации в 634 кодоне – лучше раньше 609, 768, 790, 791, 804, 891 Нет четких рекомендаций, предлагалось до 5 лет, до 10 лет или до выявления повышенного уровня ТКТ при стимуляции пентагастрином) Рекомендации по проведению профилактических тиреоидэктомий у носителей герминальных RET мутаций (Американская тиреоидологическая ассоциация (АТА), 2009) Риск агрессивности МРЩЖ (уровни ATA) Мутации в различных кодонах Сроки проведения профилактической ТЭ D (самый высокий) V804M+E805K, V804M+Y806C, Как можно скорее, в первый год V804M+S904C жизни A883F, M918T C634R/G/F/S/W/Y До 5 лет C609F/R/G/S/T До 5 летнего возраста, можно позже C611R/G/S/W/F/Y при условии* C618R/G/F/S/Y C620R/G/S/W/F/Y C630R/F/S/Y D631/Y 633/9 base pair duplication 634/12 base pair duplication V804M+V778I A R321G, 531/9 base pair Можно отсрочить после 5 лет при duplication, 532 duplication, условии* C515S, G533C, R600Q, K603E, Y606C, 635/insertion ELCR+ T636P, S649L, K666E, E768D, N777S, L790F, Y791F, V804L/M, G819K, R833C, R844Q, R866W, S891A, R912P *нормальный уровень базального и стимулированного ТКТ, нет изменений структуры ЩЖ при УЗИ, низкая пенетрантность и неагрессивное течение МРЩЖ у других членов семьи C B Международные рекомендации по проведению профилактических ТЭ European Society of Endocrine Surgeons (ESES), 2013 British Thyroid Association, 2014 European Thyroid Association, 2012 NCCN, 2015 Возраст Лимфодиссекция профилактической ТЭ Определение уровня кальцитонина (ТКТ) АТА-D – как можно раньше, до 1 года ATA-C – в 2-4 года ATA-B – до 6 лет ATA-A – до 10 лет АТА-D – до 6 мес ATA-C – до 5 лет В остальных случаях может быть отсрочена по критериям АТА При ТКТ выше порогового уровня Рекомендации АТА При повышении ТКТ выше 20 пг/мл, в некоторых случаях выше 31 пг/мл, 60 пг/мл, 90 пг/мл При повышении ТКТ >30-60 пг/мл При повышении ТКТ или РЭА Для принятия решения о лимфодиссекции и в случае отсроченной ТЭ При уровне АТА-D и ATA-C в случае повышения ТКТ >40 пг/мл и/или размера опухоли ЩЖ > при УЗИ Всем Российская ассоциация Рекомендации АТА эндокринологов Национальные клинические рекомендации по диагностике и лечению медуллярного рака щитовидной железы, 2015 АТА-D – у детей старше 1 При выборе отсроченной года ТЭ (в семье с При отсроченной ТЭ неагрессивным МРЩЖ) При повышении ТКТ Во всех случаях Всем, кроме маленьких детей (не установлен пороговый уровень) Пациенты, кому проведены профилактические ТЭ • НИИ ДОГ РОНЦ им. Н.Н. Блохина, в настоящее время, имеет наибольший в России опыт проведения профилактических тиреоидэктомий с риском МРЩЖ у детей (первая операция проведена 24.09.98) • С 1998 года по июнь 2015 года в НИИ ДОГ РОНЦ им. Н.Н. Блохина проведены профилактические тиреоидэктомии (ТЭ) 7 пациентам со 100 % риском развития МРЩЖ, как части синдрома МЭН 2А, после комплексного медико-генетического обследования и выявления мутации в гене RET • 7 детей были в возрасте от 2-х до 15 лет (3 мальчика и 4 девочки) Мутации у пациентов, кому проведены профилактические ТЭ • В 4 (57,1 %) из 7 случаев выявлена мутация р.С634R в 11 экзоне гена RET (встречается у российских пациентов более чем в 50% случаев с синдромом МЭН 2A, приводит к замене цистеинового аминокислотного остатка на аргинин), • В 1 (14,3,6%) случае - мутация р.C634G в 11 экзоне гена RET (мутация приводит к замещению цистеинового аминокислотного остатка в цистеин-обогащенном экстраклеточном домене RETбелка на глицин, мутация ассоциирует с синдромом МЭН 2А и редко встречается в российской популяции) • В 1 (14,3,6%) случае выявлена очень редкая герминальная компаунд-гетерозиготная мутация гена RET с.2556С<G, p.I852M в 14 экзоне (унаследована от мамы) и c.2372A<T, p.Y791F в 13 экзоне (унаследована от отца), • В 1 (14,3,6%) случае - мутация del632-636ins6 в 11 экзоне гена RET. Результаты профилактических ТЭ у пациентов с риском МЭН 2А • У 4 (57,1%) из 7 пациентов подтверждены доклинические стадии заболевания (участки с имитацией узлообразования и без признаков Склеточной гиперплазии – 1; дольчатая структура ткани ЩЖ, разделенная довольно «толстыми», прослойками соединительной ткани – 1; очаги гиперплазии С-клеток - 2) • В 3 (42,9%) случаях - выявлены уже манифестировавшие случаи! • У мальчика 15 лет, с мутацией р.C634G в 11 экзоне гена RET, выявлено по одному узлу МРЩЖ (10 мм. и 7 мм.) в обеих долях ЩЖ и очаги С-клеточной гиперплазии, у девочки 10 лет, с мутацией р.С634R в 11 экзоне гена RET, выявлена микрокарцинома 4 мм. в правой доле ЩЖ; у девочки 3-х лет, с мутацией р.С634R в 11 экзоне гена RET, обнаружена 4 мм. микрокарцинома в правой доле ЩЖ, диффузная (реактивная) гиперплазия и очаг нодулярной гиперплазии С-клеток. Нужно уточнить, что во всех 3-х случаях выявленного МРЩЖ - очаги рака были не более 1 см. в диаметре, отсутствовали признаки ангиолимфатической инвазии, опухоль не выходила за пределы капсулы ЩЖ. • Живы без признаков заболевания 6 детей, после профилактической ТЭ, проведенной при установленной гетерозиготной мутации в гене RET. Один больной выбыл из-под наблюдения, после 5 лет Рекомендации по результатам профилактических ТЭ у пациентов с риском МЭН 2А • Удаление ЩЖ, до развития МРЩЖ, выполненное в раннем детстве, на основании положительного результата генетического исследования, имеет лучший клинический исход, чем у пациентов после ТЭ, проведенной по поводу уже развившегося МРЩЖ. • Целесообразно выполнение ТЭ у детей с семейным анамнезом МЭН-2A, несущим герминальную RET мутацию, даже если в сыворотке уровень базального или стимулированного сывороточного кальцитонина нормальный. • Возраст проведения профилактической ТЭ зависит от агрессивности наследственного МРЩЖ (локализации мутации в определённом кодоне), что подтверждается нашими результатами – 3 (42,9%) случая манифестации заболевания из 7 Выводы по результатам лечения МРЩЖ и профилактических ТЭ у пациентов с риском МЭН • При МРЩЖ количество и величина узлов в ЩЖ не имеют статистически важного влияния на выживаемость • Необходима ранняя диагностика метастазов МРЩЖ и проведение адекватной первой операции, как на ЩЖ, так и лимфатическом коллекторе шеи • При МРЩЖ полная ремиссия не всегда достижима после повторного удаления шейных и/или средостенных метастазов, даже при отсутствии у больных отдаленных метастазов • Экстратиреоидное распространение опухоли, отдаленные метастазы предвещают неблагоприятный исход! Выводы по результатам лечения МРЩЖ и профилактических ТЭ у пациентов с риском МЭН • В случаях МРЩЖ долгосрочная выживаемость напрямую зависит от появления отдаленных метастазов, 90 % пациентов с диагностированными отдаленными метастазами погибают в течение 5 лет, а 60 % пациентов с метастазами в ЛУ проживают более 10 лет. После ГТЭ рецидивы возникают в 44 %, по сравнению с 10 % после ТЭ • Лечение МРЩЖ должно включать ТЭ, радикальную операцию на лимфатическом коллекторе шеи, ДЛТ - при нерадикальности операции • После проведенного лечения необходима заместительная гормональная терапия левотироксином, пожизненное наблюдение онкологом и эндокринологом с мониторингом уровня кальцитонина Благодарим за внимание Киназные ингибиторы для рака щитовидной железы : обзор клинического продвижения Завершены Болезнь Лекарство Sorafenib Фаза II Фаза III МРЩЖ ДРЩЖ МРЩЖ ДРЩЖ XL-184 МРЩ Pazopanib ДРЩЖ Motesanib МРЩЖ и ДРЩЖ Axitinib МРЩЖ и ДРЩЖ Sunitinib МРЩЖ и ДРЩЖ E7080 МРЩЖ и ДРЩЖ МРЩЖ, медуллярный РЩЖ; Набор продолжается Фаза I/II ДРЩЖ, дифференцированный РЩЖ ClinicalTrials.gov КАПРЕЛСА (Вандетаниб) Ингибитор протеинтирозинкиназы ПЕРВЫЙ И ЕДИНСТВЕННЫЙ ПРЕПАРАТ НА РЫНКЕ РФ ДЛЯ ТЕРАПИИ МРЩЖ НЕТ АЛЬТЕРНАТИВНЫХ МЕТОДОВ ЛЕЧЕНИЯ НЕТ АНАЛОГОВ КАПРЕЛСА® ВВЕЗЕНА В РОССИЮ •ПОКАЗАНИЕ: Нерезектабельный местно-распространенный и метастатический медуллярный рак щитовидной железы •ФОРМА ВЫПУСКА: таблетки 100 мг и 300 мг (№30) •СУТОЧНАЯ ДОЗИРОВКА: 300 мг •СРЕДНЯЯ ПРОДОЛЖИТЕЛЬНОСТЬ ЛЕЧЕНИЯ: •22 месяца согласно регистрационного исследования 1. Инструкция по медицинскому применению препарата Капрелса® (таблетки, покрытые пленочной оболочкой 100/300мг), регистрационный номер ЛП-002238, дата регистрации 19.09.2013 2. Wells SA, Jr. et al. J Clin Oncol 2012;30:134–141