Расчеты по уравнению химической реакции Сколько меди
advertisement
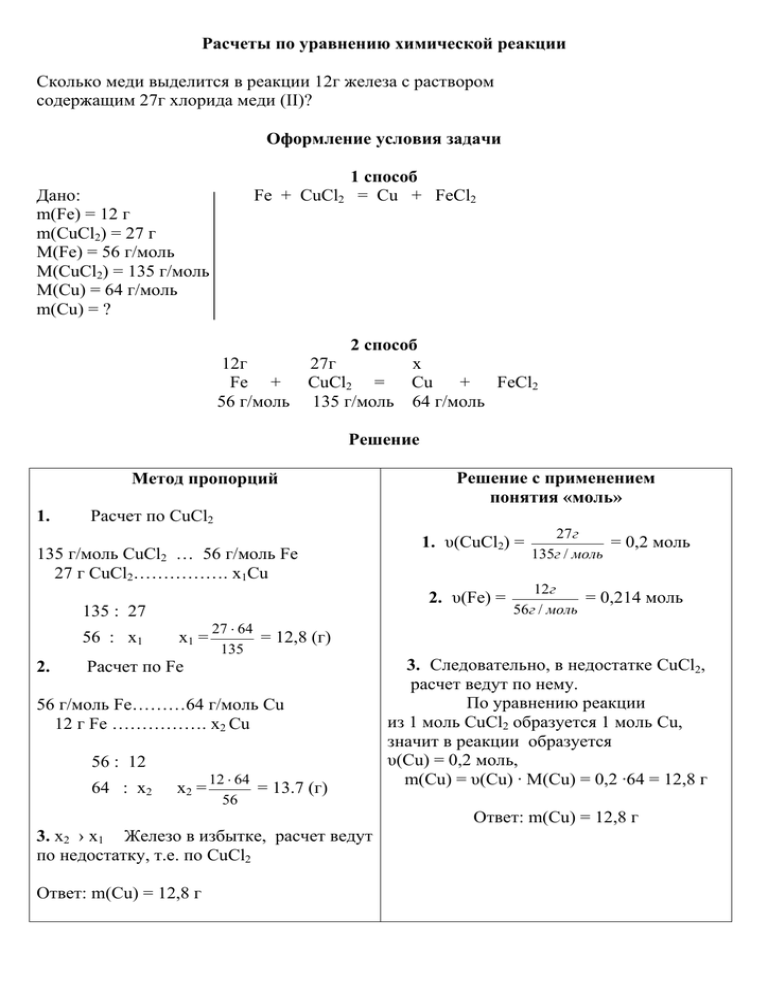
Расчеты по уравнению химической реакции Сколько меди выделится в реакции 12г железа с раствором содержащим 27г хлорида меди (II)? Оформление условия задачи 1 способ Fe + CuCl2 = Cu + FeCl2 Дано: m(Fe) = 12 г m(CuCl2) = 27 г M(Fe) = 56 г/моль М(CuCl2) = 135 г/моль M(Cu) = 64 г/моль m(Cu) = ? 12г Fe + 56 г/моль 2 способ 27г х CuCl2 = Cu + FeCl2 135 г/моль 64 г/моль Решение Метод пропорций 1. Расчет по CuCl2 135 г/моль CuCl2 … 56 г/моль Fe 27 г CuCl2……………. x1Cu 56 : х1 х1 = 27 ⋅ 64 = 12,8 (г) 135 Расчет по Fe 56 г/моль Fe………64 г/моль Cu 12 г Fe ……………. x2 Cu 56 : 12 64 : x2 1. υ(CuCl2) = 2. υ(Fe) = 135 : 27 2. Решение с применением понятия «моль» x2 = 12 ⋅ 64 = 13.7 (г) 56 27 г = 0,2 моль 135г / моль 12 г = 0,214 моль 56г / моль 3. Следовательно, в недостатке CuCl2, расчет ведут по нему. По уравнению реакции из 1 моль CuCl2 образуется 1 моль Cu, значит в реакции образуется υ(Cu) = 0,2 моль, m(Cu) = υ(Cu) · M(Cu) = 0,2 ·64 = 12,8 г Ответ: m(Cu) = 12,8 г 3. x2 › х1 Железо в избытке, расчет ведут по недостатку, т.е. по CuCl2 Ответ: m(Cu) = 12,8 г

