11 класс Тема «Основания» Литература: О.С. Габриелян. Химия
advertisement
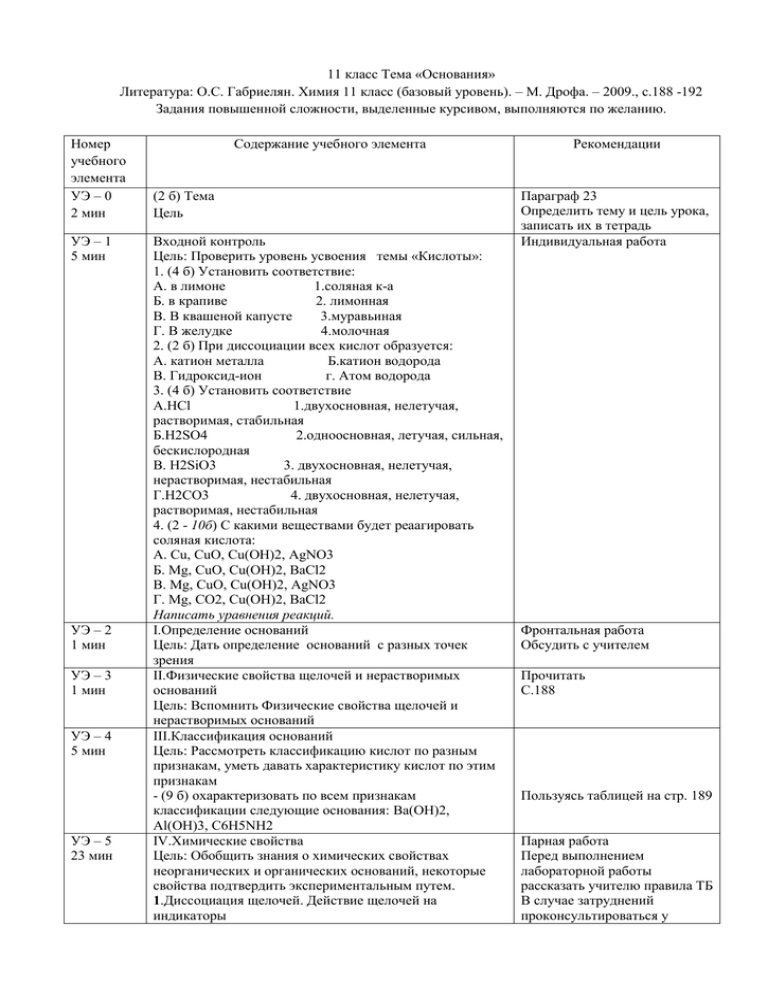
11 класс Тема «Основания» Литература: О.С. Габриелян. Химия 11 класс (базовый уровень). – М. Дрофа. – 2009., с.188 -192 Задания повышенной сложности, выделенные курсивом, выполняются по желанию. Номер учебного элемента УЭ – 0 2 мин УЭ – 1 5 мин УЭ – 2 1 мин УЭ – 3 1 мин УЭ – 4 5 мин УЭ – 5 23 мин Содержание учебного элемента (2 б) Тема Цель Входной контроль Цель: Проверить уровень усвоения темы «Кислоты»: 1. (4 б) Установить соответствие: А. в лимоне 1.соляная к-а Б. в крапиве 2. лимонная В. В квашеной капусте 3.муравьиная Г. В желудке 4.молочная 2. (2 б) При диссоциации всех кислот образуется: А. катион металла Б.катион водорода В. Гидроксид-ион г. Атом водорода 3. (4 б) Установить соответствие А.HCl 1.двухосновная, нелетучая, растворимая, стабильная Б.H2SO4 2.одноосновная, летучая, сильная, бескислородная В. H2SiO3 3. двухосновная, нелетучая, нерастворимая, нестабильная Г.H2CO3 4. двухосновная, нелетучая, растворимая, нестабильная 4. (2 - 10б) С какими веществами будет реаагировать соляная кислота: А. Cu, CuO, Cu(OH)2, AgNO3 Б. Mg, CuO, Cu(OH)2, BaCl2 B. Mg, CuO, Cu(OH)2, AgNO3 Г. Mg, CO2, Cu(OH)2, BaCl2 Написать уравнения реакций. I.Определение оснований Цель: Дать определение оснований с разных точек зрения II.Физические свойства щелочей и нерастворимых оснований Цель: Вспомнить Физические свойства щелочей и нерастворимых оснований III.Классификация оснований Цель: Рассмотреть классификацию кислот по разным признакам, уметь давать характеристику кислот по этим признакам - (9 б) охарактеризовать по всем признакам классификации следующие основания: Ba(OH)2, Al(OH)3, C6H5NH2 IV.Химические свойства Цель: Обобщить знания о химических свойствах неорганических и органических оснований, некоторые свойства подтвердить экспериментальным путем. 1.Диссоциация щелочей. Действие щелочей на индикаторы Рекомендации Параграф 23 Определить тему и цель урока, записать их в тетрадь Индивидуальная работа Фронтальная работа Обсудить с учителем Прочитать С.188 Пользуясь таблицей на стр. 189 Парная работа Перед выполнением лабораторной работы рассказать учителю правила ТБ В случае затруднений проконсультироваться у УЭ – 6 5 мин - (3 б) записать уравнение диссоциации (распад на ионы) щелочи: Fe(OH)3, Sr(OH)2, CuOH - (3 б) Л.Р. (соблюдать осторожность при работе со щелочами) проверить действие трех индикаторов (фенолфталеин, метилоранж, лакмус) на щелочи на примере гидроксида натрия 2. Взаимодействие с кислотами -(3 б) Записать реакцию в молекулярном и ионном видах между гдроксидом цинка и соляной кислотой - (2 б) Записать реакцию в молекулярном виде между фениламином и уксусной кислотой 3.Взаимодействие с оксидами неметаллов - Л.Р. (соблюдать осторожность при работе с кислотами) 1). (1 б) Получить углекислый газ: в пробирку с мелом прилить серную кислоту, пробирку закрыть пробкой с газоотводной трубкой, 2). (1 б) газоотводную трубку опустить в известковую воду (гидроксид кальция), что наблюдали? - (2 б) записать уравнение реакции в молекулярном виде между углекислым газом и известковой водой. 4. Взаимодействие с солями - (2 б) Для каких оснований характерна эта реакция? Что должно образовываться в этих реакциях? - Л.Р. (соблюдать осторожность при работе со щелочами) -(3-4 б) провести реакцию между медным купоросом и щелочью, записать уравнение реакции в молекулярном и ионном видах -(3 -4 б) провести реакцию между хлоридом аммоний и щелочью, с помощью влажной лакмусовой бумажки проверить наличие образующегося аммиака, записать уравнение реакции в молекулярном и ионном видах 5.Разложение при нагревании -(1 б) Для каких оснований характерна эта реакция? - Л.Р. (соблюдать осторожность при работе со спиртовкой) 1). (1 б) Получить гидроксид меди(II) с помощью имеющихся реактивов 2). (3 б) Провести реакцию разложения гидроксид меди(II) в (пробирку прогреть, направить отверстие в сторону от товарищей). Записать уравнение реакции. Выходной контроль Цель: проверить уровень усвоения знаний по теме «Основания» 1. (2 б) Выбрать щелочь: А.Cu(OH)2 Б. Al(OH)3 B. CsOH Г.Zn(OH)2 2. (2 б) Выбрать слабый электролит: А. Гидроксид натрия Б. Гидроксид лития В. Гидроксид аммония Г. Гидроксид калия 3. (2 б) Все основания реагируют с: А.солями Б.оксидами неметаллов В. Оксидами металлов Г.кислотами учителя С.188 С.190 С.190 С.191 рис. 136 Индивидуальная работа УЭ – 7 2 мин 4. (2б) Органическими основаниями являются: А.спирты Б. амины В.эфиры Г. жиры 5. (2 - 10 б) С группой каких веществ будет реагировать гидроксид натрия: А.HCl, CaO, FeCl3, HCOOH Б. HCl, CO, FeCl3, HCOOH B. HCl, CaO, KCl, HCOOH Г. HCl, CO2, FeCl3, HCOOH Записать уравнения реакций Цель: осуществить самооценку работы на уроке Проверьте правильность выполнения вашей работы по контрольному листу. Сосчитайте общее количество баллов и поставьте оценку 26 – 51 баллов – «3» 52 - 68 баллов –«4» 69 -79 баллов – «5» Спасибо за работу! Контрольный лист Тема «Основаня» УЭ – 1 5 мин УЭ – 4 5 мин УЭ – 5 23 мин Входной контроль 1. (4 б) Установить соответствие: А. 2 Б. 3 В. 4 Г. 1 2. (2 б) При диссоциации всех кислот образуется: Б.катион водорода 3. (4 б) Установить соответствие А.2 Б.1 В. 3 Г. 4. (2 - 10б) С какими веществами будет реаагировать соляная кислота: B. Mg, CuO, Cu(OH)2, AgNO3 2HCl + Mg = MgCl2 + H2 HCl + CuO = CuCl2 + H2O 2HCl +Cu(OH)2 = CuCl2 + 2H2O HCl + AgNO3 = AgCl + HNO3 III.Классификация оснований - (9 б) охарактеризовать по всем признакам классификации следующие основания: Ba(OH)2 – кислородсодержащее, двухкислотное, растворимое, сильное, нелетучее, стабильное; Al(OH)3 - кислородсодержащее, трехкислотное, нерастворимое, слабое, нелетучее, стабильное; C6H5NH2 - бескислородное, однокислотное, растворимое, слабое, летучее, стабильное; IV.Химические свойства 1.Диссоциация щелочей. Действие щелочей на индикаторы - (3 б) записать уравнение диссоциации (распад на ионы) щелочи: Fe(OH)3 =, Sr(OH)2 = Sr2+ 2ОНCuOH = - (3 б) фенолфталеин - малиновый, метилоранж – желтый, лакмус – синий 2. Взаимодействие с кислотами -(3 б) Zn(OH)2 +2 HCl = ZnCl2 + 2H2O - (2 б) C6H5NH2 + CH3COOH = [C6H5NH3]+CH3COO3.Взаимодействие с оксидами неметаллов - (2 б) CO2 + Ca(OH)2 = CaCO3 + H2O 4. Взаимодействие с солями - (2 б) Для щелочей; должен образовываться осадок или газ. -(3-4 б) CuSO4 + 2KOH = Cu(OH)2 + K2SO4 УЭ – 6 5 мин Cu2+ +2OH- = Cu(OH)2 -(3 -4 б) NH4Cl + NaOH = NaCl + H2O + NH3 NH4+ + OH- = H2O + NH3 5.Разложение при нагревании -(1 б) для нерастворимых 2). (3 б) Cu(OH)2 = CuO + H2O Выходной контроль Цель: проверить уровень усвоения знаний по теме «Основания» 1. (2 б) Выбрать щелочь: B. CsOH 2. (2 б) Выбрать слабый электролит: В. Гидроксид аммония 3. (2 б) Все основания реагируют с: Г.кислотами 4. (2б) Органическими основаниями являются: Б. амины 5. (2 - 10 б) С группой каких веществ будет реагировать гидроксид натрия: Г. HCl, CO2, FeCl3, HCOOH NaOH + HCl = NaCl + H2O 2NaOH + CO2 = Na2CO3 + H2O 3NaOH + FeCl3 = 3NaCl + Fe(OH)3 NaOH + HCOOH = COONa + H2O
