Школьный этап Всероссийской олимпиады школьников по химии 2013-2014 учебный год 11 КЛАСС
advertisement

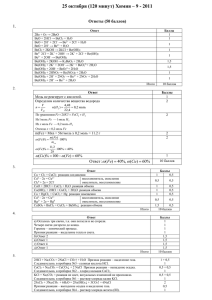
Школьный этап Всероссийской олимпиады школьников по химии 2013-2014 учебный год 11 КЛАСС Максимальный балл - 36 1. Вам предложены задания с выбором ответа (в каждом задании только один ответ правильный). Выберите верный ответ (10 баллов). 1. В схеме превращений Na2CO3 MgCO3 Mg(HCO3)2 буквами «Х» и «Y» обозначены вещества: 1) X – MgO; Y – HCl 2) X – Mg(OH)2; Y – NaCl 3) X – MgF2; Y – CO2 и H2O 4) X – MgCl2; Y – CO2 и H2O 2. При обычных условиях с наибольшей скоростью протекает реакция: 1) 2Cu + O2 = 2CuO 3) Fe + 2HCl = FeCl2+ H2 2) BaCl2+ Na2CO3 = BaCO3↓ + 2NaCl 4) Cu + S = CuS 3. Согласно уравнению OH- + H+ = H2O возможно химическое взаимодействие между веществами 1) Cu(OH)2 + 2HCl = CuCl2 + 2H2O 2) Ba(OH)2 + H2SO4 = BaSO4 + 2H2O 3) 2KOH + H2SiO3 = K2SiO3 + 2H2O 4) Ba(OH)2 + 2HCl = BaCl2 + 2H2O 4. Гомологом бензола является вещество, молекулярная формула которого: 1) С8Н10 2) С8Н18 3) С8Н16 4) С8Н14 5. К 200г 20%-ного раствора нитрата натрия добавили 10г этой же соли. Рассчитайте массовую долю нитрата натрия в полученном растворе. Ответ: Запишите число с точностью до целых в %. 1) 25; 2) 15; 3) 24; 4) 60. 6. Химическое равновесие в системе: Fe3O4 (тв ) + 4CO(г) ⇄ 3Fe (тв ) +4 CO2(г) _ Q смещается в сторону исходных веществ при: 1) повышении давления; 2) понижении температуры; 3) повышении температуры; 4) понижении давления. 7. В результате реакции, термохимическое уравнение которой 2SO2 + O2 = 2SO3 +198 кДж выделилось 79,2 кДж тепла. Объём (н.у.), израсходованного при этом кислорода равен: 1) 4,48 л 2) 6,72 л 3) 8,96 л 4) 13,44 л 8. Реакция «серебряного зеркала» характерна для: 1) уксусной кислоты 2) метановой кислоты 3) формальдегида 4) фенола 5) этилацетата 9. К реакциям присоединения и замещения относятся соответственно 1) CH3COOH + NaOH → и CuO + HCl 2) CH3COONa + NaOH и C6H5OH + Na→ 3) KBr + Cl2 → и Fe + CuCl2 4) СН2 ═ СН2 + H2 и Zn + HCl → 10.Используя метод электронного баланса, составьте уравнение реакции: Сумма коэффициентов при формулах продуктов реакции равна: 1) 14; 2) 27; 3) 9; 4) 15. 2. Решите задачу. (5 баллов). Какую массу угля потребуется сжечь, чтобы получить количество теплоты такое же, как при взаимодействии 1 т сернистого газа с сероводородом, если тепловой эффект горения угля составляет 393,3 кДж, а тепловой эффект второй реакции равен 234,5 кДж. 3. Решите задачу. (5 баллов). В колбочку наливают 20 - 30 мл дистиллированной воды, добавляют несколько капель концентрированного раствора аммиака и 3 - 4 капли раствора фенолфталеина. Как изменится окраска в растворе при охлаждении, нагревании, добавлении кристаллов хлорида аммония? Процесс электролитической диссоциации гидрата аммиака экзотермический. 4. Решите задачу. (5 баллов). Как считали самые знаменитые химики начала XIX в., органические вещества нельзя получать из неорганических. Опровергните это мнение, написав уравнения реакций, с помощью которых можно получить уксусную кислоту из мрамора. Укажите условия осуществления каждой реакции. 5. Решите задачу. (11 баллов). Продуктами горения газообразного органического вещества А являются вещества Б и В. При растворении вещества Б в веществе В образуется минеральная кислота. Вещество В при определенных условиях может взаимодействовать с веществом А. Продукт этой реакции – вещество Г не взаимодействует с едким натром, но взаимодействует с металлическим натрием. Одним из продуктов в последней реакции будет газ Д без цвета и запаха, способный вступать в реакцию с веществом А с образованием газообразного углеводорода Е, не обесцвечивающего бромную воду и перманганат калия, а в молекуле его содержится два атома углерода. Напишите соответствующие уравнения реакций. Назовите вещества А, Б, В, Г, Д, Е.