Определение показателя адиабаты методом Клемана и Дезорма
advertisement

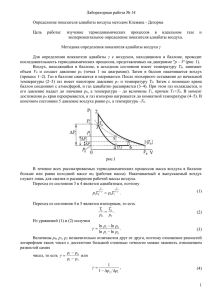
ЛАБОРАТОРНАЯ РАБОТА 13 ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ АДИАБАТЫ МЕТОДОМ КЛЕМАНА И ДЕЗОРМА Выполнил студент гр. _____________ Проверил ________________________ Ф.И.О _________________ дата ___________________ Цель работы: определить показатель адиабаты и сравнить его величину с теоретическим значением. Порядок выполнения работы 1. Установить пробку крана К так, чтобы баллон Б, который находится под столом, сообщался с насосом Н (в положение I на рис. 1). 2. Осторожно накачать воздух в баллон. Когда разность уровней жидкости в коленах манометра достигнет 10 15 см, прекратить накачивание и повернуть пробку крана К в положение II, чтобы сосуд не сообщался с атмосферой. Пробка крана должна плотно прилегать к его стенкам и не давать утечки воздуха. Рис. 1 Не забывайте об этом до конца эксперимента. 3. Через некоторое время, когда давление окончательно установится и разность уровней в манометре перестанет уменьшаться, измерить h1 - разность уровней в левом и правом коленах манометра. 4. Повернуть пробку крана, давая воздуху в сосуде расшириться наружу. Разность уровней жидкостей в манометре резко уменьшится двумя, следующими друг за другом скачками. Как только при втором скачке уровни жидкостей станут одинаковыми, (h=0) пробку следует немедленно и плотно повернуть в кране К в положение II, закрывая баллон. 5. После того, как баллон будет закрыт пробкой, уровни жидкости в манометре снова начнут расходиться. Следует подождать, когда давление окончательно установится и разность уровней в манометре перестанет увеличиваться. Затем записать установившуюся разность уровней h2 воды в обоих коленах манометра. 6. Опыт повторить не менее N = 9 раз для разных значений начальной величины h1 , h1 лежащих в пределах 10 15 см. Для каждого опыта вычислить i по формуле ,а h1 h2 затем определить среднее значение показателя адиабаты . Все измеренные и вычисленные величины заносить в таблицу 1. Таблица 1 h1 , см h2 , см = теор = 7. Определить погрешность полученного значения показателя адиабаты 1 2 ( i ) , где n 9 – число опытов n n 1 8. Записать ответ в виде ; ............... ............... i2 8. По формуле теор вычислить теоретическое значение показателя адиабаты, i считая для водуха i =5, и сравнить полученный результат с . Контрольные вопросы 1. Сформулируйте I-е начало термодинамики и запишите его для идеального газа. 2. Какой газ можно считать идеальным? От каких термодинамических параметров зависит внутренняя энергия идеального газа и что она описывает? 3. Какие величины входят в уравнение состояния идеального газа? Каков его вид? 4. Дайте определение теплоемкости. Чем она отличается от молярной и от удельной теплоемкостей? Почему для разных процессов величина теплоемкости одной и той же система различна? Какие величины связывает уравнение Майера и как его получить? 5. Какой процесс называется адиабатическим? политропическим? Докажите, что изобарический, изотермический и изохорический процессы являются политропическими. Как на практике осуществить адиабатический процесс с газом? 6. Выведите уравнение Пуассона для адиабатического процесса. Что такое показатель адиабаты? 7. Идеальный газ расширяется (сжимается) адиабатически (изобарически, изотермически). Что при этом происходит с давлением, объемом, температурой и внутренней энергией газа? Они увеличиваются, уменьшаются или не изменяются? Нарисуйте примерные графики этих процессов на диаграммах а) Т - р; б) Т - V; в) р - V. 8. Запишите выражение внутренней энергии, теплоемкостей CP , CV и показателя адиабаты в молекулярно- кинетической теории. Как они зависят от числа степеней свободы i молекул газа? 9. Какие процессы с воздухом в баллоне Б на рис.3- 2 происходят при выполнении работы: а) при накачивании воздуха? б) при открывании крана К? в) при его последующем закрывании? Почему именно эти процессы? 10. Выведите уравнение для определения показателя адиабаты . 11. Молярные теплоемкости азота в процессах 1 2 и 1 3 равны C 1 и C 2 соответственно. Их отношение C 1 C 2 равно: а) 3 в) 5 г) 7 3 7 5 12. Средняя кинетическая энергия молекул газа при температуре Т зависит от их конфигурации и структуры, что связано с возможностью различных видов движения атомов в молекуле и самой молекулы. При условии, что имеет место только поступательное и вращательное движение молекулы как целого, средняя кинетическая 3 1 5 7 энергия молекулы азота N2 равна ... а) kT б) kT в) kT г) kT 2 2 2 2 13. Если не учитывать колебательные движения в линейной трехатомной "молекуле" газа (см.рис.), то отношение кинетической энергии вращательного движения к полной 3 3 2 2 кинетической энергии молекулы равно ...а) б) в) г) 6 5 5 13 14. Молярная теплоемкость идеального газа при постоянном давлении равна 9 C p R , где R 8,31 Дж/(кгмоль) – универсальная газовая постоянная. Число 2 вращательных степеней свободы молекулы равно .. а) 9 б) 1 в) 2 г) 3 5 б) 5 Литература 1. Савельев И.В., Курс общей физики,1973, гл. XI, §94 - 98. 2. Колмаков Ю.Н., Пекар Ю.А., Лежнева Л.С., Термодинамика и молекулярная физика, 1999, гл. I, § 4 -9.