Document 978973
advertisement

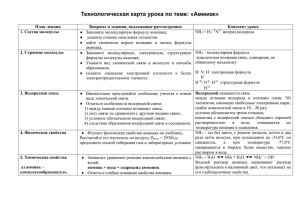
ыводы, Тема урока. Аммиак. Аммиачная вода (Парная лабораторная работа) Цель урока: получить аммиак и изучить его свойства, познакомиться с практическим значением этого вещества. Задание 1. Напишите молекулярную, электронную и структурную формулы аммиака. Укажите вид химической связи в молекуле этого вещества. Задание 2. Получите аммиак. Изучите его свойства. С этой целью начните выполнять практическую работу № 3 (с. 74 учебника): опыты 1 и 2. Внимание! Как только почувствуете резкий запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой и пока прекратите опыт. Почему аммиак собирают в сухую пробирку, расположенную отверстием вниз? По результатам наблюдений запишите физические свойства аммиака. (Консультация на с. 50.) Задание 3. Исследуйте взаимодействие аммиака с водой. (На этом уроке я демонстрирую учащимся опыт «Фонтан», иллюстрирующий большую растворимость аммиака в воде.). Для этого продолжайте выполнять опыт 2 и проделайте опыт 3. Ответьте на вопросы: 1. Что образуется при растворении аммиака в воде? (Консультация на с. 51.) 2. Водный раствор аммиака изменяет окраску фенолфталеина на малиновую. Какие свойства проявляет аммиачная вода? (Консультация на с. 52.) Запишите в тетрадь уравнение реакции аммиака с водой: Н H:N:H + Н:0: - [H:N:H]+ + OHH H H . ион аммония ИЛИ NH3 + H2O - NH4+ + OHЗапишите, какие еще названия имеет аммиачная вода. (Консультация на с. 52.) Задание 4. Исследуйте взаимодействие аммиака с кислотами. Подогрейте немного смесь для получения аммиака. Смочите стеклянную палочку концентрированной соляной кислотой и поднесите ее к отверстию газоотводной трубки. Что наблюдаете? Закончите уравнение химической реакции; назовите продукт реакции: NH3 + HCl > (Консультация на с, 52, табл. 15.) Закрепление. Закончите уравнения химических реакций, дайте названия продуктам реакций: а) NH3 + HNO3 >; б) NH3 + H2SO4 > ; в) NH3 + H2SO4 > ; избыток г) NH3 + H3PO4> ; Проверьте результаты работы друг у друга. Исправьте ошибки. Задание 5. Запишите в тетрадь уравнения реакций окисления аммиака. Укажите условия их осуществления. Коэффициенты расставьте методом электронного баланса. (Консультация на с. 52.) Задание 6. Запишите уравнение реакции получения аммиака в лаборатории. (Консультация на с. 50.) Задание 7. Познакомьтесь с применением аммиака. Запишите, где применяется аммиак и его водный раствор. Задание на дом: § 19. Знать формулы аммиака и иона аммония, состав аммиачной воды и свойства аммиака. Хочу заметить, что, предлагая учащимся домашнее задание, всегда обращаю их внимание на тот материал, который они должны особенно хорошо выучить. Обычно при проведении подобных работ у нас в конце урока остается немного времени для краткого повторения изученного. На уроках повторения и обобщения знаний учащиеся неоднократно воспроизводят материал: записывают формулы веществ, уравнения реакций и т.д. Поэтому я редко даю письменное домашнее задание, стараюсь все отработать на уроках. с заданиями к параграфам учебника и выясняют, могут ли они самостоятельно дописать необходимые уравнения реакций (в приведенной схеме конспекта оставлены для этого места, которые обозначены многоточием), приводят примеры, поясняющие особые свойства серной кислоты