Простые и сложные вещества простые вещества из атомов одного элемента.
advertisement

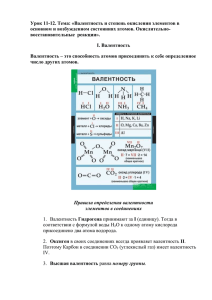
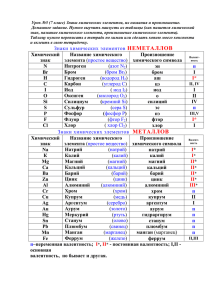
Простые и сложные вещества простые вещества — это вещества, образованные из атомов одного элемента. Например, железо — Fe, азот - N2, ртуть — Hg. При написании формул таких простых веществ есть одно маленькое секретное правило: если простое вещество — газ, то его молекула двухатомная: N2, H2, O2, Cl2 (кроме брома и йода — эти вещества твердые) если простое вещество твердое или жидкое, то его молекулу записываем в виде одного элемента: С, Fe, Pt, S, Ca и т.д. Сложные вещества или химические соединения, — это вещества, образованные атомами разных элементов. Самый простой пример — H2O — водичка В сложных веществах сразу встает проблема как правильно писать эти формулы…. Давайте разберем! Есть 2 понятия, которые надо знать и уметь отличать друг от друга валентность и степень окисления Валентность элемента — это количество связей, которые может образовывать атом. У атома может быть несколько валентностей. У металлов (1-я, 2-я и 3-я группы) валентность = номеру группы. Например, Al — в третьей группе, значит, его валентность = 3 У неметаллов : максимальная валентность элемента = номеру группы, промежуточные = № группы-2 минимальная = 8-№группы Берем S — она находится в 6-й группе периодической системы. Следовательно, максимальная валентность элемента = номеру группы = 6 (H2SO4) промежуточные валентности: 4 (H2SO3) минимальная валентность = 8-№группы = 2 (H2S) Валентность = количество связей, и вот как это выглядит структурно: цифры — валентность каждого атома Степень окисления элемента – - это условный заряд атома в соединении По сути — это тоже число, но со знаком «+» или «-». Например, в соединении H2S — водород Н будет положительно заряженным ионом, степень окисления=+1, S — отрицательно со степенью окисления элемента= -2: +1 -2 H2S Кстати, ион — заряженная частица, образующаяся в результате потери или присоединения атомом или молекулой одного или нескольких электронов.