Обобщение и систематизация знаний учащихся
advertisement
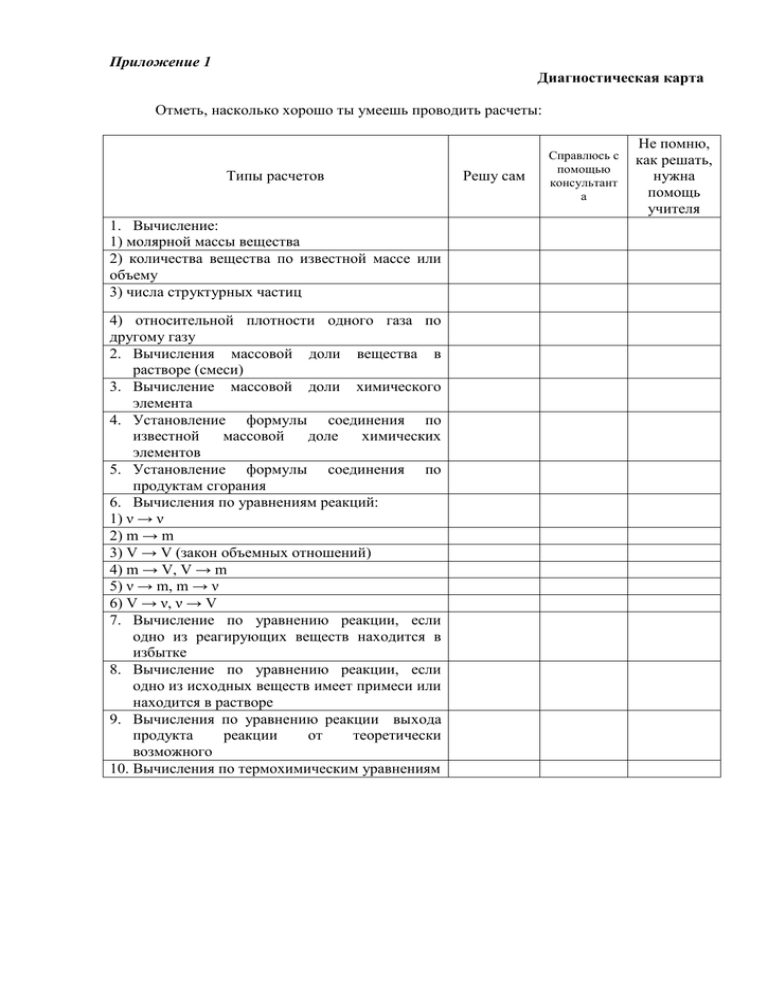
Приложение 1 Диагностическая карта Отметь, насколько хорошо ты умеешь проводить расчеты: Типы расчетов 1. Вычисление: 1) молярной массы вещества 2) количества вещества по известной массе или объему 3) числа структурных частиц 4) относительной плотности одного газа по другому газу 2. Вычисления массовой доли вещества в растворе (смеси) 3. Вычисление массовой доли химического элемента 4. Установление формулы соединения по известной массовой доле химических элементов 5. Установление формулы соединения по продуктам сгорания 6. Вычисления по уравнениям реакций: 1) ν → ν 2) m → m 3) V → V (закон объемных отношений) 4) m → V, V → m 5) ν → m, m → ν 6) V → ν, ν → V 7. Вычисление по уравнению реакции, если одно из реагирующих веществ находится в избытке 8. Вычисление по уравнению реакции, если одно из исходных веществ имеет примеси или находится в растворе 9. Вычисления по уравнению реакции выхода продукта реакции от теоретически возможного 10. Вычисления по термохимическим уравнениям Решу сам Справлюсь с помощью консультант а Не помню, как решать, нужна помощь учителя Вариант 1 ЗАДАЧИ 1. а) Определите молярную массу глюкозы C6H12O6 б) Рассчитайте количество вещества и объем (н.у.) 2,2 г оксида углерода (IV) в) Определите массу и число молекул в образце воды количеством вещества 3,5 моль. г) Рассчитайте относительную плотность оксида серы (IV) по воздуху 2. Рассчитайте массу воды, в которой нужно растворить 25 г сахара, для приготовления 10 % раствора сахара. 3. Определите массовую долю каждого химического элемента в карбонате кальция. 4. Анализ образца некоторого органического вещества показал, что массовая доля углерода в нем – 81,81 %, а водорода – 18,19 %. Относительная плотность этого вещества по водороду равна 22. Определить молекулярную формулу этого вещества. 5. При сжигании 2,8 г газообразного вещества было получено 8,8 г оксида углерода (IV) и 3,6 г воды. Плотность газа по водороду равна 14. Определите молекулярную формулу газообразного вещества. 6. 1) Какое количество вещества хлорида калия образуется при взаимодействии гидроксида калия с соляной кислотой, содержащей 0,2 моль хлороводорода? 2) Сколько г соли образуется при взаимодействии 9,8 г серной кислоты с оксидом меди (II)? 3) Сколько л кислорода расходуется на сгорание 1,5 м3 этилена? 4) Рассчитайте, какой объем водорода образуется при взаимодействии 27 г алюминия с соляной кислотой 5) Вычислите массу циклогексана, полученного в процессе гидрирования 5 моль бензола 6) Вычислите объем водорода (н.у.), выделившегося при действии избытка соляной кислоты на 1,5 моль магния 7. Вычислите массу спирта, образовавшегося при взаимодействии 5,6 л (н.у.) этилена и 5,4 г воды. 8. 1) Сколько г сульфата натрия образуется при взаимодействии 200 г раствора серной кислоты, массовая доля которой в растворе составляет 24,5 %, с избытком раствора гидроксида натрия? 2) Сколько л (н.у.) ацетилена можно получить при действии избытка воды на 40 г технического карбида кальция, содержащего 5 % примесей? 9. Из 92 г этанола получили 33,6 л (н.у.) этилена. Вычислите выход продукта реакции в процентах от теоретически возможного. 10. Используя термохимическое уравнение реакции CH4 + 2O2 = CO2 + 2H2O + 803 кДж рассчитайте, какое количество теплоты выделится при сгорании 11,2 м3 метана.














