Планирование по химии 7 класс Филимонова С.А.
advertisement
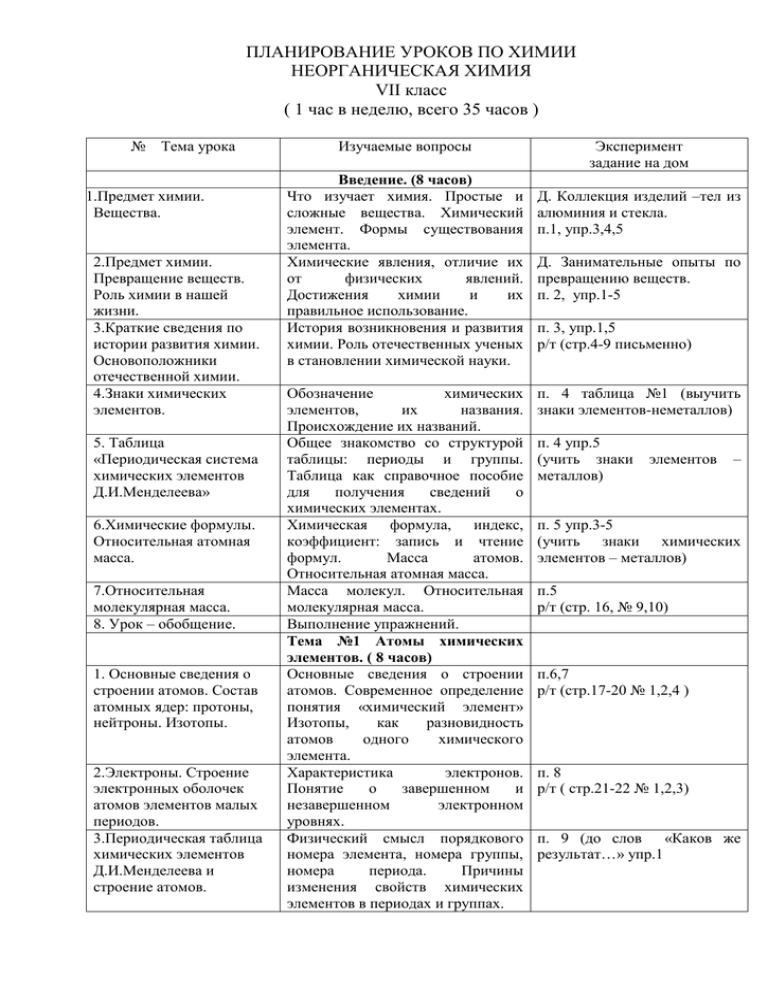
ПЛАНИРОВАНИЕ УРОКОВ ПО ХИМИИ НЕОРГАНИЧЕСКАЯ ХИМИЯ VII класс ( 1 час в неделю, всего 35 часов ) № Тема урока 1. 1.Предмет химии. Вещества. 2.Предмет химии. Превращение веществ. Роль химии в нашей жизни. 3.Краткие сведения по истории развития химии. Основоположники отечественной химии. 4.Знаки химических элементов. 5. Таблица «Периодическая система химических элементов Д.И.Менделеева» 6.Химические формулы. Относительная атомная масса. 7.Относительная молекулярная масса. 8. Урок – обобщение. 1. Основные сведения о строении атомов. Состав атомных ядер: протоны, нейтроны. Изотопы. 2.Электроны. Строение электронных оболочек атомов элементов малых периодов. 3.Периодическая таблица химических элементов Д.И.Менделеева и строение атомов. Изучаемые вопросы Введение. (8 часов) Что изучает химия. Простые и сложные вещества. Химический элемент. Формы существования элемента. Химические явления, отличие их от физических явлений. Достижения химии и их правильное использование. История возникновения и развития химии. Роль отечественных ученых в становлении химической науки. Обозначение химических элементов, их названия. Происхождение их названий. Общее знакомство со структурой таблицы: периоды и группы. Таблица как справочное пособие для получения сведений о химических элементах. Химическая формула, индекс, коэффициент: запись и чтение формул. Масса атомов. Относительная атомная масса. Масса молекул. Относительная молекулярная масса. Выполнение упражнений. Тема №1 Атомы химических элементов. ( 8 часов) Основные сведения о строении атомов. Современное определение понятия «химический элемент» Изотопы, как разновидность атомов одного химического элемента. Характеристика электронов. Понятие о завершенном и незавершенном электронном уровнях. Физический смысл порядкового номера элемента, номера группы, номера периода. Причины изменения свойств химических элементов в периодах и группах. Эксперимент задание на дом Д. Коллекция изделий –тел из алюминия и стекла. п.1, упр.3,4,5 Д. Занимательные опыты по превращению веществ. п. 2, упр.1-5 п. 3, упр.1,5 р/т (стр.4-9 письменно) п. 4 таблица №1 (выучить знаки элементов-неметаллов) п. 4 упр.5 (учить знаки металлов) элементов – п. 5 упр.3-5 (учить знаки химических элементов – металлов) п.5 р/т (стр. 16, № 9,10) п.6,7 р/т (стр.17-20 № 1,2,4 ) п. 8 р/т ( стр.21-22 № 1,2,3) п. 9 (до слов «Каков же результат…» упр.1 4. Ионная химическая связь. Металлическая связь. 5.Ковалентная неполярная химическая связь 6. Ковалентная полярная химическая связь. Понятие «ион». Понятие об ионной связи. Схемы образования ионных соединений. Понятие о металлической связи. Схема образования двухатомных молекул (H2,CI2,N2). Электронные и структурные формулы. Кратность химической связи. Схемы образования молекул соединений (НСI, H2O, NH3). Электронные и структурные формулы. Понятие об электроотрицательности и ковалентной полярной связи. п.9 (до конца) упр.2;п.12 р/т (стр.25-26) п. 10 р/т (стр.28-29) п. 11 р/т (стр.30-33) 7.Обобщающий урокВыполнение упражнений. повторение. Подготовка к контрольной работе. 8. Контрольная работа. №1 Тема 2. Простые вещества и соединения химических элементов. (13 часов) 1. Простые вещества – Характеристика положения металлы. Общие металлов в Периодической физические свойства. системе. Строение атомов металлов. Физические свойства металлов. 2. Простые вещества – Характеристика положения неметаллы. Физические неметаллов в Периодической свойства неметаллов системе. Строение атомов простых веществ. неметаллов. Физические свойства неметаллов. р/т (стр.33-35) 3.Аллотропия. Понятие аллотропии на примере модификаций кислорода. Аллотропия фосфора и олова. Относительность представлений о металлических и неметаллических свойствах. Д. Получение и свойства белого и серого олова. Понятие о степени окисления. Определение степени окисления в бинарных соединениях. Составление формул бинарных соединений, общий способ их названий. п.17 р/т (стр.49-50 № 1,2,3,4,5) 4. Степень окисления. Бинарные соединения. 5. Бинарные соединения металлов и неметаллов: оксиды, хлориды, сульфиды и др. 6.Важнейшие классы бинарных соединений – оксиды, летучие водородные соединения. 7. Основания. Составление формул, их названия. Расчеты по формулам. Характеристика важнейших соединений. Состав, названия, классификация оснований. Гидроксиды натрия, Д. Коллекция металлов. п. 13 р/т (стр.36-38) Д.Коллекция неметаллов. п. 14 р/т(стр.38-39 № 1,2,3,7,8) п. 14 р/т(стр.38-39 № 4,5,6,) Д. Образцы хлоридов, сульфидов, оксидов металлов. п. 17 упр.2 р/т (стр.51-53 № 8,9,10,12,13) Д. Образцы оксидов: (P2O5,CO2,SiO2,H2O), HCI, NH3 (газы и растворы). п.18 упр.1 р/т (стр.53-54 № 1,2,3,4,7) Д. Образцы щелочей (твердые и в растворе) и калия, кальция. 8.Кислоты. 9. Соли как производные кислот и оснований. 10.Урок – упражнение. 11.Контрольная работа №2 12. Аморфные и кристаллические вещества. 13. Чистые вещества и смеси. Физические явления в химии. нерастворимых оснований. Изменение окраски индикаторов. Работа в рабочих тетрадях. п.19 упр.2,3,4 Состав и названия кислот, их Д. Образцы кислот: HCI, классификация. Представители HNO3,H2SO4,H3PO4,некоторых кислот. других минеральных и органических кислот. Изменение окраски индикаторов. п.20 упр.3,4 выучить формулы основных кислот. Состав и название солей. Расчеты Д. Образцы солей. по формулам солей. п.21 упр.1-3 Упражнения в составлении формул по названиям и названий веществ по формулам. Расчеты по формулам соединений. Понятие о межмолекулярном взаимодействии и молекулярной Чистые вещества и смеси. Способы получения чистых веществ (разделение смесей). Тема.3 Простейшие операции с веществом. Химический практикум. (3 часа) 1.Правила безопасности при работе в химическом кабинете. Знакомство с лабораторным оборудованием. 2.Приемы обращения с нагревательными приборами и лабораторным оборудованием. 3. Очистка загрязненной поваренной соли. Тема.4 Учебные экскурсии. (3 часа) (аптека, местные производства) ПЛАНИРОВАНИЕ УРОКОВ ПО ХИМИИ НЕОРГАНИЧЕСКАЯ ХИМИЯ (продолжение) VIII класс ( 2 часа в неделю, всего 70 часов ) № Тема урока Изучаемые вопросы Эксперимент задание на дом Повторение основных вопросов курса 7 класса (3 часа) 1. Периодическая таблица Периодическая система (таблица) и п.4,6 химических элементов в строение атома. р/т (стр.23-25) свете строения атома. 2. Важнейшие бинарные Бинарные соединения: оксиды, п.17,18 соединения. Степень сульфиды, хлориды, гидриды, р/т (стр.49-55 выборочно) окисления. нитриды. Определение степени окисления, составление формул по степени окисления. 3.Состав и названия Состав, названия и классификация п. 19,20,21 оснований, кислот, солей. оснований, кислот. Состав и р/т (стр.67-68) названия солей. Расчеты по формулам оснований, кислот, солей (вычисление молекулярной массы, определение степени окисления, зарядов атомов). Тема.1 Простые и сложные вещества. Количество вещества. Массовая и объемная доли компонентов смеси. (10 часов) 1.Количество вещества. Количество вещества и единицы Д.некоторые металлы и его измерения: моль, ммоль, кмоль. неметаллы количеством 1 Число Авогадро. моль, 1 ммоль, 1 кмоль. п.15 ( до слов «Масса 1 моль…») упр.1,2 2.Молярная масса вещества. Расчет молярных масс по п. 15 (до конца) упр.3,4 химической формуле. Выполнение упражнений с использованием понятий: число Авогадро, количество вещества, масса вещества. 3. Молярный объем Понятие о молярном объеме газов, Д. Модель молярного объема газообразных веществ. миллимолярном и киломолярном газов. объеме. п.16 упр.1,2 4.Урок-упражнение Решение задач и упражнений с р/т (стр. 41-48 выборочно) использованием понятий: количество вещества, молярная масса, молярный объем газов, число Авогадро. 5. Самостоятельная работа Решение задач по теме. 6. Чистые вещества и смеси. Массовая и объемная доли компонентов смеси, доля примесей. 7. Расчеты, связанные с понятием «доля» 8. Практическая работа №1 9. Урок - упражнение 10. Контроль знаний. 1-2. Химические явления. Понятие о доли компонента в смеси, вычисление массы или объема вещества в смеси и его доле. Решение задач и упражнений на расчет доли (массовой или объемной) и нахождение массы (объема) компонента смеси. «Приготовление раствора сахара и определение массовой доли сахара в растворе» Решение задач и упражнений. Самостоятельная работа. Тема.2 Изменения происходящие с веществами. (14 часов) Понятие о химических явлениях, их отличие от физических. Признаки и условия протекания химических реакций. Экзоэндотермические реакции. п. 24 упр.1-3 п. 24 упр.4-7 р/т (стр. 75-82 выборочно) Д. Химические явления: горение магния, взаимодействие HCI с мрамором, получение Cu(OH)2 и последующее растворение его в кислоте, взаимодействие соли меди с железом, помутнение известковой воды, взаимодействие ацетата свинца с йодидом калия. п.26 упр.1-6 р/т (стр.88-90) Д. Опыт, подтверждающий закон сохранения массы веществ в результате химических реакций. п.27 стр. 96-27 3.Закон сохранения массы Количественная сторона веществ. Химические химических реакций в свете уравнения. учения об атомах и молекулах. Закон сохранения массы веществ и его значение. Роль М.В.Ломоносова и Д.Дальтона в открытии закона. Понятие о химическом уравнении, как об условной записи химической реакции с помощью химических формул. Значение индексов и коэффициентов. Составление уравнений химических реакций. 4. Реакции разложения Сущность реакций разложения и Д. Разложение нитратов калия составление уравнений реакций, или натрия, перманганата проделанных учителем. калия, азотной кислоты, гидроксила железа(III). п.27 реакции разложения р/т (стр.90-91) 5.Практическая работа №2 «Разложение перманганата калия». 6. Реакции соединения Сущность реакций соединения и Д. Осуществление переходов: составление уравнений реакций, S->SO2->H2SO3 P->P2O5->H3PO4 проделанных учителем. Ca->CaO->Ca(OH)2 п.27 реакции соединения р/т (стр.92-94) 7. Реакции замещения Сущность реакций замещения и Д. Взаимодействие щелочных составление уравнений реакций, металлов с водой, цинка с проделанных учителем. кислотами, взаимодействие металлов (Fe,AI,Zn) с растворами солей CuCI2, AgNO3. п.27 реакции замещения р/т (стр.94-96) 8. Практическая работа №3 «Получение водорода». «Замещение меди» р/т (стр.96-97) 9. Реакции обмена Сущность реакций обмена и Д. Взаимодействие растворов составление уравнений реакций, щелочей, окрашенных проделанных учителем. Реакция фенолфталеином, с нейтрализации. Условия течения растворами кислот; реакций между растворами кислот, взаимодействие H2SO4 u щелочей и солей до конца. BaCI2, HCI u AgNO3, NаNO3 u Fe2 (SO4)3 и др. п.27 реакции обмена р/т (стр.97-98) 10.Практическая работа №4 «Реакции обмена» п.27 р/т (стр.99 № 6,7)) 11-12 Расчеты по Решение задач на нахождение п.28 задачи 1-5 химическим уравнениям. количества, массы или объема р/т (стр.100-106 выборочно) продукта реакции по количеству, массе или объему исходного вещества. Расчеты с использованием понятия «доля» (исходное вещество дано в виде растворов заданной концентрации или содержит определенную долю примесей). 13.Обощающий урок- Решение задач и упражнений. повторение по теме. Подготовка к контрольной работе. 14.Контрольная работа. Тема 3 Скорость химических реакций. Химическое равновесие. (7 часов) 1.Скорость химических Понятие о скорости химических Л.Взаимодействие гранул и реакций. реакций. Единицы измерения порошка цинка с соляной скорости химических реакций. кислотой. Скорость гомогенных и п.29 упр.1-5 гетерогенных процессов. Зависимость скорости от площади соприкосновения реагирующих веществ. 2.Зависимость скорости Зависимость скорости х/р от Л. Взаимодействие Zn, Mg,Fe химических реакций от природы реагирующих веществ, с HCI. Взаимодействие природы реагирующих температуры, концентрации раствора H2SO4 с раствором веществ, концентрации и реагирующих веществ (закон тиосульфата натрия температуры. действующих масс) различной концентрации. Взаимодействие цинка с 3. Катализ и катализаторы H2SO4 при разных температурах; тиосульфата натрия с H2SO4 при разной температуре. п.30 упр.1-7 Понятие о катализе, катализаторах Л. Разложение пероксида и ингибиторах. Понятие о водорода в присутствии ферментах, как биологических MnO2, горение сахара в катализаторах белковой природы. присутствии MnO2, горение сахара в присутствии свежего сигаретного пепла п.31 упр.1-5 4. Обратимые и необратимые Понятие об обратимости Л. Примеры необратимых реакции. химических реакций. Условия реакций, протекающих в протекания необратимых реакций. растворах с образованием газа, осадка или воды, а также реакций горения. Примеры обратимых реакций. п.32 упр.1-4 5. Химическое равновесие и Понятие о химическом равновесии, способы его смещения как характеристике обратимых реакций. Динамический характер химического равновесия. Принцип Ле Шателье. Д.Смещение равновесия химической реакции, протекающей между роданидом аммония и хлоридом железа (III) п.33 упр.1-5 6-7. Обобщение и Выполнение упражнений. Учет и систематизация знаний по контроль знаний по теме. теме «Скорость химических реакций. Химическое равновесие». Тема 4 « Растворение. Растворы. Свойства растворов электролитов. (29 часа) 1.Растворение как физико- Растворы. Гидраты. Д. Мгновенная химический процесс Кристаллогидраты. Тепловые кристаллизация явления при растворении. перенасыщенного раствора глауберовой соли. Л.Растворение безводного сульфата меди (II) в воде. п.34 ( До слов « растворимость зависит от температуры…») 2.Растворимость. растворов. Типы Кривые растворимости. Насыщенный, ненасыщенный и перенасыщенный раствор. Различная растворимость веществ. Зависимость её от температуры. Л. Растворимость веществ при различных температурах. Тепловые явления при растворении. п.34 (до конца) упр.1-7 р/т (стр.110-114 выборочно) 3-4. Электролитическая Электролиты и неэлектролиты. диссоциация. Степень электролитической диссоциации. Сильные и слабые электролиты. Механизм диссоциации веществ с различным видом связи. Д. Испытание веществ и их растворов на электропроводность. Зависимость электролитической диссоциации уксусной кислоты от разбавления. п.35 упр.1-6 5.Основные положения Ионы. Свойства ионов. теории Электролитической Классификация ионов по составу диссоциации. (простые и сложные),по заряду (катионы и анионы), по водной оболочке (гидратированные и негидратированные) 6. Ионные уравнения Реакции обмена, идущие до конца. реакций Запись уравнений реакций (молекулярных, полных и сокращенных ионных) с использованием таблицы растворимости. 7.Практическая работа №5 «Ионные реакции» 8.Практическая работа №6 «Условия течения химических реакций между растворами электролитов до конца» 9-10.Кислоты в свете ТЭД. Определение кислот, как Классификация кислот. электролитов, их диссоциация. Химические свойства Классификация кислот по кислот. различным признакам. Взаимодействие кислот с металлами, условия течения этих реакций. Электрохимический ряд напряжения металлов. Взаимодействие металлов с оксидами металлов и основаниями. Реакция нейтрализации. Взаимодействие кислот с солями. Использование таблицы растворимости веществ в воде для характеристики химических свойств кислот. 11.Практическая работа №7 «Химические свойства кислот» Д.Движение окрашенных ионов в электрическом поле. п.36 упр.1-5 р/т (стр.114-119 выборочно) 12-13. Основания в свете Определение оснований, как ТЭД, их классификация и электролитов, их диссоциация. свойства. Классификация оснований по различным признакам. Взаимодействие оснований с кислотами (повторение). Взаимодействие щелочей с солями (работа с таблицей растворимости) и оксидами неметаллов. Разложение нерастворимых Л. Примеры реакций, идущих до конца. п.37 упр.1-5 р/т (стр. 119-121) р/т (стр.121-124) Повторить состав основных кислот Л. Химические свойства кислот (на примере HCI, H2SO4) п. 38 упр.1-6 р/т (стр.131 №1; 140-141 № 13,14) Л. Реакции характерные для щелочей и нерастворимых оснований. п.39 упр.1-5 14. Практическая работа №8 15-16. Оксиды. оснований. «Химические свойства оснований». Состав оксидов, их классификация: несолеобразующие и солеобразующие (кислотные и основные). Свойства кислотных и основных оксидов. 17-18. Соли в свете ТЭД, их Определение солей как свойства. электролитов, их диссоциация. Взаимодействие солей с металлами, особенности этих реакций. Взаимодействие солей между собой (работа с таблицей растворимости). Взаимодействие солей с кислотами и щелочами (повторение). 19.Практическая работа №9 «Химические свойства солей». р/т (стр.142-143;146-147) Л. Изучение свойств основных оксидов для CaO и кислотных для CO2 п.40 упр.1-5 р/т (стр. 124-131 выборочно) Л. Химические солей. п.41 упр.1-5 р/т (стр. 148-149;) свойства р/т (стр. 156-158) 20-21.Генетическая связь Понятие о генетической связи и Д. иллюстрация переходов: между классами генетических рядах металлов и P->P2O5->H3PO4->Ca3(PO4)2; неорганических соединений. неметаллов. Ca->CaO->Ca(OH)2-> Ca3(PO4)2; п.42 упр.1-5 р/т (стр. 158-161) 22. Обобщение и Решение расчетных задач по систематизация знаний по уравнениям, характеризующим теме. свойства основных классов соединений и выполнение упражнений на закрепления понятия о генетической связи. Подготовка к контрольной работе. 23. Практическая работа «Решение экспериментальных №10 задач» 24. Контрольная работа. 25. Классификация Различные признаки Д.Примеры реакций химических реакций. классификации химических соединения, разложения, реакций. замещения, обмена, гомогетерогенных, экзо-и эндотермических, каталитических и некаталитических. 26.ОкислительноОпределение степеней окисления Д. Взаимодействие Zn с HCI, c восстановительные реакции. элементов, образующих вещества S, c CuCI2. Горение магния. различных классов. Реакции Взаимодействие хлорной и Окислительно-восстановительные сероводородной воды. и реакции ионного обмена, их п.43 упр.1-3 отличия. Понятие об окислителе и восстановителе, окислении и восстановлении. 27. Упражнения в Составление уравнений п. 43 упр.7 составлении Окислительно- окислительно-восстановительных р/т (стр.161-166 выборочно) восстановительных реакций. 28.Свойства изученных классов веществ в свете ОВР. 29. Обобщение и систематизация знаний по теме ОВР. 1-4. Повторение основных законов, понятий и теорий через знакомство с жизнью и деятельностью ученых, осуществивших их открытие. реакций методом электронного баланса. Характеристика свойств простых р/т (стр.161-166 выборочно) веществ металлов и неметаллов, а также кислот и солей в свете представлений об ОВР. Выполнение упражнений. Учет и контроль знаний по теме. Тема. 5 Шеренга великих химиков (4 часа) Парацельс, Роберт Бойль, М.В. Ломоносов, А.Л.Лавуазье, К.Л.Бертолле, А.Авогадро, Д.И.Менделеев, С.А.Аррениус, И.А.Каблуков, А Л Ле Шателье. Тема.6 Учебные экскурсии. (3 часа) (аптека, местные производства) ПОЯСНИТЕЛЬНАЯ ЗАПИСКА К УЧЕБНОМУ ПЛАНУ ОСНОВНОЕ ОБЩЕЕ ОБРАЗОВАНИЕ ХИМИЯ Изучение химии на ступени основного общего образования направлено на достижение следующих целей: Освоение важных знаний об основных понятиях и законах химии, химической символике; Овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчеты на основе химических формул веществ и уравнений химических реакций; Развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями; Воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры; Применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде. Настоящее планирование подготовлено на базе примерного планирования уроков по химии Заслуженного учителя школы РФ, профессора ИПК МО, к.п.н. О.С.Габриеляна, утвержденных МО РФ программы и учебника О.С.Габриеляна. Согласно нового БУП 2004 года на изучение химии в 8-9 классах отведено по 2 часа в неделю (всего 140 часов за 2 года). Практика преподавания химии в основной школе показала, что данного количества часов не достаточно для освоения важных знаний по предмету и закрепления навыков применения полученных знаний и умений на практике, особенно в самом начале изучения предмета. В 8 классе необходимо на изучение предмета 3 часа в неделю -105 часов в год. В связи с тем, что в 8 классе увеличивается предельная аудиторная учебная нагрузка , курс изучения химии можно начинать в 7 классе за счет компонента образовательного учреждения (1час в неделю), включив в программу только основные понятия, законы химии, химическую символику, применение знаний и умений на практике, исключив решение расчетных задач. Программа изучения предмета в 7 классе построена, исходя из укрупненной дидактической единицы – «химический элемент», который может существовать в виде атома, образовывать простое вещество и входить в состав сложного. После основательного введения, изучаются две темы: «Атомы химических элементов», «Простые вещества и важнейшие соединения химических элементов» из которых исключены расчетные задачи по химическим формулам веществ. Изучение двух тем заканчивается небольшим химическим практикумом и учебными экскурсиями на местные производства. Программа изучения предмета в 8 классе, после небольшого повторения начинается с количественных отношений в химии «Количество вещества. Массовая и объемная доли компонентов смеси». Логика подсказывает, что после изучения состава вещества необходимо изучать его свойства, поэтому следующая тема – «Изменения, происходящие с веществами», которая подкреплена практическими работами. Чтобы охарактеризовать химическую реакцию, важно знать её закономерности, и следующая тема – «Скорость химических реакций. Химическое равновесие». Большинство химических реакций происходит в растворах, и поэтому курс 8 класса заканчивается темой «Растворение. Растворы. Свойств растворов электролитов», которая подкреплена еще рядом практических работ. В заключении дается классификация химических реакций по различным признакам, и изучаются окислительновосстановительные процессы. Данная программа подчинена строгой логике, освобождена от избытка конкретного материала, т.к. в основу её положен развивающий принцип. Для усиления идей гуманизации и гуманитаризации в завершение курса предусматривается тема «Шеренга великих химиков», в которой повторение основного материала 8 класса проводится по блокам через знакомство с жизнью и деятельностью выдающихся ученых-химиков. Предлагаемое планирование изучения основ химии с 7 класса позволит многим учащимся сделать более правильный выбор в определении профиля в старшем звене средней школы.

