Напишите уравнения реакций, с помощью которых можно
advertisement

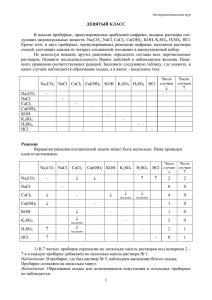
25 октября (120 минут) Химия – 9 - 2011 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. 2 - 5 уравнения написать в молекулярном, полном и сокращенном ионном виде. Ве → ВеО → ВеСl2 → Be(OH)2→ Be(NO3)2 ↓ K2BeO2 2. При обработки соляной кислотой смеси железа с медью массой 28 г выделилось 4,48 л водорода (н.у.). Определить массовую долю железа и меди в смеси. 3. Какими пятью различными способами можно получить хлорид меди(II)? Приведите уравнения соответствующих реакций. Определите тип каждой реакции. Для окислительно-восстановительных реакций составьте электронный баланс. 4. а) Горело семь свечей. Три погасли. Сколько свечей осталось? Дополнительный вопрос: горение свечи – это физический или химический процесс? Ответ обоснуйте. б) Символ элемента, названного в честь России: 1)Rh 2)Ru 3)Rb 4)Ra в) Раствор образуется при смешивании с водой: 1) уксусной кислоты 2) цемента 3) молока 4) подсолнечного масла г) Вещество, молекулярная формула которого включает три атома: 1) азот 2) кислород 3) сера 4) углекислый газ д) Самый распространенный элемент на земле:1) кислород 2) алюминий 3) железо 4) кальций 5. Известно, что в четырех пробирках под номерами 1, 2, 3, 4 находятся растворы HCl, CaCl2, KCl, FeCl3. Однако не известно, какое вещество находится в конкретной пробирке. В каждую из пробирок добавили раствор карбоната натрия. В пробирке 1 визуальных изменений не произошло, в пробирке 2 образовался осадок, в пробирке 3 образовался газ, а в 4 одновременно произошло образование осадка и газа. Определите, какое вещество находится в каждой пробирке. Ответ обоснуйте и проиллюстрируйте соответствующими уравнениями реакций в молекулярном виде. Химия – 9 - 2011 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. 2 - 5 уравнения написать в молекулярном, полном и сокращенном ионном виде. Ве → ВеО → ВеСl2 → Be(OH)2→ Be(NO3)2 ↓ K2BeO2 2. При обработки соляной кислотой смеси железа с медью массой 28 г выделилось 4,48 л водорода (н.у.). Определить массовую долю железа и меди в смеси. 3. Какими пятью различными способами можно получить хлорид меди(II)? Приведите уравнения соответствующих реакций. Определите тип каждой реакции. Для окислительно-восстановительных реакций составьте электронный баланс. 4. а) Горело семь свечей. Три погасли. Сколько свечей осталось? Дополнительный вопрос: горение свечи – это физический или химический процесс? Ответ обоснуйте. б) Символ элемента, названного в честь России: 1)Rh 2)Ru 3)Rb 4)Ra в) Раствор образуется при смешивании с водой: 1) уксусной кислоты 2) цемента 3) молока 4) подсолнечного масла г) Вещество, молекулярная формула которого включает три атома: 1) азот 2) кислород 3) сера 4) углекислый газ д) Самый распространенный элемент на земле:1) кислород 2) алюминий 3) железо 4) кальций 5. Известно, что в четырех пробирках под номерами 1, 2, 3, 4 находятся растворы HCl, CaCl2, KCl, FeCl3. Однако не известно, какое вещество находится в конкретной пробирке. В каждую из пробирок добавили раствор карбоната натрия. В пробирке 1 визуальных изменений не произошло, в пробирке 2 образовался осадок, в пробирке 3 образовался газ, а в 4 одновременно произошло образование осадка и газа. Определите, какое вещество находится в каждой пробирке. Ответ обоснуйте и проиллюстрируйте соответствующими уравнениями реакций в молекулярном виде.