СКАЧАТЬ Рабочую программу по химии 9 класс
advertisement

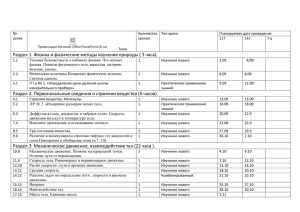
РАБОЧАЯ ПРОГРАММА ПО ХИМИИ ДЛЯ 9 КЛАСС 2.Пояснительная записка 2.1 Перечень нормативных документов, использованных при составлении рабочей программы. Закон Российской Федерации от 29.12.2012 года №273-ФЗ «Об образовании в РФ» (с последующими изменениями и дополнениями) приказ Минобразования России от 5 марта 2004 № 1089 «Об утверждении федерального компонента государственных образовательных стандартов начального общего, основного общего и среднего (полного) общего образования»; приказ Минобразования России от 9 марта 2004 №1312 «Об утверждении федерального базисного учебного плана и примерных учебных планов для образовательных учреждений Российской Федерации, реализующих программы общего образования» (в ред. приказов Минобрнауки РФ от 20.08.2008 № 241, от 30.08.2010 № 889, от 03.06.2011 № 1994, от 01.02.2012 № 74); приказ от 06.10.2009 № 373 «Об утверждении и введении в действие федерального государственного образовательного стандарта начального общего образования» (в ред. приказов Минобрнауки России от 26.11.2010 № 1241, от 22.09.2011 № 2357, от 18.12.2012 № 1060); приказ от 17.12.2010 № 1897 «Об утверждении федерального государственного образовательного стандарта основного общего образования»; Постановление Главного Государственного санитарного врача Российской Федерации «Об утверждении СанПин 2.4.2821-10 «Санитарно-эпидемиологические требования к условиям и организации обучения в общеобразовательных учреждениях» от 29.12.2010 №189; приказ Минобрнауки России от 31.03.2014 № 253 «Об утверждении федерального перечня учебников, рекомендуемых к использованию при реализации имеющих государственную аккредитацию образовательных программ начального общего, основного общего, среднего общего образования». Приказ Министерства образования Оренбургской области от 13.08.2014 № 01-21/1063 « Об утверждении регионального базисного учебного плана и примерных учебных планов для общеобразовательных организаций Оренбургской области». Устав МОБУ СОШ №__ города___________ Образовательная программа МОБУ СОШ №__ города ______________. Учебный план МОБУ СОШ №__ города на 20__ - 20__ учебный год Положение МОБУ СОШ №__ «О рабочей программе педагога» 2.2.Ведущие целевые установки в предмете Содержание программы направлено на освоение знаний и на овладение умениями на базовом уровне, что соответствует Образовательной программе школы. Она включает все темы, предусмотренные федеральным государственным образовательным стандартом основного общего образования по химии и авторской программой учебного курса. Построена данная программа на основе спиральной модели, предусматривающей постепенное развитие и углубление теоретических представлений при линейном ознакомлении с эмпирическим материалом. Основное содержание авторской полностью нашло отражение в данной рабочей программе. 2.3. Цели обучения с учетом специфики учебного предмета - формирование у учащихся знаний основ науки - важнейших фактов, понятий, законов и теорий, химического языка, доступных обобщений мировоззренческого характера и понятий об основных принципах химического производства. -развитие умений наблюдать и объяснять химические явления, происходящие в природе, в лаборатории, на производстве и в повседневной жизни; -формирование умений работать с веществами, выполнять несложные химические опыты, соблюдать правила техники безопасности; грамотно применять химические знания в общении с природой и в повседневной жизни; -раскрытие роли химии в решении глобальных проблем человечества: рациональном природопользовании, защите окружающей среды от загрязнения промышленными и бытовыми отходами; -развитие личности обучающихся, формирование у них гуманистических отношений и экологически целесообразного поведения в быту и трудовой деятельности. 2.4. Конкретизация целей обучения с учетом специфики образовательного учреждения Курс химии в нашей школе направлен на овладения знаниями и умениями по предмету, которые затем будут востребованы в процессе изучения физики, органической химии и последующих курсов химии в старших классах. 2.5. Задачи обучения по предмету Задачи, решаемые в курсе химии можно сформулировать следующим образом: - Показать школьникам химию как предмет изучения и убедить учащихся в необходимости и полезности ее изучения; - Приобщить к терминологическому языку химии и сформировать первые пространственные представления об объектах и явлениях, происходящих в окружающем ребенка мире; - Познакомить с химией как уникальным и наглядным источником знаний и средством обучения. 2.6.Общая характеристика предмета В данной программе выражена химико-экологическая направленность содержания. В нём отражена система важнейших химических знаний, раскрыта роль химии в познании окружающего мира, в повышении уровня материальной жизни общества, в развитии его культуры, в решении важнейших проблем современности. Содержание представлено тремя взаимосвязанными и равными блоками знаний, развивается по спирали, отражающей повышение теоретического уровня изучения и обобщения знаний. Все другие виды знаний и способов деятельности включаются в эти блоки. Содержание блоков знаний пронизано и экологическими сведениями. Построение курса с химико-экологической направленностью осуществляется с учётом логики науки, реализации принципов дидактики и психологии усвоения знаний и развития личности обучаемых. 2.7.Общая характеристика учебного процесса Наиболее частые технологии обучения химии в 9 классе - объяснительно-иллюстративная, частично-поисковая, практическая, лабораторная. Курс основан на знаниях, полученных при изучении таких предметов, как физика. 2.8.Обоснование выбора УМК Программа выбрана в соответствии с федеральным компонентом Государственного образовательного стандарта, примерной программой основного общего образования по химии , рекомендована Департаментом образовательных программ и стандартов общего образования Министерства образования РФ, в полном объеме соответствует образовательным целям МОБУ СОШ №__, построена с учетом принципов системности, научности, доступности и преемственности; способствует формированию ключевых компетенций обучающихся; обеспечивает условия для реализации практической направленности, учитывает возрастную психологию обучающихся. 2.9.Описание места учебного предмета в учебном плане Согласно федеральному государственному образовательному стандарту общего образования предмет химия входит в образовательную область «Естествознание». Федеральный базисный учебный план для общеобразовательных учреждений РФ отводит 70 учебных часов в год, для обязательного изучения химии в 9-м классе 2 часа в неделю. 2.10. Результаты освоения конкретного учебного предмета Личностные результаты: 1) воспитание российской гражданской идентичности 2) формирование основ экологической культуры соответствующей современному уровню экологического мышления 3) формирование целостного мировоззрения, соответствующего современному уровню развития науки и общественной практики, учитывающего социальное, культурное, языковое ,духовное многообразие современного мира. Предметные результаты: 1) формирование представлений о химии, ее роли в освоении планеты человеком, о химических знаниях как компоненте картины мира, задач охраны окружающей среды и рационального природопользования; 2) формирование представлений и теоретических знаний о целостности и неоднородности Земли,как планеты людей в пространстве и во времени, особенностях природы, жизни, культуры и хозяйственной деятельности людей, экологических проблемах на разных материках. 3) формирование умений и навыков использования знаний в повседневной жизни для объяснения и оценки безопасности окружающей среды в результате химического воздействия. Метапредметные результаты: 1)Регулятивные: ставить учебные задачи, планировать и корректировать свою деятельность в соответствии с ее целями, задачами и условиями, оценивать свою работу, владеть различными способами самоконтроля. 2) Познавательные учебно-логические: классифицировать в соответствии с выбранными признаками. Сравнивать объекты, систематизировать информацию, определять проблему и способы ее решения, владеть навыками анализа. 3) Учебно-информационные: поиск необходимых источников информации, работа с текстом, составление тезисного плана, выводов, использовать различные виды моделирования, создание собственной информации . 4)Коммуникативные: выступать перед аудиторией, уметь вести дискуссию, диалог, находить приемлемое решение при наличии разных точек зрения. 3.Содержание учебного предмета Название раздела и темы Количество часов 9 класс (неорганическая химия) 50 Повторение основных вопросов курса 8 класса и введение в курс 9 6 класса Тема 1. Металлы 18 Тема 2. Неметаллы 26 9 класс (органическая химия) 20 Тема 3. Органические соединения 10 Тема 4. Обобщение знаний по химии 10 за курс основной школы Итого 70 4.Тематическое планирование с определением основных видов учебной деятельности для курса 9 класса. Содержание программы Тема 1. Металлы (18 ч) Положение металлов в периодической системе Д. И. Менделеева. Металлическая кристаллическая решетка и металлическая химическая связь. Общие физические свойства металлов. Химические свойства металлов как восстановителей, а также в свете их положения в электрохимическом ряду напряжений металлов. Коррозия металлов и способы борьбы с ней. Сплавы, их свойства и значение. Общая характеристика щелочных металлов. Металлы в природе. Общие способы их получения. Строение атомов. Щелочные металлы — простые вещества. Важнейшие соединения щелочных металлов — оксиды, гидроксиды и соли (хлориды, карбонаты, сульфаты, нитраты), их свойства и применение в народном хозяйстве. Калийные удобрения. Общая характеристика элементов главной подгруппы II группы. Строение атомов, Щелочноземельные металлы — простые вещества. Важнейшие соединения щелочноземельных металлов — оксиды, гидроксиды и соли (хлориды, карбонаты, нитраты, сульфаты, фосфаты), их свойства и применение в народном хозяйстве. Алюминий. Строение атома, физические и химические свойства простого вещества. Соединения алюминия — оксид и гидроксид, их амфотерный характер. Важнейшие соли алюминия. Применение алюминия и его соединений. Железо. Строение атома, физические и химические свойства простого вещества. Генетические ряды Fе2+ и Fе3+. Важнейшие соли железа. Значение железа и его соединений для природы и народного хозяйства. Демонстрации. Образцы щелочных и щелочноземельных металлов. Образцы сплавов. Взаимодействие натрия, лития и кальция с водой. Взаимодействие натрия и магния с кислородом. Взаимодействие металлов с неметаллами. Получение гидроксидов железа (II) и (III). Лабораторные опыты.1. Получение и взаимодействие гидроксида цинка с растворами кислот и щелочей. 2. Рассмотрение образцов металлов. 3. Взаимодействие металлов с растворами кислот и солей. 4. Ознакомление с образцами природных соединений натрия, кальция, алюминия и рудами железа. 5. Качественные реакции на ионы Fе2+ и Fе3+. Тема 2. Неметаллы (26ч) Общая характеристика неметаллов: положение в периодической системе, особенности строения атомов, электроотрицательность (ЭО) как мера «неметалличности», ряд ЭО. Кристаллическое строение неметаллов — простых веществ. Аллотропия. Физические свойства неметаллов. Относительность понятия «металл» — «неметалл». Общая характеристика галогенов. Строение атомов. Простые вещества и основные соединения галогенов, их свойства. Краткие сведения о хлоре, броме, фторе и йоде. Применение галогенов и их соединений в народном хозяйстве. Сера. Строение атома, аллотропия, свойства и применение ромбической серы. Оксиды серы (IV и VI), их получение, свойства и применение. Серная кислота и ее соли, их применение в народном хозяйстве. Производство серной кислоты. Азот. Строение атома и молекулы, свойства простого вещества. Аммиак, строение, свойства, получение и применение. Соли аммония, их свойства и применение. Оксиды азота (II) и (IV). Азотная кислота, ее свойства и применение. Нитраты и нитриты, проблема их содержания в сельскохозяйственной продукции. Азотные удобрения. Фосфор. Строение атома, аллотропия, свойства белого и красного фосфора, их применение. Основные соединения: оксид фосфора (V) и ортофосфорная кислота, фосфаты. Фосфорные удобрения. Углерод. Строение атома, аллотропия, свойства модификаций, применение. Оксиды углерода (II) и (IV), их свойства и применение. Карбонаты: кальцит, сода, поташ, их значение в природе и жизни человека. Кремний. Строение атома, кристаллический кремний, его свойства и применение. Оксид кремния (IV), его природные разновидности. Силикаты. Значение соединений кремния в живой и неживой природе. Понятие о силикатной промышленности. Демонстрации. Образцы галогенов — простых веществ. Взаимодействие галогенов с натрием, алюминием. Вытеснение хлором брома или йода из растворов их солей. Взаимодействие серы с металлами, водородом и кислородом. Взаимодействие концентрированной азотной кислоты с медью. Поглощение углем растворенных веществ или газов. Восстановление меди из ее оксида углем. Образцы природных соединений хлора, серы, фосфора, углерода, кремния. Образцы важнейших для народного хозяйства сульфатов, нитратов, карбонатов, фосфатов. Образцы стекла, керамики, цемента. Лабораторные опыты. 6. Качественные реакции на хлорид-, сульфат-, карбонат-ионы. 7. Распознавание солей аммония. 8. Ознакомление с природными силикатами. 9. Ознакомление с продукцией силикатной промышленности. 10. Получение углекислого газа и его распознавание. Тема 3. Органические соединения (10 ч) Вещества органические и неорганические, относительность этого понятия. Причины многообразия углеродных соединений. Теория строения органических соединений А. М. Бутлерова. Алканы. Строение молекулы метана. Понятие о гомологическом ряде. Изомерия углеродного скелета. Химические свойства алканов: реакция горения,з амещения, разложения и изомеризации. Применение метана. Алкены. Этилен как родоначальник гомологического ряда алкенов. Двойная связь в молекуле этилена. Свойства этилена: реакции присоединения (водорода, галогена, галогеноводорода, воды) и окисления. Понятие о предельных одноатомных спиртах на примере этанола и двухатомных — на примере этиленгликоля. Трехатомный спирт — глицерин. Реакции полимеризации этилена. Полиэтилен и его значение. Алкины. Ацетилен. Тройная связь в молекуле ацетилена. Применение ацетилена на основе свойств: реакция горения, присоединения хлороводорода и дальнейшая полимеризация в поливинилхлорид, реакция гидратации ацетилена. Понятие об альдегидах на примере уксусного альдегида. Окисление альдегида в кислоту. Одноосновные предельные карбоновые кислоты на примере уксусной кислоты. Ее свойства и применение. Реакции этерификации и понятие о сложных эфирах. Жиры как сложные эфиры глицерина и жирных кислот. Понятие об аминокислотах как амфотерных органических веществах. Реакции поликонденсации. Белки, их строение и биологическая роль. Понятие об углеводах. Глюкоза, ее свойства и значение. Крахмал и целлюлоза, их биологическая роль. Демонстрации.Модели молекул метана и других углеводородов. Взаимодействие этилена с бромной водой и раствором перманганата калия. Получение ацетилена карбидным способом и его горение. Образцы этанола, этиленгликоля и глицерина. Окисление уксусной кислоты. Получение уксусно-этилового эфира. Омыление жира. Доказательство наличия функциональных групп в растворах аминокислот. Цветные реакции белков. Взаимодействие глюкозы с аммиачным раствором оксида серебра. Гидролиз глюкозы и крахмала. Лабораторные опыты.11. Изготовление моделей молекул углеводородов. 12. 13.Взаимодействие глюкозы с гидроксидом меди (II). 14.Взаимодействие крахмала с йодом. Свойства глицерина. Тема 5. Обобщение знаний по химии за курс основной школы. (10 ч) Человек в мире веществ, материалов, химических реакций. Проблема безопасного использования химических веществ. Понятие о БАДах. нефть,природный газ и их применение. Простые и сложные вещества. Решение задач. Контрольная работа. 5.Описание учебно-методического и материально-технического обес печения образовательного процесса Габриелян О.С. Химия. 9 класс. М., «Дрофа», 2009. Габриелян О.С, Остроумов И.Г. Настольная книга учителя. Химия. 9 кл.: Методическое пособие. - М.: Дрофа. Химия. 9 кл.; Контрольные и проверочные работы к учебнику О.С. Габриеляна «Химия. 9» / О.С. Габриелян, П.Н. Березкин, А.А. Ушакова и др. - М.: Дрофа. Габриелян О.С, Остроумов И.Г. Изучаем химию в 9 кл.: Дидактические материалы. - М.: Блик плюс. Габриелян О.С, Яшукова А.В. Рабочая тетрадь. 9 кл. К учебнику О.С. Габриеляна «Химия. 9». - М.: Дрофа. Габриелян О.С, Воскобойникова Н.П. Химия в тестах, задачах, упражнениях. 8 - 9 кл. - М.: Дрофа. 6. Планируемые результаты изучения предмета Основные умения и навыки, которые должны быть сформированы у учащихся по окончанию изучения курса химии в 9 классе: Неорганическая химия. Учащиеся должны знать: - положение металлов и неметаллов в ПСХЭ Д.И.Менделеева; - общие физические и химические свойства металлов и основные способы их получения; - основные свойства и применение важнейших соединений щелочных и щелочноземельных металлов; Учащиеся должны уметь: давать определения и применять следующие понятия: сплавы, коррозия металлов, переходные элементы, амфотерность; Органическая химия. Учащиеся должны знать: - причины многообразия углеродных соединений (изомерию); виды связей; важнейшие функциональные группы, номенклатуру основных представителей групп органических веществ; - строение, свойства и практическое применение метана, этилена, ацетилена, одноатомных и многоатомных спиртов, уксусного альдегида и уксусной кислоты; - понятие об альдегидах, сложных эфирах, жирах, аминокислотах, белках и углеводах; реакциях этерификации, полимеризации и поликонденсации. Учащиеся должны уметь: - разъяснять на примерах причины многообразия органических веществ, материальное единство и взаимосвязь органических веществ, причинно-следственную зависимость между составом, строением, свойствами и практическим применением веществ; - составлять уравнения химических реакций, подтверждающих свойства изученных органических веществ, их генетическую связь; - выполнять обозначенные в программе эксперименты и распознавать важнейшие органические вещества. 7. Приложения. 7.1. Календарно-тематическое планирование на год № Название раздела. Вид урока п/п Тема урока. Основные понятия Межпредметные связи Оборудование уровня Основное содержание. 1 1. Введение Характеристика химического элемента по его положению в ПСХЭ Д.И.Менделеева Отслеживание обученности Вводный Металлические свойства. Изменения свойств. Оксиды, Таблица Д.И.Менделеева, простые вещества – металлы и §1 -2 Дата предпол./ фактич. гидроксиды. 2 Характеристика химического элемента по его положению в ПСХЭ Д.И.Менделеева 3 Амфотерные оксиды и Комбинированный гидроксиды 4 Периодический закон. Система элементов Д.И.Менделеева Комбинированный 5 Обобщение и систематизация Обобщение и систематизация Презентация, таблицы 6 Контрольная работа Урок контроля Таблицы 7 2. Металлы Металлы. Особенности строения. Физические свойства. Сплавы Комбинированный Комбинированный Тип химической связи. Период. Порядковый номер. Группа. Строение атома неметаллы Диск, таблица Менделеева §1-2 Амфотерность. Переходные элементы Р-ры сильной кислоты, сильной щелочи, солей амфотерных элементов (цинка, алюминия) §2 упр 3,4 Периодический закон. Периодическая зависимость. Разные варианты § 3 упр 2 ПСХЭ, портрет Д.И.Менделеева Металлические кристаллические решетки. Сплавы Физика Коллекция образцов металлов, коллекция §1-3 §4-6 сплавов 8 Химические свойства металлов Комбинированный Химические свойства металлов на основании их положения в электрохимическ ом ряду напряжений Щелочные металлы. Фенолфталеин, химическая посуда § 7,8 9 Общие понятия о коррозии металлов Комбинированный Коррозия. Химическая, электрохимическ ая коррозия. Лужение. Ингибиторы Презентация, ржавое железо, консервная банка §9,10 10 Металлы в природе. Общие способы их получения Комбинированный Руды. Горные породы. Минералы. Металлургия, гидрометаллурги я, пирометаллурги я Коллекция руд металлов. Природные соединения различных металлов §9 11 Жесткость воды и способы ее устранения Комбинированный Дистилляция Презентация §9 12 Щелочные металлы Комбинированный Едкие щелочи Щелочные металлы, растворы кислот, фенолфталеин, стеклянная посуда §11упр 3,4 13 Бериллий, магний и щелочноземельные металлы Комбинированный Щелочноземельн ые металлы Образцы металлов. Колба с кислородом, фенолфталеин, пробирки §12 14 Алюминий Комбинированный Алюминотермия Металлический алюминий, неметаллокислитель, реактивы, химическая посуда §13 15 Соединения алюминия Комбинированный Алюмосиликаты . Боксит. Корунд Презентация, образцы природных соединений и сплавов алюминия §13 упр 5,6 16 Железо, его строение, физические и химические свойства Комбинированный Технически чистое и химически Минералы § железа: магнитный, бурый и красный чистое вещество железняки Соединения железа Желтая и красная кровяные соли, роданид калия, стеклянная посуда §14 17 Генетические ряды железа (II) и железа (III). Важнейшие соли железа. Комбинированный 18 Практическая работа «Получение соединений металлов и изучение их свойств» Практическая работа Презентация, реактивы, химическая посуда §14 19 Обобщение и систематизация знаний по теме «Металлы» Обобщение и систематизация Таблицы, тесты § 4-14. Глава 2 20 Контрольная работа по теме «Металлы» Контрольная работа Таблицы, тесты 21 22 3. Неметаллы Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон Водород Комбинированный Аллотропия Презентация, образцы неметаллов §15,16 Комбинированный Окислительные и восстановительн Соляная кислота, цинк, пробирка §17 ые свойства водорода 23 Галогены Комбинированный Открытие галогенов. Химическая активность. Условия образования соединений галогенов Образцы галогенов §17 24 Соединения галогенов Комбинированный Галогениды Растворы галогеноводород ных кислот и галогенидов §19 25 Получение галогенов, применение Комбинированный Фтор, хлор, бром, йод Растворы галогеноводород ных кислот и галогенидов §20 26 Кислород Комбинированный Горение и медленное окисление. Дыхание и фотосинтез Природные кислородсодерж ащие вещества. Схема круговорота кислорода в природе. Газометр с кислородом §21 27 Сера и ее соединения Комбинированный Демеркуризация Различные модификации серы, природные серосодержащие вещества §22 28 Серная кислота. Окислительные свойства серной кислоты Комбинированный Производство серной кислоты. Соли серной кислоты Концентрирован ная серная кислота, медь, схемы и плакаты по производству и применению серной кислоты §23 29 Решение задач и упражнений Обобщение и систематизация Презентация, таблицы §23 30 Азот Комбинированный Азот в природе, его биологическое значение Прибор для получения газов, горелка, ряд ЭО металлов §24 31 Аммиак Комбинированный Водородная связь. Донорноакцепторный механизм образования ковалентной связи. Донор. Акцептор Реактивы, прибор для получения газов §25 32 Соли аммония Комбинированный Хлорид, нитрат, карбонат аммония Кристаллически е соли аммония 33 Азотная кислота и ее соли Комбинированный Оксиды, ряд активности металлов Азотная кислота, §27 образцы кристаллических нитратов, коллекция азотных удобрений ,уголь, сера 34 Окислительные свойства азотной кислоты Комбинированный Свойства азотной кислоты как окислителя и как электролита Азотная кислота, §27 медь 35 Фосфор и его соединения Комбинированный Фосфиды. Фосфин. Фосфаты 36 Решение задач и упражнений по теме «Подгруппа азота» Обобщение и систематизация 37 Углерод Комбинированный §26 §28 Таблицы Аллотропия. Аморфный углерод Модели §29 кристаллических решеток алмаза и графита, древесный уголь, активированный уголь, растворы чернил, разбавленные соки овощей и фруктов, одеколон, вата, песок, посуда 38 Кислородные соединения углерода Комбинированный 39 Практическая работа «Получение, собирание и распознавание газов» Практическая работа 40 Кремний и его соединения Комбинированный 41 Решение задач и упражнений по теме «Подгруппа углерода» Урок применения знаний Угарный газ Кремнезем, силикаты Известковая вода, сухой лед, прибор для получения газов, стеклянная посуда, лучинка §30 Набор реактивов, химическая посуда Конспект с 189. Презентация, образцы природных соединений кремния §31 Таблицы С 188 42 Практическая работа «Получение соединений неметаллов и изучение их свойств» Практическая работа Химические реактивы и посуда С 187 43 Решение задач Урок применения знаний Учебник, таблицы Конспекть. 44 Обобщение и систематизация знаний по теме «Неметаллы» Обобщение и систематизация знаний по теме Учебник, таблицы §15-31 45 Контрольная работа по теме «Неметаллы» Контрольная работа Таблицы 46 Предмет органической химии. Особенности органических веществ Комбинированный Органическая химия. Органические вещества. Валентность. Органические кислоты, жиры, масла, вазелин, крахмал, сахароза, глюкоза §32 47 Теория строения органических соединений Комбинированный Теория строения органических соединений А.М.Бутлерова. значение органической химии Таблицы §32 конспект 48 Углеводороды: метан, этан, особенности физических и химических свойств Комбинированный Изомерия. Гомологические ряды и гомологи. Реакции дегидрирования Отдельные представители алканов §33 49 Этилен и его гомологи Комбинированный Реакции дегидратации, этилен, реакции полимеризации, мономеры, полимеры, непредельные углеводороды Образцы изделий из полиэтилена §34 50 Практическая работа «Изготовление моделей углеводородов» Практическая работа Шаростержневы е модели § 51 Решение задач и упражнений Урок применения знаний Таблицы, презентация § 52 Спирты. Метанол, этанол, этиленгликоль, глицерин Комбинированный Этиловый спирт, растительное масло, медная проволока, пробирки, стеклянная посуда §35 Спирты. Функциональная группа 53 Предельные одноосновные кислоты и их представители, свойства Комбинированный Карбоновые кислоты. Карбоксильная группа. Сложные эфиры Реактивы, индикаторная бумага §36 54 Предельные и непредельные кислоты. Жиры как сложные эфиры Комбинированный Реакции этерификации. Жиры. Предельные и непредельные жирные кислоты. Реактивы, индикатор, растительное масло, твердый животный жир, семена подсолнечника §36,37 55 Аминокислоты. Белки, свойства и биологические функции Комбинированный Белки. Витамины. Реакции поликонденсаци и. Пептидная связь Реактивы для ксантопротеинов ой реакции §38 56 Моносахариды, дисахариды, полисахариды Комбинированный Моносахариды, дисахариды, полисахариды Презентация, реактивы, образцы изучаемых углеводородов §39 57 Основные понятия химии ВМС. Краткий обзор важнейших полимеров Комбинированный Пластмассы, волокна Демонстрационн ые образцы полимеров и волокон §40 58 Решение задач и упражнений по теме «Органические вещества» Урок применения знаний Таблицы 59 Обобщение и систематизация знаний по теме «Органические вещества» Обобщение и систематизация Презентация, таблицы, конспект §32-40 60 Человек в мире Комбинированный веществ, материалов и химических реакций Химия вокруг нас Таблицы, дополнительный материал Конспект. 61 Проблема безопасного Комбинированный использования химических веществ в повседневной жизни Безопасное использование химических веществ в повседневной жизни Презентация, компьютер, полотно, проектор Конспект. 62 Химические элементы Комбинированный в клетках живых организмов Органические и неорганические элементы живых организмов Презентация, компьютер, полотно, проектор Конспект. 63 Практическая работа « Знакомство с образцами химических средств Химические средства санитарии и гигиены Практическая работа Биология. Презентация, компьютер, полотно, проектор санитарии и гигиены» 64 Калорийность важнейших компонентов пищи: белков, жиров, углеводов. Понятие о БАД Комбинированный Калорийность Презентация, компьютер, полотно, проектор Конспект. 65 Нефть, природный газ, их применение Комбинированный Нефть, газ Схемы, таблицы Конспект. 66 Виды химического загрязнения гидросферы, атмосферы, почвы и его последствия Комбинированный Химические загрязнения Презентация, компьютер, полотно, проектор Конспект. 67 Простые и сложные вещества. Строение органических веществ Комбинированный Химические вещества и их строение Презентация, компьютер, полотно, проектор Конспект. 68 Итоговый тест Итоговая контрольная работа 7.2. Положение о системе оценивания в предмете. Тесты Отметка «5»: - полно раскрыто содержание материала в объёме программы и учебника; - чётко и правильно даны определения и раскрыто содержание понятий, верно использованы - для доказательства использованы различные умения, выводы из наблюдений и опытов; - ответ самостоятельный. научные термины; Отметка «4»: - раскрыто содержание материала, правильно даны определения понятие и использованы научные термины, ответ самостоятельные, определения понятий неполные, допущены незначительные нарушения последовательности изложения, небольшие неточности при использовании научных терминов или в выводах, в обобщениях из наблюдений и опытов. Отметка «3»: - усвоено основное содержание учебного материала, но изложено фрагментарно; - не всегда последовательно определение понятии недостаточно чёткие; - не использованы выводы и обобщения из наблюдения и опытов, допущены ошибки при их изложении; - допущены ошибки и неточности в использовании научной терминологии, определении понятии. Отметка «2» - основное содержание учебного материала не раскрыто; не даны ответы на вспомогательные вопросы учителя; допущены грубые ошибка в определении понятие, при использовании терминологии. Отметка «1» - ответ па вопрос не дан. Оценка практических умений учащихся. Оценка умений ставить опыты Отметка «5»: - правильно определена цель опыта; - самостоятельно и последовательно проведены подбор оборудования и объектов, а также работа по закладке опыта; - научно, грамотно, логично описаны наблюдения и сформулированы выводы из опыта. Отметка «4»: - правильно определена цель опыта; самостоятельно проведена работа по подбору оборудования, объектов при закладке опыта допускаются; - 1-2 ошибки, в целом грамотно и логично описаны наблюдения, сформулированы основные выводы из опыта; - в описании наблюдении допущены неточности, выводы неполные. Отметка «3»: - правильно определена цель опыта, подбор оборудования и объектов, а также работы по закладке опыта проведены с помощью учителя; - допущены неточности я ошибка в закладке опыта, описании наблюдение, формировании выводов. Отметка «2»: - не определена самостоятельно цель опыта; не подготовлено нужное оборудование; - допущены существенные ошибки при закладке опыта и его оформлении. Отметка «1» - полное неумение заложить и оформить опыт. Оценка умений проводить наблюдения. Учитель должен учитывать: - правильность проведения; - умение выделять существенные признаки, логичность и научную грамотность в оформлении результатов наблюдение и в выводах. Отметка «5»: - правильно по заданию проведено наблюдение; выделены существенные признаке, логично, научно грамотно оформлены результаты наблюдения и выводы. Отметка «4»: - правильно по заданию проведено наблюдение, при выделении существенных признаков у наблюдаемого объекта (процесса), названы второстепенные; - допущена небрежность в оформлении наблюдений и выводов. Отметка «3»: - допущены неточности, 1-2 ошибка в проведении наблюдение по заданию учителя; - при выделении существенных признаков у наблюдаемого объекта (процесса) выделены лишь некоторые, допущены ошибки (1-2) в оформлении наблюдение и выводов. Отметка «2»: - допущены ошибки (3-4) в проведении наблюдение по заданию учителя; - неправильно выделены признака наблюдаемого объекта (процесса), допущены ошибки (3-4) в оформлении наблюдений и выводов. Отметка «1» - не владеет умением проводить наблюдение