Лекция 7. Титриметрический метод анализа. План
advertisement

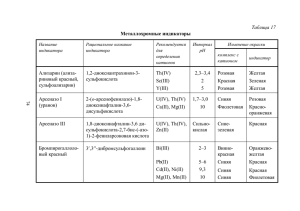
1. 2. 3. 4. 5. Лекция 7. Титриметрический метод анализа. План Сущность титриметрического метода анализа Классификация титриметрических методов анализа Расчеты в титриметрии. Стандартные и рабочие растворы Погрешности титриметрического метода Построение кривых титрования. Титриметрический метод анализа основан на том, что вещества реагируют друг с другом в эквивалентных количествах: n1 = n2 где n1 и n2 количества вещества 1 и 2, [n]= моль n = C·V где C молярная концентрация эквивалента;·V объем раствора [V]= л Тогда для двух стехиометрически реагирующих веществ справедливо соотношение: C1·V1 = C2·V2 Титриметрический анализ – метод определения количества вещества путем точного измерения объема растворов веществ, вступающих между собой в реакцию. Титр – количество г вещества содержащегося в 1 мл раствора или эквивалентное определяемому веществу. Например, если титр H2SO4 равен 0,0049 г/мл, это значит, что каждый мл раствора содержит 0,0049 г. серной кислоты. Раствор, титр которого известен, называется титрованным Титрование – процесс добавления к исследуемому раствору или его аликвотной части эквивалентного количества титрованного раствора. При этом используются стандартные растворы – растворы с точной концентрацией вещества (Na2CO3, HCl). Реакция титрования должна отвечать следующим требованиям: 1) Реакция должна протекать количественно, быть строго стехиометричной 2) Реакция должна протекать с высокой скоростью; 3) Реакция должна протекать до конца, должны отсутствовать конкурирующие процессы; 4) Для данной реакции должен существовать удобный способ фиксирования конца реакции (точки эквивалентности). Например, кислотно-основное титрование: HCl + NaOH → NaCl + H2O (индикатор метилоранж) Классификация методов титриметрического анализа. Классифицировать титриметрические методы анализа можно по нескольким признакам. Например, по типу основной реакции, протекающей при титровании: 1) кислотно-основное титрование (нейтрализация): H3O+ + OH- ↔ 2H2O этим методом определяют количество кислоты или щёлочи в анализируемом растворе; а) ацидиметрия б) алкалиметрия 2) окислительно-восстановительное титрование (редоксиметрия): Ox1 + Red2 ↔ Ox2 + Red1 а) перманганатометрия (KMnO4); б) йодометрия (I2); в) броматометрия (KBrO3); г) дихроматометрия (K2Cr2O7); д) цериметрия (Ce(SO4)2); е) ванадометрия (NH4VO3); ж) титанометрия (TiCl3) и т.д. 3) осадительное титрование: Me + X ↔ MeX↓ а) аргентометрия Ag+ + Cl- AgCl б) меркурометрия 4) комплексометрическое титрование Mem+ + nL ↔ [Me(L)n]m+ а) меркуриметрия б) комплексонометрия (ЭДТА) Главная задача титриметрического анализа – не только использовать раствор точно известной концентрации, но и правильно определить точку эквивалентности. Существует несколько способов зафиксировать точку эквивалентности: 1. По собственной окраске ионов определяемого элемента, например перманганат ионы MnO4- имеют малиновую окраску 2. С помощью индикаторов например, при реакции нейтрализации используют кислотно-щелочные индикаторы: лакмус, фенолфталеин, метил оранж – органические соединения изменяющие окраску при переходе от кислой к щелочной среде. Индикаторы – органические красители, которые меняют свою окраску при изменении кислотности среды. Схематически (опуская промежуточные формы) равновесие индикатора можно представить как кислотно-основную реакцию HIn +H2O In- + H3O+ H2O H+ + OHH+ + H2O H3O+ На область перехода окраски индикатора (положение и интервал) влияют все факторы, от которых зависит константа равновесия (ионная сила, температура, посторонние вещества, растворитель), а также индикатора. 3. По веществу-свидетелю Пример: Ag+ + Cl- AgCl Ag+ + CrO4 Ag2CrO4 (ярко оранжевая окраска) В колбу, где требуется определить ион хлора, добавляют небольшое количество соли K2CrO4 (свидетель). Затем из бюретки постепенно добавляют исследуемое вещество, при этом первыми в реакцию вступают ионы хлора и образуется белый осадок (AgCl), т. е. ПР AgCl << ПР Ag2Cr O4. Таким образом, лишняя капля нитрата серебра даст ярко оранжевую окраску, т. к. весь хлор уже прореагировал. Способы титрования. 1. прямое титрование, при прямом титровании титрант непосредственно добавляют к титруемому веществу. Такой способ применим только при выполнении всех требований, перечисленных выше. 2. обратное титрование (с избытком), используется при медленно протекающей реакции. Если скорость реакции мала, или не удается подобрать индикатор, или наблюдаются побочные эффекты, например потери определяемого вещества вследствие летучести, можно использовать прием обратного титрования: добавить к определяемому веществу заведомый избыток титранта Т1, довести реакцию до конца, а затем найти количество непрореагировавшего титранта титрованием его другим реагентом Т2 с концентрацией С2. очевидно, что на определяемое вещество затрачивается количество титранта Т1, равное разности СТ1VT1 = СT2VT2. 3. косвенное титрование (по замещению), применяется при анализе органических соединений. Если реакция нестехиометрична или протекает медленно, то используют титрование заместителя, для чего проводят химическую реакцию определяемого вещества с вспомогательным реагентом, а получающийся в эквивалентном количестве продукт оттитровывают подходящим титрантом. Способы выражения концентрации раствора. Молярная концентрация – моль/ л 1М – в 1 литре находится 1 г/моль вещества Молярная концентрация эквивалентов (нормальные растворы) (раствор должен содержать в 1 л заданное число эквивалентных масс). Химическим эквивалентом называется количество вещества эквивалентное одному г атома водорода. Титр раствора Т Титр по рабочему веществу: T m вещ -ва [ г/мл] 1000 49 0,049 [г/мл] 1000 Титр по рабочему веществу надо перевести в титр по определяемому веществу, воспользовавшись фактором пересчёта: Tonp = Tраб· F Т Пример: HCl NaOH NaCl H 2 O F Mэ NaOH Мэ HCl Основные уравнения для титриметрического анализа С1 ·V1 = Сx ·V x, где С1 – молярная концентрация эквивалента (нормальность титранта) V1 – количество раствора, которое вылили из бюретки для химической реакции С xV x – характеристика искомого вещества Сx С1V1 Vx % вещ -ва опр. ·Vх 100% а а – навеска анализируемого вещества Стандартные и рабочие растворы Титрант с известной концентрацией называют стандартным раствором. По способу приготовления различают первичные и вторичные стандартные растворы. Первичный стандартный раствор готовят растворением точно количества химически чистого вещества известного стехиометрического состава в определенном объеме растворителя. Вторичный стандартный раствор получают следующим образом: готовят раствор с приблизительной концентрацией и определяют его концентрацию (стандартизируют) по подходящему первичному стандарту. Первичные стандартные вещества должны отвечать ряду требований: 1. Состав вещества должен строго соответствовать химической формуле. Содержание примесей менее 0,05% 2. Вещество должно быть устойчивым при комнатной температуре, быть не гигроскопичным, не окисляться кислородом воздуха, не поглощать углекислый газ, быть не летучим. 3. Вещество должно иметь достаточно высокую молекулярную массу, чтобы уменьшить погрешность при взвешивании. Для приготовления первичных стандартных раствором можно воспользоваться фиксаналом – ампулой, в которой запаяно известное количество стандартного вещества или раствора.