ХИМИЯ (физическая и коллоидная)
advertisement
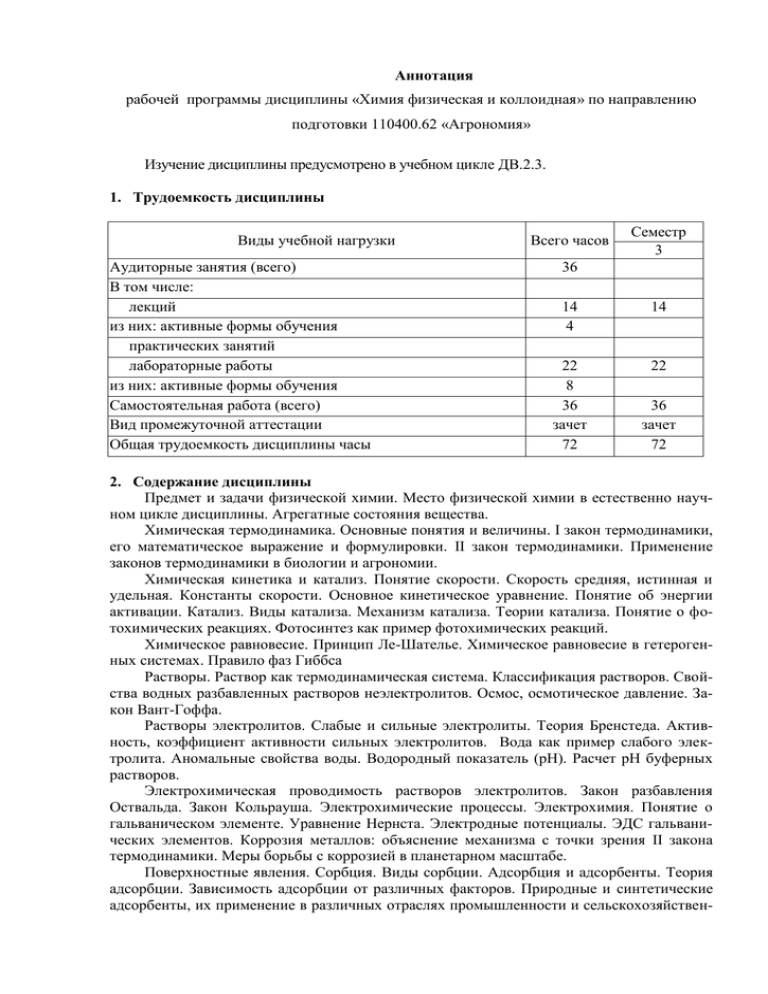
Аннотация рабочей программы дисциплины «Химия физическая и коллоидная» по направлению подготовки 110400.62 «Агрономия» Изучение дисциплины предусмотрено в учебном цикле ДВ.2.3. 1. Трудоемкость дисциплины Виды учебной нагрузки Аудиторные занятия (всего) В том числе: лекций из них: активные формы обучения практических занятий лабораторные работы из них: активные формы обучения Самостоятельная работа (всего) Вид промежуточной аттестации Общая трудоемкость дисциплины часы Всего часов Семестр 3 36 14 4 14 22 8 36 зачет 72 22 36 зачет 72 2. Содержание дисциплины Предмет и задачи физической химии. Место физической химии в естественно научном цикле дисциплины. Агрегатные состояния вещества. Химическая термодинамика. Основные понятия и величины. I закон термодинамики, его математическое выражение и формулировки. II закон термодинамики. Применение законов термодинамики в биологии и агрономии. Химическая кинетика и катализ. Понятие скорости. Скорость средняя, истинная и удельная. Константы скорости. Основное кинетическое уравнение. Понятие об энергии активации. Катализ. Виды катализа. Механизм катализа. Теории катализа. Понятие о фотохимических реакциях. Фотосинтез как пример фотохимических реакций. Химическое равновесие. Принцип Ле-Шателье. Химическое равновесие в гетерогенных системах. Правило фаз Гиббса Растворы. Раствор как термодинамическая система. Классификация растворов. Свойства водных разбавленных растворов неэлектролитов. Осмос, осмотическое давление. Закон Вант-Гоффа. Растворы электролитов. Слабые и сильные электролиты. Теория Бренстеда. Активность, коэффициент активности сильных электролитов. Вода как пример слабого электролита. Аномальные свойства воды. Водородный показатель (рН). Расчет рН буферных растворов. Электрохимическая проводимость растворов электролитов. Закон разбавления Оствальда. Закон Кольрауша. Электрохимические процессы. Электрохимия. Понятие о гальваническом элементе. Уравнение Нернста. Электродные потенциалы. ЭДС гальванических элементов. Коррозия металлов: объяснение механизма с точки зрения II закона термодинамики. Меры борьбы с коррозией в планетарном масштабе. Поверхностные явления. Сорбция. Виды сорбции. Адсорбция и адсорбенты. Теория адсорбции. Зависимость адсорбции от различных факторов. Природные и синтетические адсорбенты, их применение в различных отраслях промышленности и сельскохозяйствен- ного производства, их роль в достижении экологического равновесия в современном мире. Дисперсные системы, их классификация. Характеристика коллоидных растворов как пример дисперсной системы. Классификация коллоидных растворов. Получение коллоидных растворов. Строение коллоидной частицы (мицеллы). Свойства лиофобных коллоидных растворов. Броуновское движение, осмотическое давление, оптические свойства. Устойчивость и коагуляция коллоидных растворов. Причины и механизм коагуляции. Правило Шульце-Гарди. Защита золей от коагуляции. Теория Зигмонди. Аэрозоли. Эмульсии. Суспензии, порошки, их характеристика, способы получения. Природные и искусственные микрогетерогенные системы. Структурированные коллоидные системы. Растворы высокомолекулярных соединений (ВМС). Примеры химических реакций, лежащих в основе получения полимеров. Природные полимеры. Основные свойства растворов ВМС. Изоэлектрическая точка белков. Набухание и растворение ВМС. Изменение энтальпийного и энтропийного факторов. При набухании и полном растворении полимеров. Степень набухания в жизнедеятельности животных и растительных организмов. 3. Цели и задачи дисциплины: Целью изучения физической химии является изучение взаимосвязи химических и физических явлений, знакомство с теоретическими и экспериментальными методами. Физическая химия выполняет общие закономерности химических реакций и физических явлений; изучает механизм химических реакций. Конечной целью изучения является возможность управления химическими процессами, предсказание направления и возможности протекания реакций в конкретных условиях. Коллоидная химия изучает дисперсные системы, среди которых важное место отведено коллоидным растворам и микрогетерогенным системам. Задачами дисциплины является изучение: - применение законов физической и коллоидной химии для практического использования в современных технологических процессах. 4. Место дисциплины в структуре ООП: дисциплина «Химия физическая и коллоидная» относится к циклу естественнонаучных дисциплин. Для ее изучения необходимы знания, умения и навыки по неорганической и аналитической химии, физике и математике в объеме, предусмотренном государственным образовательным стандартом. Предшествующие дисциплины: химия неорганическая и аналитическая, химия органическая, ботаника. Последующие дисциплины: химия тяжёлых металлов, экология, физиология растений. 5.Требования к результатам освоения дисциплины В результате освоения дисциплины обучающийся должен: знать: Историю науки, выдающихся ученых, научные исследования и открытия которых послужили формированию химии как науки, Основные термодинамические понятия и величины, Математическое выражение и формировки законов термодинамики, Применение 2-го закона термодинамики для объяснения наиболее важных природных явлений и процессов: растворимости, осмоса, коррозии металлов, коагуляции, набухания и др., Знать классификацию растворов, значение растворов для жизнедеятельности растений, животных и человека, для промышленного производства, Аномальные свойства воды, состав и свойства буферных растворов, рН и рОН, методы исследования свойств буферных растворов, Электродные процессы, их кинетику и термодинамику; Основные процессы коллоидных систем, строение мицеллы, коагуляцию, порог коагуляции, правило Шульце-Гарди, способы защиты золей от коагуляции, Свойства растворов высокомолекулярных растворов (ВМС), набухание, степень набухания. уметь: Применить знание термодинамики к объяснению важнейших процессов и явлений, Сделать расчеты константы скорости, теплового эффекта реакции, рН раствора, осмотического давления, констант равновесия Кс и Кр, порога коагуляции, степени набухания полимеров, Построить график зависимости, например адсорбции от концентрации и др., Решать задачи, Формулировать законы и уметь их применять, Обобщать и делать выводы по результатам эксперимента, Уметь работать с учебной, методической и научной литературой, Написать реферат и подготовить доклад к научной студенческой конференции. владеть: приемами и методами безопасной работы в химической лаборатории, обращаться с химической посудой, реактивами, приборами, самостоятельно работать с учебной, научной и справочной литературой, делать обобщающие выводы. Выпускник должен обладать следующими общекультурными и профессиональными компетенциями: ОК-1; ОК-2; ОК-3; ОК-6; ОК-8; ОК-11; ПК-1; ПК-25; ПК-26. Разработчик: доцент кафедры химии, к.с.х.н. Е.Г.Прудникова