doc помощь по шагам Размер: 452 кБ
advertisement
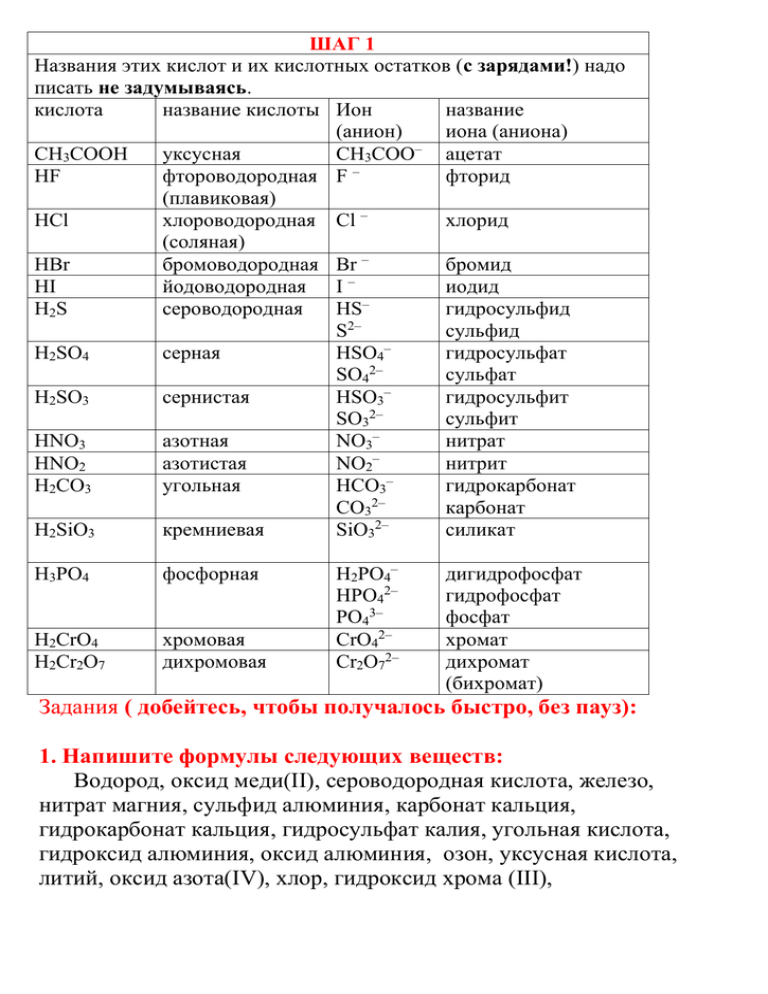
ШАГ 1 Названия этих кислот и их кислотных остатков (с зарядами!) надо писать не задумываясь. кислота название кислоты Ион название (анион) иона (аниона) – CH3COOH уксусная CH3COO ацетат HF фтороводородная F – фторид (плавиковая) HCl хлороводородная Cl – хлорид (соляная) HBr бромоводородная Br – бромид – HI йодоводородная I иодид H2S сероводородная HS– гидросульфид 2– S сульфид – H2SO4 серная HSO4 гидросульфат 2– SO4 сульфат – H2SO3 сернистая HSO3 гидросульфит 2– SO3 сульфит HNO3 азотная NO3– нитрат HNO2 азотистая NO2– нитрит – H2CO3 угольная HCO3 гидрокарбонат 2– CO3 карбонат H2SiO3 кремниевая SiO32– силикат H3PO4 фосфорная H2CrO4 Н2Cr2O7 хромовая дихромовая H2PO4– HPO42– PO43– CrO42– Cr2O72– дигидрофосфат гидрофосфат фосфат хромат дихромат (бихромат) Задания ( добейтесь, чтобы получалось быстро, без пауз): 1. Напишите формулы следующих веществ: Водород, оксид меди(II), сероводородная кислота, железо, нитрат магния, сульфид алюминия, карбонат кальция, гидрокарбонат кальция, гидросульфат калия, угольная кислота, гидроксид алюминия, оксид алюминия, озон, уксусная кислота, литий, оксид азота(IV), xлор, гидроксид хрома (III), йодоводородная кислота, нитрит натрия, хлорид железа (II), пероксид водорода, аммиак, азотистая кислота. 2. Назовите вещества CH3COOH KH2PO4 CuSO4 FeCl3 SiO2 KMnO4 ZnS H2SO4 Na2O NaHCO3 KI Ba(NO3)2 BaO NaNO2 Al2O3 SO2 NaOH Na2S CO2 AgNO3 SO3 CH3COONa КОН Na2SO3 Cl2 Na2SO3 N2 HNO3 HBr H3PO4 ШАГ 2 СОЛЕОБРАЗУЮЩИЕ ОКСИДЫ Названия кислородсодержащих кислот состоят из двух частей: собственного названия кислоты, выраженного прилагательным, и группового слова кислота (серная кислота, фосфорная кислота). Собственное название кислоты образуется от русского названия кислотообразующего элемента путём добавления различных суффиксов: -н-, -ов-, -ев- (если элемент находится в единственной или высшей степени окисления); промежуточная степень окисления +5 обозначается суффиксом -новат- (хлорноватая кислота HClO3, бромноватая кислота HBrO3, иодноватая кислота HIO3); промежуточные степени окисления +3 и +4 обозначаются суффиксом -(ов)ист- (мышьяковистая кислота HAsO2, хлористая кислота HClO2); степень окисления +1 обозначается суффиксом новатист- (азотноватистая кислота H2N2O2, хлорноватистая кислота HClO). Если кислотообразующий элемент в двух кислотах находится в одной и той же степени окисления, но кислоты отличаются по «содержанию воды», то для кислоты с меньшим содержанием кислорода к названию добавляют приставку мета-, а для кислоты с большим содержанием кислорода — приставку орто-, например,метафосфорная кислота HPO3 и ортофосфорная кислота H3PO4. Кислородсодержащие кислоты с несколькими кислотообразующими элементами называются изополикислотами. Их обычно называют традиционными названиями (дифосфорная кислота H4P2O7, дисерная кислота H2S2O7). Кислоты, в которых атомы кислорода заменены на атомы серы, называются тиокислотами и имеют соответствующую приставку тио- (тиофосфорная кислота H3PO3S, тиосерная кислота H2S2O3) Названия солей бескислородных кислот, как и всех бинарных, т.е. состоящих из двух элементов соединений, образуются из корня латинского названия неметалла, к которому добавляется суффикс - ид, и русского названия металла. Традиционные названия солей состоят из названий анионов в именительном падеже и названий катионов в родительном падеже. Названия анионов строятся на основе названий кислотообразующих элементов. Если кислотообразующий элемент может иметь одну степень окисления, то к его названию добавляют суффикс -ат: CO32- — карбонат, GeO32- — германат. Если кислотообразующий элемент может принимать две степени окисления, то для аниона, образованного этим элементом в более высокой степени окисления, применяют суффикс -ат, а для аниона с элементов в меньшей степени окисления — суффикс -ит: SO42- — сульфат NO3- — нитрат SO32- — сульфит NO2- — нитрит Если элемент может принимать три степени окисления, то для высшей, средней и низшей степени окисления используют соответственно суффиксы -ат, -ит и суффикс -ит с приставкой гипо-. Наконец, в случае элементов, принимающих четыре степени окисления, для высшей степени окисления применяют приставку пер- и суффикс -ат, далее (в порядке понижения степени окисления) суффикс -ат, суффикс -ит и суффикс -ит с приставкой гипо-: +7 ClO4- — перхлорат +5 ClO3- — хлорат +3 ClO2- — хлорит +1 ClO- — гипохлорит Названия кислых солей образуются путём добавления приставки гидро- к названию аниона. Если на один анион приходится больше одного атома водорода, то его количество указывают при помощи умножающей приставки (NaHCO3 — гидрокарбонат натрия, NaH2PO4 — дигидрофосфат натрия). Аналогично, для образования названий основных солей используются приставки гидроксо- ((FeOH)NO3 — гидроксонитрат железа(II))
