Зачеты по химии
advertisement
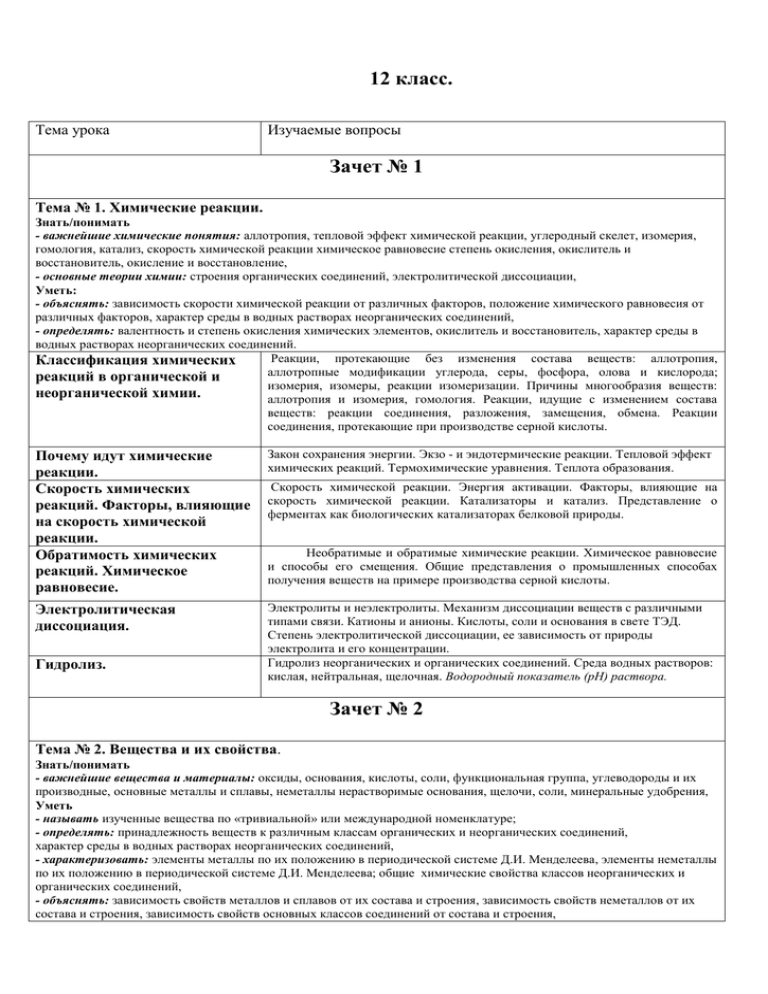
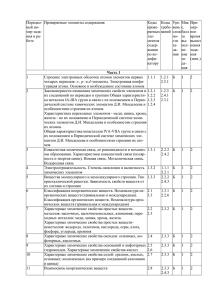
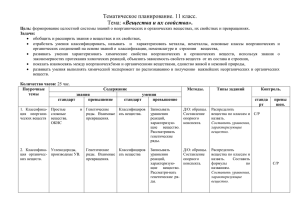
12 класс. Тема урока Изучаемые вопросы Зачет № 1 Тема № 1. Химические реакции. Знать/понимать - важнейшие химические понятия: аллотропия, тепловой эффект химической реакции, углеродный скелет, изомерия, гомология, катализ, скорость химической реакции химическое равновесие степень окисления, окислитель и восстановитель, окисление и восстановление, - основные теории химии: строения органических соединений, электролитической диссоциации, Уметь: - объяснять: зависимость скорости химической реакции от различных факторов, положение химического равновесия от различных факторов, характер среды в водных растворах неорганических соединений, - определять: валентность и степень окисления химических элементов, окислитель и восстановитель, характер среды в водных растворах неорганических соединений. Реакции, протекающие без изменения состава веществ: аллотропия, Классификация химических аллотропные модификации углерода, серы, фосфора, олова и кислорода; реакций в органической и изомерия, изомеры, реакции изомеризации. Причины многообразия веществ: неорганической химии. аллотропия и изомерия, гомология. Реакции, идущие с изменением состава веществ: реакции соединения, разложения, замещения, обмена. Реакции соединения, протекающие при производстве серной кислоты. Почему идут химические реакции. Скорость химических реакций. Факторы, влияющие на скорость химической реакции. Обратимость химических реакций. Химическое равновесие. Закон сохранения энергии. Экзо - и эндотермические реакции. Тепловой эффект химических реакций. Термохимические уравнения. Теплота образования. Электролитическая диссоциация. Электролиты и неэлектролиты. Механизм диссоциации веществ с различными типами связи. Катионы и анионы. Кислоты, соли и основания в свете ТЭД. Степень электролитической диссоциации, ее зависимость от природы электролита и его концентрации. Гидролиз неорганических и органических соединений. Среда водных растворов: кислая, нейтральная, щелочная. Водородный показатель (рН) раствора. Гидролиз. Скорость химической реакции. Энергия активации. Факторы, влияющие на скорость химической реакции. Катализаторы и катализ. Представление о ферментах как биологических катализаторах белковой природы. Необратимые и обратимые химические реакции. Химическое равновесие и способы его смещения. Общие представления о промышленных способах получения веществ на примере производства серной кислоты. Зачет № 2 Тема № 2. Вещества и их свойства. Знать/понимать - важнейшие вещества и материалы: оксиды, основания, кислоты, соли, функциональная группа, углеводороды и их производные, основные металлы и сплавы, неметаллы нерастворимые основания, щелочи, соли, минеральные удобрения, Уметь - называть изученные вещества по «тривиальной» или международной номенклатуре; - определять: принадлежность веществ к различным классам органических и неорганических соединений, характер среды в водных растворах неорганических соединений, - характеризовать: элементы металлы по их положению в периодической системе Д.И. Менделеева, элементы неметаллы по их положению в периодической системе Д.И. Менделеева; общие химические свойства классов неорганических и органических соединений, - объяснять: зависимость свойств металлов и сплавов от их состава и строения, зависимость свойств неметаллов от их состава и строения, зависимость свойств основных классов соединений от состава и строения, - выполнять химический эксперимент: по распознаванию важнейших неорганических и органических классов соединений, - характеризовать: общие химические свойства металлов, неметаллов, основных классов соединений, - выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ, Классификация неорганических веществ. Классификация органических веществ Металлы. Коррозия металлов. Общие свойства получения металлов. Простые и сложные вещества. Оксиды, их классификация. Гидроксиды (основания, кислородные кислоты, амфотерные гидроксиды). Кислоты, их классификация. Соли средние, кислые, основные. Углеводороды, их классификация. Производные углеводородов, их классификация. Положение металлов в ПСХЭ Д.И. Менделеева. Общие физические свойства металлов. Взаимодействие металлов с неметаллами (хлором, серой, кислородом). Взаимодействие щелочных и щелочноземельных металлов с водой. Электрохимический ряд напряжений металлов, взаимодействие металлов с растворами кислот и солей. Общие способы получения металлов. Понятие о коррозии металлов, способы защиты от коррозии. Сплавы Металлы в прирде. Металлургия: пиро-, гидро-, и электрометаллургия. Электролиз расплавов и растворов металлов, его практическое применение. Зачет № 3 Неметаллы. Положение неметаллов в ПСХЭ Д.И. Менделеева. Сравнительная характеристика галогенов как наиболее типичных представителей неметаллов. Окислительные свойства неметаллов (взаимодействие с металлами и водородом). Восстановительные свойства неметаллов (взаимодействие с более электроотрицательными неметаллами). Благородные газы. Кислоты органические и неорганические. Кислоты неорганические и органические. Классификация кислот. Химические свойства кислот: взаимодействие с металлами, основными оксидами, основаниями, солями, спиртами. Основания органические и неорганические. Классификация оснований. Химические свойства оснований: взаимодействие с кислотами, кислотными оксидами и солями. Разложение нерастворимых оснований Амфотерные соединения в свете протолитической теории. Амфотерность оксидов и гидроксидов переходных металлов, взаимодействие с кислотами и щелочами. Амфотерность аминокислот. Амфотерные органические и неорганические основания. Зачет № 4 Генетическая связь между классами органических и неоганических соединений. Понятие о генетической связи и генетических рядах в неорганической и органической химии. Генетический ряд металла. Генетический ряд неметалла. Особенности генетического ряда в органической химии Зачет № 5 Тема № 3. Химия в жизни общества. Знать/понимать - важнейшие понятия: химическая промышленность, экология, минеральные удобрения, СМС, средства бытовой химии, лекарства, Уметь - использовать приобретенные знания и умения в практической деятельности и повседневной жизни для: объяснения химических явлений, происходящих на производстве; определения возможности протекания химических превращений в различных условиях и оценки их последствий, Уметь - использовать приобретенные знания и умения в практической деятельности и повседневной жизни: для экологически грамотного поведения в окружающей среде; оценки влияния химического загрязнения ОС на организм человека и другие живые организмы Химия и производство. Химия и сельское хозяйство. Химия и экология. Химия и повседневная жизнь человека. 1.химическая промышленность и хим. технологии, 2.сырье для химичекой промышленности, 3.энергия для химического производства, 4.защита окружающей среды. Общие представления о промышленных способах получения химических веществ на примере производства серной кислоты 1. химизация сельского хозяйства, 2. удобрения, их классификация, 3. хим. средства защиты растений, 4. отрицательные последствия применения пестицидов и борьба с ними, 5. химизация животноводства. 1.химическое загрязнение окружающей среды и его последствия, 2.охрана гидросферы, почвы и атмосферы от химического загрязнения. 1.домашняя аптечка, 2.моющие и чистящие средства, правила безопасной работы со средствами бытовой химии. 3. химические вещества как строительные и поделочные материалы. 4. вещества, используемые в полиграфии, живописи, скульптуре, архитектуре, бытовая химическая грамотность.