Синтез и исследование свойств азидсодержащих
advertisement
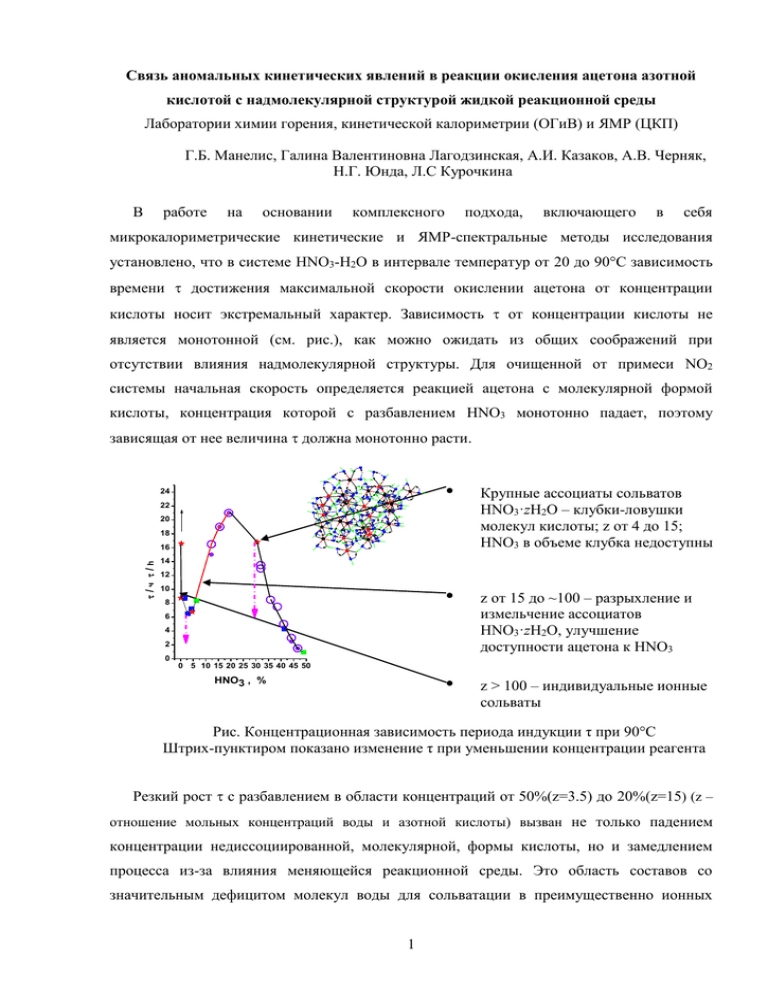
Связь аномальных кинетических явлений в реакции окисления ацетона азотной кислотой с надмолекулярной структурой жидкой реакционной среды Лаборатории химии горения, кинетической калориметрии (ОГиВ) и ЯМР (ЦКП) Г.Б. Манелис, Галина Валентиновна Лагодзинская, А.И. Казаков, А.В. Черняк, Н.Г. Юнда, Л.С Курочкина В работе на основании комплексного подхода, включающего в себя микрокалориметрические кинетические и ЯМР-спектральные методы исследования установлено, что в системе HNO3-H2O в интервале температур от 20 до 90С зависимость времени достижения максимальной скорости окислении ацетона от концентрации кислоты носит экстремальный характер. Зависимость от концентрации кислоты не является монотонной (см. рис.), как можно ожидать из общих соображений при отсутствии влияния надмолекулярной структуры. Для очищенной от примеси NO2 системы начальная скорость определяется реакцией ацетона с молекулярной формой кислоты, концентрация которой с разбавлением HNO3 монотонно падает, поэтому зависящая от нее величина должна монотонно расти. 24 22 • Крупные ассоциаты сольватов HNO3·zH2O – клубки-ловушки молекул кислоты; z от 4 до 15; HNO3 в объеме клубка недоступны • z от 15 до ~100 – разрыхление и измельчение ассоциатов HNO3·zH2O, улучшение доступности ацетона к HNO3 • z > 100 – индивидуальные ионные сольваты 20 18 / ч / h 16 14 12 10 8 6 4 2 0 0 5 10 15 20 25 30 35 40 45 50 HNO3 , % Рис. Концентрационная зависимость периода индукции τ при 90°С Штрих-пунктиром показано изменение τ при уменьшении концентрации реагента Резкий рост с разбавлением в области концентраций от 50%(z=3.5) до 20%(z=15) (z – отношение мольных концентраций воды и азотной кислоты) вызван не только падением концентрации недиссоциированной, молекулярной, формы кислоты, но и замедлением процесса из-за влияния меняющейся реакционной среды. Это область составов со значительным дефицитом молекул воды для сольватации в преимущественно ионных 1 комплексах, что должно приводить к их ассоциации. Такие ассоциаты ионных комплексов могут образовывать запутанные Н-связанные наноразмерные клубки. Тогда молекулярная форма HNO3 со временем жизни около 1пс, возникающая в процессе динамического равновесия внутри клубка-ловушки, оказывается недоступной для встречи с реагентом – ацетоном – вне клубка. Это приводит к торможению реакции и росту в этой области составов системы. При дальнейшем разбавлении HNO3 водой в интервале концентраций от 20% (z≈15) до 6% (z≈50) наблюдается аномальный эффект: уменьшение несмотря на падение концентрации молекулярной формы кислоты, что в рамках наших представлений связано с частичным разрушением и разрыхлением ассоциатов ионных комплексов при обогащении их водой, высвобождением молекул HNO3 и увеличением доступности реагентов друг к другу. Участок составов ниже 5% (z>100) с большим количеством воды, чем необходимо для полной сольватации ионов, характеризует резкий рост с разбавлением, вызванный практически полной диссоциацией кислоты на отдельные сольваты протона и аниона и ничтожной убывающей равновесной концентрацией молекулярной HNO3. Для оценки влияния ацетона на надмолекулярную структуру реакционной системы изучены спектры ЯМР 1Н в зависимости от концентрации ацетона. Обнаружены резкие изменения ХС в области концентраций ацетона ниже 1%, что свидетельствует об ослаблении структурирования как за счет уменьшения доли ассоциатов больших размеров, так и о разрушении агрегации ацетона, увеличивая количество реагирующих частиц. Это должно ускорять реакцию и приводить к уменьшению , что и подтвердили кинетические эксперименты (см. рис.). Из полученных в настоящей работе данных следует, что аномальные явления в кинетике окисления ацетона водными растворами азотной кислоты связаны с изменяющейся надмолекулярной организацией реакционной среды, включающей ионные и/или молекулярные комплексы азотной кислоты с водой, их ассоциацию, агрегацию ацетона и их взаимное влияние. Мы полагаем, что работа с концентрациями ацетона ниже 0.1% позволит, избавившись от влияния агрегации ацетона, разделить эффекты, что упростит картину и будет способствовать количественному описанию аномальных кинетических эффектов и их связи с супрамолекулярной структурой реакционной среды. 2






