Календарное тематическое планирование уроков химии в 9 классе
advertisement
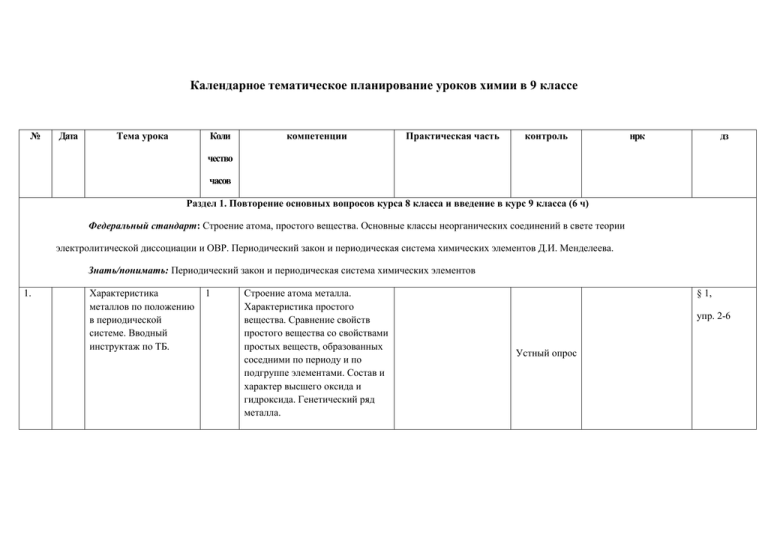
Календарное тематическое планирование уроков химии в 9 классе № Дата Тема урока Коли компетенции Практическая часть контроль нрк дз чество часов Раздел 1. Повторение основных вопросов курса 8 класса и введение в курс 9 класса (6 ч) Федеральный стандарт: Строение атома, простого вещества. Основные классы неорганических соединений в свете теории электролитической диссоциации и ОВР. Периодический закон и периодическая система химических элементов Д.И. Менделеева. Знать/понимать: Периодический закон и периодическая система химических элементов 1. Характеристика металлов по положению в периодической системе. Вводный инструктаж по ТБ. 1 Строение атома металла. Характеристика простого вещества. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду и по подгруппе элементами. Состав и характер высшего оксида и гидроксида. Генетический ряд металла. § 1, упр. 2-6 Устный опрос 2. 3. 4 Свойства оксидов, кислот, оснований и солей в свете теории электролитической диссоциации и процессов окислениявосстановления 1 Генетические ряды металлов и неметаллов 1 Переходные элементы. 1 Строение атомов неметаллов. Характеристика простого вещества. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду и по подгруппе элементами. Состав и характер высшего оксида и гидроксида, состав летучего водородного соединения. Генетический ряд неметалла. Понятие о переходных элементах. Амфотерность. Генетический ряд переходного элемента. Зависимость свойств оксидов и гидроксидов переходных элементов от степени окисления (для хрома). § 1, упр.7, 8, 10 Устный опрос Л.о.1. Получение и изучение свойств гидроксида цинка. § 2, Устный опрос Устный опрос упр. 3 5 6 Периодический закон и периодическая система химических элементов Д.И. Менделеева. 1 Контрольная работа по теме “Повторение основных вопросов курса 8 класса. Введение в курс 9 класса». 1 Периодический закон и периодическая система химических элементов Д. И. Менделеева в свете учения о строении атома. Значение периодического закона. Физический смысл порядкового номера элемента, номера группы и периода. Закономерность изменения свойств элементов в образованных ими веществах в пределах периода и группы §3 Характеристика свойств основных классов веществ, в свете ТЭД и окислительновосстановительных реакций. Осуществление цепочек превращений § 1-3 упр.4,5, 6, 7 Контрольная работа зад. в тетр. Раздел 2. Металлы. (15 ч ) Федеральный стандарт: Свойства простых веществ металлов. Щелочные и щелочно-земельные металлы и их соединения. Алюминий. Амфотерность оксида и гидроксида алюминия. Железо. Оксиды, гидроксиды и соли железа. Уметь: характеризовать химические элементы - металлы на основе их положения в периодической системе Д.И.Менделеева и особенностей строения их атомов; связь между строением и свойствами металлов; химические свойства основных групп металлов. Использовать приобретенные знания и умения в практической деятельности и повседневной жизни для: безопасного обращения с веществами и материалами; экологически грамотного поведения в окружающей среде; 7 8 9 10 Положение металлов в периодической системе Д.И.Менделеева Физические свойства металлов Сплавы. Химические свойства металлов 1 1 1 1 1. Металлопроизводство на Южном Урале Значение металлов в жизни человеческой цивилизации. Деление элементов на металлы и неметаллы. Особенности строения атомов металлов и характерное свойство металлов – восстановительная способность. § 4 упр.2-4 Устный опрос Физические свойства металлов: пластичность, электро- и теплопроводность, металлический блеск, плотность, твердость и др. Л.о.2. Ознакомление с образцами металлов Металлы черные и цветные. Драгоценные металлы. Сплавы как системы металлов другими металлами и неметаллами. Особенности свойств сплавов. Классификация сплавов с Д.о. Образцы сплавов. Взаимодействие металлов с кислородом, неметаллами, водой. Особенности взаимодействия металлов с растворами кислот и солей. Использование таблицы растворимости для прогнозирования этих свойств. Л.о.3. Взаимодействие металлов с растворами кислот и солей. § 5, упр.2,3 Устный опрос 2. Производство чугуна и стали на металлургических предприятиях области Устный опрос § 6, 7 упр. 2,4 § 8, упр.2,3, 5, 7 Самост. работа 11 12 13 Получение металлов. Щелочные металлы. Соединения щелочных металлов. 1 1 1 Металлы в природе. Руды металлов. Пиро-, гидро- и электрометаллургия, микробиологическая металлургия. Понятие о коррозии металлов и сплавов. Д.о. Коллекции образцов руд черных и цветных металлов. Общая характеристика щелочных Д.оВзаимодействие металлов. Металлы в природе. натрия, лития с водой. Общие способы их получения. Строение атомов. Щелочные металлы — простые вещества, их физические и химические свойства. Важнейшие соединения щелочных металлов — оксиды, гидроксиды и соли (хлориды, карбонаты, сульфаты, нитраты), их свойства и применение в народном хозяйстве. Л.о.4. Коллекция образцов природных соединений щелочных металлов. 3. Устный опрос Гидрометаллургические и пирометал-лургические основы получения металлов на предприятиях Урала. §9 упр. 6 § 10 консп. Работа в группах § 11, упр. 1,2, 5 14 15 Щелочноземельные металлы. Соединения щелочноземельных металлов 1 1 Общая характеристика элементов главной подгруппы II группы. Строение атомов. Щелочноземельные металлы — простые вещества, их физические и химические свойства. Д.о Образцы щелочноземельных металлов. Взаимодействие кальция с водой. 4. Запасы известняка, доломита, фосфоритов на Южном Урале. Работа в группах Л.о.5. Ознакомление с образцами природных соединений кальция. Важнейшие соединения щелочноземельных металлов — оксиды, гидроксиды и соли (хлориды, карбонаты, нитраты, сульфаты и фосфаты), их свойства и § 12, упр.4,5 Значение Ca, Mg для здоровья живых организмов. 5. Применение различных соединений кальция и магния в различных областях строительства на территории области применение в народном хозяйстве. 16 Алюминий. 1 Алюминий. Строение атома, физические и химические свойства простого вещества. Алюминотермия. Л.о.6. Получение гидроксида алюминия и взаимодействие его с растворами кислот и щелочей. 6. Применение алюминия и изделий из него на предприятиях области и в быту Устный опрос § 13 упр.5-7 17 Соединения алюминия. 1 Соединения алюминия — оксид и гидроксид, их амфотерный характер. Важнейшие соли алюминия. Применение алюминия и его соединений. Л.о.7. Ознакомление с образцами природных соединений: алюминия. 7. Бокситовые рудники на территории Челябинской области 18 Железо. 1 Железо. Строение атома, физические и химические свойства простого вещества. Железо в природе: оксидные и сульфидные руды. Л.о.8. Ознакомление с образцами природных соединений железа. 8. Применение железа и его сплавов в быту и промышленности. Роль железа в жизнедеятельности организмов. § 14 упр.1, 4 19 20 Соединения железа. Обобщения и систематизация 1 1 знаний по теме «Металлы». 21 Контрольная работа по теме: “Металлы” 1 Генетические ряды Fe2+ и Fe3+. Качественные реакции на Fe2+ и Fe3+. Важнейшие соли железа. Значение железа, его соединений и сплавов в природе и народном хозяйстве. Биологическая роль железа. Решение задач и упражнений по теме. Д.о. Получение Fe(OH)2 и Fe(OH)3 Л.о.9 Качественные реакции на Fe2+ и Fe3+ . § 14 упр. 5, 6 Устный опрос § 8, 9, 10-14, Работа с карточками Контр. работа повтор. пр.р.№1 стр.84 Раздел 3. Практикум № 1"Свойства металлов и их соединений" (3 ч) Уметь: распознавать опытным путем растворы кислот и щелочей; проводить качественные реакции на ионы металлов в растворе. 22 23 24 Осуществление цепочки химических превращений металлов. 1 Получение и свойства соединений металлов. 1 Решение экспериментальных задач на распознавание и получение веществ. 1 Химические превращения металлов. Правила работы с кислотами и щелочами. практическая работа №1 Получение и свойства соединений металлов практическая работа №2 Качественные реакции на ионы металлов. Правила работы с кислотами и щелочами. практическая работа №3 пр.р.№2 стр.84 пр.р.№3 стр.86 Зачет Раздел 4. Неметаллы (23 ч) Федеральный стандарт: Свойства простых веществ неметаллов. Водород. Водородные соединения неметаллов. Кислород. Озон. Вода. Галогены. Галогеноводородные кислоты и их соли. Сера. Оксиды серы. Серная, сернистая и сероводородная кислоты и их соли. Азот. Аммиак. Соли аммония. Оксиды азота . Азотная кислота и ее соли. Фосфор. Оксид фосфора. Ортофосфорная кислота и ее соли. Углерод. Алмаз, графит. Угарный и углекислый газы. Угольная кислота и ее соли. Кремний. Оксид кремния . Кремниевая кислота. Силикаты. Химические вещества как строительные и поделочные материалы (мел, мрамор, известняк, стекло, цемент Уметь: характеризовать химические элементы - неметаллы на основе их положения в периодической системе Д.И.Менделеева и особенностей строения их атомов; связь между строением и свойствами неметаллов; химические свойства основных неметаллов и их соединений. повт. § 1,3 25 Общая характеристика неметаллов. 1 Неметаллы: атомы и простые вещества. 26 27 Химические элементы в клетках живых организмов 1 Водород. 1 Положение неметаллов в периодической системе элементов, особенности строения их атомов. Электроотрицательность как мера неметалличности, ряд ЭО. Аллотропия. Физические свойства неметаллов. Относительность понятий «металл» и «неметалл». Кислород и озон. Состав воздуха. Д.о. Коллекция образцов неметаллов в различных агрегатных состояниях. Макро- и микроэлементы. Роль микроэлементов в жизнедеятельности растений, животных и человека. Витамины. Гормоны. Д.о. Образцы витаминных препаратов и гормонов. Водород. Положение в периодической системе химических элементов Д. И. Менделеева. Строение атома и молекулы. Физические и химические свойства водорода, его получение и применение. § 15, упр.2,3 Устный опрос § 16 упр.1-6 (уст.) Устный опрос 10. Применение водорода § 17 на промышленных предприятиях области. упр.3,4 Устный опрос Проблемы водородной энергетики. 28 29 Галогены. Биологическое значение и применение галогенов и их соединений. 1 1 Общая характеристика галогенов. Строение атомов. Простые вещества, их физические и химические свойства. Основные соединения галогенов (галогеноводороды и галогениды), их свойства. Д.о. Образцы галогенов простых веществ. Взаимодействие галогенов с Na, Al. Качественная реакция на хлоридион. Краткие сведения о хлоре, броме, фторе и иоде Л.о.10. Качественная реакция на Cl- Биологическая роль фтора, хлора, брома. Их значение в промышленности, сельском хозяйстве, быту. 11. Галогениды, добываемые на Южном Урале § 18, 12. Использование хлора, проблема йододефицита. § 19,20 упр.4,5 Тест Производство йодированной соли в регионе. упр.1-3 30 Кислород 1 Кислород в природе - в атмосфере, литосфере, гидросфере. Химические свойства кислорода: взаимодействие с простыми веществами и сложными веществами. Горение и медленное окисление. Дыхание и фотосинтез. Получение и применение кислорода. Д.о. Получение кислорода разложением KMnO4. Собирание и распознавание кислорода. 13. Биологическая роль кислорода и озона в живых организмах. Влияние хозяйственной деятельности человека на круговорот кислорода в природе. Производство и применение кислорода в регионе. § 21, упр.1,2,8 31 Сера. Сера в природе. Применение серы. 1 Сера. Строение атома, аллотропия, свойства и применение ромбической серы 32 Соединения серы и их применение 1 . Сероводород и сероводородная кислота. 33 Оксиды серы (IV) и (VI).Сернистая кислота и ее соли. 1 Получение и свойства оксидов серы (IV) и (VI) как кислотных оксидов. Реакция 2SO2+O2 = 2SO3, условия смещения равновесия вправо. Сернистая кислота и ее соли. Д.о. Взаимодействие серы с металлами, водородом и кислородом. 14. Соединения серы - одни § 22, из загрязнителей окружающей среды региона упр.1,3 15. Сернистый газ – побочный продукт металлургии. Превращения в атмосфере, кислотные дожди, закисление почв. 34 35 36 37 Серная кислота. Соли серной кислоты. 1 Азот 1 Аммиак Соли аммония 1 1 Характеристика свойств серной кислоты с позиции ТЭД и окислительновосстановительных реакций. Сравнение свойств концентрированной и разбавленной H2SO4. Соли серной кислоты. Применение серной кислоты и ее солей в народном хозяйстве. Качественная реакция на сульфат-ион. Д.о. Образцы сульфатов Л.о11. Качественная реакция на сульфат-ион. 16. Применение солей серной кислоты в сельском хозяйстве § 23, упр.1,2 Строение атомов азота. Строение молекулы азота. Физические и химические свойства азота. Биологическое значение азота. 17. Получение азота в кислородном цехе Устный опрос ОАО «Мечел» § 24, Строение молекулы аммиака. Водородная связь. Физические свойства, получение, собирание, распознавание. Водный аммиак. Химические свойства аммиака. 18. Использование аммиака на Устный опрос хладокомбинатах, в медицине и быту § 25, 19. Получение сульфата аммония на коксохимическом Устный опрос производстве ОАО «Мечел», значение в жизни растений. § 26, Состав, получение, физические и химические свойства солей аммония. Применение солей аммония в народном хозяйстве. Д.о. Образцы солей аммония; Л.о. 12. Распознавание солей аммония упр.2,4 упр.7.8 упр.4,5 38 39 40 Кислородные соединения азота. Азотная кислота. 1 Соли азотистой и азотной кислот. 1 Фосфор. Соединения фосфора. 1 Оксиды азота. Азотная кислота, ее свойства: взаимодействие конц. и разб. НNО3 с медью. Применение азотной кислоты в промышленности. Д.о. Взаимодействие конц. и разб. НNО3 с Си. 20. Оксиды азота в атмосфере. Кислотные Устный опрос дожди . § 27, Нитраты и их свойства (разложение при нагревании). Проблема повышенного содержания нитратов и нитритов в сельскохозяйственной продукции Д.о. Образцы азотных удобрений. 21. Применение азотных удобрений в сельском хозяйстве региона. Влияние их на Устный опрос урожайность сельскохозяйственных культур. Влияние нитратов на организм. § 27, Фосфор. Строение атома, аллотропия, свойства белого и красного фосфора, их применение. Д.о. Образцы природных соединений фосфора. Основные соединения: оксид фосфора (V), ортофосфорная кислота и фосфаты. Фосфорные удобрения. 22. Залежи фосфоритов и апатитов на Южном Урале. Тест Производство и применение фосфорных удобрений на Урале упр.5 упр.6, 7 § 28, упр.2,5 41 42 Углерод. Оксиды углерода (II) и (IV). 1 1 Строение атома углерода. Аллотропия: алмаз и графит. Аморфный углерод и его сорта: кокс, сажа, древесный уголь. Адсорбция и ее практическое значение. Химические свойства углерода. Биологическое значение углерода. Углерод основной элемент живой природы. Д.о. Модели кристаллических решеток алмаза и графита. Образцы углерода. Адсорбция активированным углем растворенных или газообразных веществ. 23. Основные виды § 29, топлива в регионе. Запасы угля. Топливно- упр.6,8; энергетический комплекс области. Физические и химические свойства оксидов углерода. Получение и применение СО и СО2, их биологическое значение. Л.о. 13. Получение углекислого газа и его распознавание.. 24. Антропогенные источники оксидов углерода в атмосфере Урала. Значение для здоровья человека. Природно-охранные мероприятия угледобыче. при § 30, упр.3, 6,7 43 44 45 Угольная кислота и ее соли. Кремний Кремниевая кислота и ее соли. 1 1 1 Угольная кислота. Карбонаты: кальцит, сода, поташ, их значение в природе и жизни человека. Качественная реакция на карбонат-ион. Д.о. Коллекция карбонатов. Кремний. Строение атома, кристаллический кремний, его свойства и применение. Оксид кремния (IV), его природные разновидности. Силикаты. Значение соединений кремния в живой и неживой природе. Д.о. Коллекция природных соединений кремния. Силикатная промышленность. Производство стекла, фарфора, цемента. Л.о.15. Ознакомление с природными силикатами. 25. Жесткость воды в различных местах региона. Л.о.14 Качественная реакция на карбонатион. Месторождения известняка, мрамора на Южном Урале. 26. Природные соединения кремния на Южном Урале § 31, 27. Силикатное производство Южного Урала. § 31, упр.1,3 Устный опрос упр.4 Л.о.16. Ознакомление с продукцией силикатной промышленности. 46 Обобщения и систематизация знаний по теме «Неметаллы». 1 Решение задач и упражнений, подготовка к контрольной работе. Устный опрос § 16-31, упр. в тетради 47 Контрольная работа по теме «Неметаллы» пр.р. № 4 стр.187 1 Контрольная работа Раздел 5. Практикум № 2 «Свойства неметаллов и их соединений». (3 ч) Федеральный стандарт: Методы анализа веществ. Качественные реакции на газообразные вещества и ионы в растворе. Определение характера среды. Индикаторы. Получение газообразных веществ. Проведение химических реакций в растворах. Уметь: распознавать опытным путем: кислород, водород, углекислый газ, аммиак; проводить качественные реакции на хлорид-, сульфат-, карбонатионы; 48 49 Решение экспериментальных задач по теме “Подгруппа кислорода”. 1 Решение экспериментальных задач по теме “Подгруппы азота и углерода” 1 Свойства соединений подгруппы кислорода. Правила ТБ. практическая Свойства соединений подгруппы азота и углерода. Правила ТБ. практическая работа № 4 работа № 5 Зачет Зачет пр.р. № 5 стр.188 пр.р. № 6 стр.89 50 Получение, собирание и распознавание газов. 1 Получение кислорода, аммиака и углекислого газа, доказательство их наличия, свойства. Правила ТБ. практическая работа № 6 Зачет Раздел 6. Органические соединения (10 ч) Вещества органические и неорганические, относительность понятия «органические вещества». Причины многообразия органических соединений. Химическое строение органических соединений. Молекулярные и структурные формулы органических веществ. 51 Предмет органической химии. Теория строения органических соединений А.М. Бутлерова 1 Первоначальные сведения о строении органических веществ. Причины многообразия органических соединений. Молекулярные и структурные формулы органических веществ. § 32, упр.1,2 Устный опрос 52 Предельные углеводороды. Метан и этан: строение молекул. Горение метана и этана. Дегидрирование этана. Применение метана.. Д.о. Модели молекул метана и других углеводородов. Л.о.17. Изготовление моделей молекул углеводородов. Устный опрос 28. Природные § 33, источники упр.4 углеводородов. Применение углеводородного сырья на предприятиях области 53 54 Непредельные углеводороды. Этилен. Кислородсодержащие органические вещества 1 1 Химическое строение молекулы этилена. Двойная связь. Взаимодействие этилена с водой. Реакции полимеризации этилена. Полиэтилен и его значение. Д.о Взаимодействие этилена с бромной водой и раствором перманганата калия. Предельные одноатомные спирты на примерае метанола и этанола. Трехатомный спирт — глицерин. Д.о. Образцы метанола, этанола, этиленгликоля, глицерина. Качественная реакция на глицерин. Л.о. 18. Свойства глицерина. § 34, упр.1.2 С.р. Устный опрос РК № 28. Получение § 35, упр.5. кислородсодержащих органических веществ на предприятиях области, значение для человека. Антропогенные источники фенолов, альдегидов в биосфере региона 55 56 Предельные одноосновные карбоновые кислоты. 1 Жиры 1 Карбоновые кислоты (уксусная, стеариновая) как представители кислородсодержащих органических соединений. Реакции этерификации и понятие о сложных эфирах. Д.о Получение уксусноэтилового эфира. Жиры как сложные эфиры глицерина и жирных кислот. Биологическая роль жиров. Д.о Омыление жира. § 36, упр.1,2 Устный опрос § 37 упр.1,2 Устный опрос 57 Белки. 1 Белки, их строение биологическая роль. и Д.о. Доказательство наличия функциональных групп в растворах аминокислот. Качественные реакции на белки. 58 Углеводы. 1 Понятие об углеводах. Глюкоза, ее свойства и значение. Крахмал и целлюлоза (в сравнении), их биологическая роль. 59 Обобщение и систематизация знаний по теме «Органические вещества». 1 Представления о полимерах на Д.о. Коллекции примере полиэтилена. пластмасс и волокон, каучуков и биополимеров. Взаимосвязь органических веществ. Контрольная работа по теме «Органические вещества» 1 60 § 38, упр.4 Устный опрос Л.о.19. Взаимодействие глюкозы с гидроксидом меди (II) без нагревания Устный опрос и при нагревании. Л.о.20. Взаимодействие крахмала с иодом. 30. Состав и маркировка продукции предприятий пищевой промышленности региона § 39 упр.1,2 § 40, Тест Раздел 7. Обобщение и повторение знаний по химии за курс основной школы (8 ч). повт. §32-40 61 62 63 64 65 Периодический закон и периодическая система химических элементов Д.И. Менделеева. 1 Химическая связь и кристаллические решетки 1 Типы химических реакций. 1 Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение атома. Устный опрос Типы химических связей Зачет Основные классы неорганических веществ. 1 Решение расчетных задач. 1 Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ; изменению степеней окисления химических элементов; поглощению или выделению энергии. Понятие о скорости химических реакций. Катализаторы Основные классы неорганических веществ и их свойства. Решение расчетных задач на нахождение: 1) массовой доли химического элемента в веществе; 2) массовой доли § 1-3 Зачет 8 кл. Зачет § 10-12, 22 8 кл. Работа по карточкам § 27, 32, 43. 66 67 68 Решение расчетных задач. 1 Подготовка к итоговой контрольной работе по курсу «Химия» 1 Итоговая контрольная работа 1 Резервное время 2 растворенного вещества в растворе; 3) количества вещества, массы или объема по количеству вещества, массе или объему одного из реагентов или продуктов реакции. 8 кл. § 17-21 Контрольная работа - -