АОО «Назарбаев Интеллектуальные школы» Образец Экзаменационные материалы для итоговой аттестации
advertisement
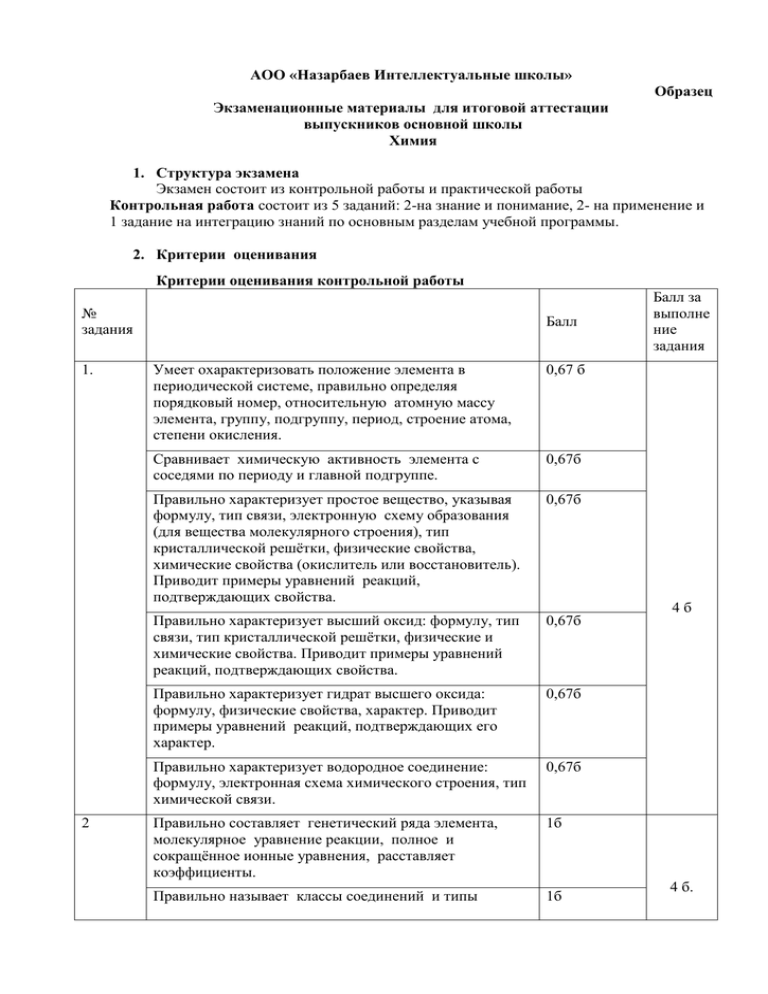
АОО «Назарбаев Интеллектуальные школы» Образец Экзаменационные материалы для итоговой аттестации выпускников основной школы Химия 1. Структура экзамена Экзамен состоит из контрольной работы и практической работы Контрольная работа состоит из 5 заданий: 2-на знание и понимание, 2- на применение и 1 задание на интеграцию знаний по основным разделам учебной программы. 2. Критерии оценивания Критерии оценивания контрольной работы № задания 1. 2 Балл Умеет охарактеризовать положение элемента в периодической системе, правильно определяя порядковый номер, относительную атомную массу элемента, группу, подгруппу, период, строение атома, степени окисления. 0,67 б Сравнивает химическую активность элемента с соседями по периоду и главной подгруппе. 0,67б Правильно характеризует простое вещество, указывая формулу, тип связи, электронную схему образования (для вещества молекулярного строения), тип кристаллической решётки, физические свойства, химические свойства (окислитель или восстановитель). Приводит примеры уравнений реакций, подтверждающих свойства. 0,67б Правильно характеризует высший оксид: формулу, тип связи, тип кристаллической решётки, физические и химические свойства. Приводит примеры уравнений реакций, подтверждающих свойства. 0,67б Правильно характеризует гидрат высшего оксида: формулу, физические свойства, характер. Приводит примеры уравнений реакций, подтверждающих его характер. 0,67б Правильно характеризует водородное соединение: формулу, электронная схема химического строения, тип химической связи. 0,67б Правильно составляет генетический ряда элемента, молекулярное уравнение реакции, полное и сокращённое ионные уравнения, расставляет коэффициенты. 1б Правильно называет классы соединений и типы 1б Балл за выполне ние задания 4б 4 б. химических реакций 3 4 5 Правильно составляет электронный баланса 1б Правильно составляет молекулярное, полное ионное и сокращённое ионное уравнения гидролиза соли. 1б Правильно формулирует термины. 0,5 б Правильно производит вычисление исходных концентраций веществ 2б Правильно производит вычисление константы химического равновесия 1б Правильно указывает факторы, влияющие на смещение химического равновесия: температура, давление, концентрация веществ. 1,5 б Приводит обоснование положения металлов в периодической системе химических элементов, исходя из строения их атомов 1б Делает сравнительную характеристику валентных возможностей металлов 1б Дает сравнительную характеристику физических свойств металлов. 1б Дает сравнительную характеристику химических свойств металлов, с записью уравнений реакций. 1б Приводит формулы характерных соединений этих элементов и указывает их химический характер, с записью уравнений реакций. 1б Правильно составляет краткое условие задачи, записывает уравнение реакции, расставляет коэффициенты. 1б Правильно производит расчёт массы и количества вещества в исходном растворе, массы раствора по окончании реакции. 1б Правильно производит расчёт массы раствора, массы и количества вещества после реакции. 1б Правильно производит расчёт массы соли вступившей в реакцию, массы металла выделившегося после реакции 1б Правильно производит расчёт массы прореагировавшего металла и его молярной массы. 1б Правильно определяет по Периодической системе металл и записывает ответ. 1б 5б 5б 6б Критерии оценивания практической работы Критерии Балл Соблюдение правил техники безопасности 1 Постановка цели работы 1 Выдвижение гипотезы 1 Правильно подобраны приборы и реактивы для выполнения работы. 1 Оформление работы 1 Выводы по работе 1 Итого: 6 Примерный перечень практических работ Практическая работа № 1. Получение кислорода и изучение его свойства. Оформите результаты работы. Практическая работа № 2. Получение водорода и изучение его свойств. Оформите результаты работы. Практическая работа № 3.Приготовление раствора соли с заданной массовой долей соли Оформите результаты работы. Практическая работа № 4. Основные классы неорганических соединений. Оформите результаты работы. Практическая работа № 5. Генетическая связь между классами неорганических соединений. Оформите результаты работы. Практическая работа № 6. Осуществите реакцию обмена между оксидом меди (ІІ) и серной кислотой. Оформите результаты работы. Практическая работа № 7. Осуществите практически следующие превращения: Fe → FeCl2 → Fe(OH)2 →Fe(OH)3 →Fe2O3 Оформите результаты работы. Практическая работа № 8. Проведите реакции, идущие с выделением газа, образованием осадка и воды. Оформите результаты работы. Практическая работа № 9. Выполнение экспериментальных задач по качественному обнаружению ионов. Оформите результаты работы. Практическая работа № 10.Используя необходимые реактивы, докажите что скорость химической реакции зависит oт: а) природы реагирующих веществ; б) площади поверхности соприкосновения.. Оформите результаты работы. Практическая работа № 11. Используя необходимые реактивы, докажите что скорость химической реакции зависит oт: присутствия катализатора. Оформите результаты работы. Оформите результаты работы. Практическая работа 12. С помощью химического эксперимента докажите основной характер оксид и гидроксид кальция. Оформите результаты работы. Практическая работа № 13. Получите гидроксид алюминия и исследуйте его характерные химические свойства. Оформите результаты работы. Практическая работа № 14. Докажите на опытах химические свойства металлов, на основании результатов опытов объясните принцип расположения элементов в электрохимическом ряду напряжений металлов. Оформите результаты работы. Практическая работа № 15. Определите с помощью индикатора реакцию раствора хлорида цинка, карбоната натрия и сульфата натрия. Оформите результаты работы. Практическая работа № 16. Используя химические реактивы, осуществите реакции, которые выражаются следующими сокращёнными ионными уравнениями: Оформите результаты работы. А) Н+ + ОН- → Н2О Б) Ag+ + Cl- → AgCl↓ В) Ba2+ + SO42- → BaSO4↓ Г) Ca2+ + CO32- → CaCO3↓ Д) CO32- + 2H+ → CO2↑ + H2O. Практическая работа № 17. Докажите наличие ионов меди (II), цинка, и железа (II, III) в растворах солей. Оформите результаты работы. Практическаая работа № 18. Экспериментально осуществить следующие превращения: AlCl3 Al(OH)3 Na[Al(OH)4] Al(OH)3. . Оформите результаты работы. Практическая работа № 19. Не прибегая к другим реактивам, распознайте, в какой из трёх пробирок с растворами находятся: хлорид цинка, хлорид меди(II), гидроксид натрия. Оформите результаты работы. Практическая работа № 20. Не прибегая к другим реактивам, распознайте, в какой из трёх пробирок с растворами находятся: сульфат железа (II), сульфат магния, гидроксид калия. Оформите результаты работы. 3. Шкала перевода баллов в оценку 30- баллов - максимальное количество. «5»-89-100% 26-30 баллов «4»-72-88% 22-25 баллов «3»-55-71% 17-21 баллов «2»- 54 и ниже 16 баллов и ниже. 4. Время проведения экзамена: Контрольная работа-3 часа Практическая работа-1 час Контрольная работа 1.Используя периодическую систему химических элементов, дайте характеристику элемента, простого вещества и соединений элемента № 4. 2.Составьте генетический ряд бериллия, имея следующие вещества: бериллий, гидроксид бериллия, соляная кислота, оксид бериллия, хлорид бериллия. Напишите уравнения реакции составленной схемы превращений в молекулярном и ионном виде, разберите их с позиции ОВР, назовите классы соединений и типы химических реакций. В какой цвет окрасится водный раствор хлорида бериллия при добавлении к нему лакмуса, фенолфталеина и метилового оранжевого? 3. Что такое константа химического равновесия? Напишите выражения констант равновесия для нескольких обратимых химических реакций. При достижении состояния химического равновесия в системе N2 + 3H2 ↔ 2NH3 + Q равновесные концентрации веществ были равны: [N2] = 1,5 моль/л; [H2] = 4,5 моль/л; [NH3] = 2 моль/л. Вычислите: а) исходные концентрации азота и водорода; б) константу химического равновесия, в) сформулируйте оптимальные условия проведения данного процесса. 4.Элементы калий и цинк находятся в одном периоде. Исходя из строения их атомов, обоснуйте их положение в периодической системе химических элементов. Дайте сравнительную характеристику их валентных возможностей, физических и химических свойств. Приведите формулы характерных соединений этих элементов и укажите их химический характер. 5. В раствор хлорида кобальта (II) массой 380 г с массовой долей соли 40% поместили кусочек неизвестного металла (Мe). Через некоторое время кусочек металла вынули из раствора, высушили и взвесили, его масса увеличилась на 14 г. Массовая доля хлорида кобальта в растворе после реакции стала равной 8, 75%. Определите неизвестный металл, если известно, что в образовавшемся хлориде он имеет степень окисления + 2. Практическая работа Решите следующие экспериментальные задачи. Задача № 1.Осуществите практически превращения веществ по следующей схеме: CuSO4 → Cu (OH)2 → CuCl2. ↓ Cu Задача № 2. В трёх пробирках находятся растворы сульфата натрия, карбоната натрия, хлорида натрия. Используя необходимые реактивы, распознайте каждый из растворов. Решение и правильные ответы контрольной работы Задание № 1. I. Ве – п. № 4; Ar (Be) = 9, II – группа, главная подгруппа, 2 период. 2𝑒̅; 1s22s2. Be0 ; Be* 1s2 2s12p1 +4Be Be+2 ; 𝑒̅ = 4; 1 1p =4; 1 2𝑒̅ 0n = 5; 1s2 2s2 2p0 1s2 2s1 2p1 II. Ве проявляет амфотерные свойства. Сравним металлические свойства бериллия с соседями по периоду и главной подгруппе. Li> Be > B; Li более активен, чем Ве, т.к. Z (Li) < Z(Be), R(Li) > R(Be), Li - 1𝑒̅ ; Be - 2𝑒̅ . Ве более активен, чем В, т.к. Z(Be) < Z(B), R (Be) > R (B), Be - 2𝑒̅ , B - 3𝑒̅ . Mg Ве менее активен, чем Mg т.к. Z(Be) < Z (Mg), R (Be) < R (Mg). III. Ве - простое вещество, металлический тип связи, металлическая кристаллическая решётка, электрическая проводимость уменьшается с повышением температуры металла, проводит тепло, пластичен, ковок, металлический блеск. 2Ве0 + О20→ 2Ве+2 О-2 ↑ ↓ в-ль о-ль Be0 + Cl20 → Be+2 Cl2- ↑ в-ль ↓ о-ль Be0 +2H+ Cl → Be+2 Cl2 + H20↑ ↑ ↓ в-ль о-ль Be0 + 2NaOH + 2H2+1 O → Na2[Be+2 (OH)4] + H20↑ ↑ ↓ тетрагидроксов-ль о-ль бериллат натрия. IV. ВеО – высший оксид, проявляет амфотерные свойства, смешанный тип связи ковалентная сильно полярная и ионная связь, ионная кристаллическая решётка. ВеО + 2НСl → BeCl2 + H2O основные св-ва BeO + 2H+ + 2Cl- → Be2+ + 2Cl- + H2O BeO + 2H+ → Be2+ + H2O BeO + 2KOH → K2BeO2 + H2O кислотные бериллат св-ва. калия. V. Be(OH)2 – гидрат высшего оксида, нерастворимое в воде основание, амфотерный гидроксид. Be(OH)2↓ + 2HCl → BeCl2 + 2H2O основные св-ва H2BeO2 + 2NaOH → Na2BeO2 + 2H2O кислотные св-ва. VI. Водородного соединения не имеет. 1 2 3 Задание № 2. Ве → ВеО→ ВеСl2 → Be(OH)2 4 𝐭 1) 2Ве0 + О20 → 2Ве+2 О-2 р. соединения, ОВР. oксид бериллия (II) Ве0 – 2е̅ → Ве+2 2 р. ок-ния, Ве0 в-ль (о-ся) О20 + 4е̅ → 2О-2 1 р. в-ния, О20 о-ль (в-ся). 2)ВеО + 2HCl → BeCl2 + H2O; р. обмена соляная хлорид кислота бериллия (II). + BeO + 2H +2Cl → Be2+ + 2Cl- + H2O BeO + 2H+ → Be2+ + H2O Вывод. В реакции участвуют оксид бериллия (II) и два катиона водорода с образованием катиона бериллия (2+) и воды. 3) BeCl2 +2NaOH → Be(OH)2 ↓ + 2NaCl; р. ионного обмена. гидроксид гидроксид хлорид натрия берилия натрия (щёлочь) (нерастворимое (соль) основание) 2+ + Be + 2Cl + 2Na + 2OH- → Be(OH)2↓ + 2Na+ + 2ClBe2+ +2OH- → Be(OH)2↓ Вывод. В реакции участвуют катион бериллия (2+) и два гидроксид иона с образованием гидроксида бериллия (II). 4) Be(OH)2↓ + 2HCl → BeCl2 + 2H2O р. ионного обмена Be(OH)2↓ +2H+ +2Cl- → Be2+ +2Cl- + 2H2O Be(OH)2↓ +2H+ → Be2+ +2H2O Вывод. В реакции учувствует гидроксид бериллия и два катиона водорода с образованием катиона бериллия и двух молекул воды. BeCl2 ↔ Be2+ + 2Cl- соль образована слабым основанием и сильной кислотой, реакция гидролиза протекает по аниону в две ступени. 1 ступень. Be2+ + 2Cl- + HOH→ (BeOH)+ + H+ +2ClBe2+ + HOH → (BeOH)+ + H+ - в избытке находятся катионы водорода следовательно реакция среды кислая, лакмус – красный, фенолфталеин – бесцветный, метиловый оранжевый – розовый. BeCl2 +H2O → BeOHCl + HCl 2 ступень. BeOHCl ↔ (BeOH)+ +Cl(BeOH)+ + Cl- + HOH → Be(OH)2↓ +H+ + Cl(BeOH)+ + HOH → Be(OH)2↓ + H+ + - в избытке находятся катионы водорода, следовательно, реакция среды кислая, лакмус – красный, фенолфталеин – бесцветный, метиловый оранжевый – розовый. BeOHCl + H2O → Be(OH)2↓ + HCl. Задание № 3.Константа равновесия или равновесный закон действующих масс. В состоянии равновесия произведение концентраций продуктов в степенях, равных стехиометрическим коэффициентам, деленное на такое же произведение концентраций реагентов, есть величина постоянная при t =const. 2H2 +O2 ↔ 2H2O Kр = [H2O]2 / [H2]2[O2] N2 + O2 ↔ 2NO Kр = [NO]2/ [N2] [O2] Дано: Решение. N2 + 3H2↔ 2NH3 + Q [N2] = 1,5 моль/л а) с1(N2) = ∆c(N2) + c2(N2) = ∆c(NH3) + c2(N2) = [c2(NH3)c1(NH3)+c2(N2)] = [H2] = 4,5 моль/л = (2моль/л-0моль/л)+1,5моль/л = 3,5моль/л. [NH3] = 2 моль/л с1(Н2) = ∆с(Н2) + с2(Н2) = ∆с(NH3) + c2(H2) = [c2(NH3) – c1(NH3) + c2(H2)]= = (2моль/л-0моль/л) + 4,5моль/л = 6,5моль/л a)[N2]1 - ? [H2]1 - ? б) Кр = [NH3]2/ [N2][H2]3 = 22/ 1,5• 4,53 = 0,04 б) Кр - ? в) N2+3H2↔2NH3 + Q в) условия Согласно принципу Ле-Шателье: протекания - ? 1) т.к. реакцция экзотермическая температуру процесса необходимо понизить, что бы сместить равновесие в сторону образования аммиака2) реакция протекает с уменьшением объёма т.к. в реакцию вступает 4V газов, а образуется 2Vобъёма газа. Таким образом, при увеличении давления равновесие сместиться в сторону образования аммиака. 3) Повышение концентрации азота и водорода ведёт к смещению равновесия в сторону образования аммиака. Задание № 4. Калий Цинк 1.Строение атома. +1 3d10 -е̅ +19К 2е̅ 8е̅8е̅1е̅ ;4s1 +2 -2 е̅ +30Zn 2𝑒̅ 8𝑒̅ 18𝑒̅ 2𝑒̅ ; 4s2 4s1 * +30Zn 4s1 1 4s1 3d10 4p1 3d10 4p Обосновать положение калия и цинка в периодической системе химических элементов можно с помощью правила Клечковского. Калий и цинк находятся в одном периоде т.к. , n = 4, l= 0,1,2,3. m = 2l + 1. Если l = 0, то одна s – орбиталь; если l =1, то три р-орбитали, если l = 2, то пять d-орбиталей, если l = 3, то семь f –орбиталей. При заполнении электронами орбиталей в начале заполняются те подуровни, для которых сумма n + l наименьшая, в случае равенства этих сумм в начале заполняются подуровни с меньшим значением n. У цинка заполняется 3d подуровень т.к. сумма n +l = 3+2=5, а для подуровня 4s: n+l = 4+0 = 4, т.е. меньше, чем для подуровня 3d, поэтому в атоме калия девятнадцатый электрон размещается на 4s –орбитали. 2.Валентные возможности. У калия большой радиус атома, на внешнем энергетическом уровне имеет один валентный электрон, который он легко отдаёт, являясь сильным восстановителем. Степень окисления калия в соединениях +1. В атоме цинка предпоследний d- подуровень полностью завершён и энергетически устойчив, поэтому цинк в химических реакциях может отдавать только 2s-электрона, проявляя степень окисления +2. 3.Физические свойства. Калий Цинк Серебристо-белый металл имеет лёгкий Синевато-белого цвета с сильным фиолетовый оттенок. На воздухе легко металлическим блеском. Вов лажном окисляется и тускнеет. Кристаллическая воздухе блеск исчезает из-за образования решётка кубическая объёмноплёнки оксида. Металл средней твёрдости. центрированная, поэтому пластичен, мягок, Пластичен, может быть прокатан в фольгу. легко режется ножом, легче воды, Технический цинк при о.у. является легкоплавок, в жидком состоянии проводит хрупким, но при 100-1500 становиться электрический ток и тепло. пластичным и его можно прокатывать в листы и вытягивать в проволоку. Выше 2000 опять становиться хрупким и его можно растереть в порошок. Принадлежит к числу летучих металлов. Его теплопроводность составляет 60% от теплопроводности серебра, а электрическая проводимость в 4 раза меньше. 4.Химические свойства. Калий. Химическая активность обусловлена слабой связью единственного валентного электрона с ядром. K0 -1𝑒̅ → K+ Горит в кислороде, фторе, хлоре: 2K0 + O20→K2+1 O2-1 (пероксид калия). ↑ ↓ в-ль о-ль 2K0 +Cl20 → 2K+1 Cl-1 (хлорид калия) ↑ ↓ в-ль о-ль При растирании с серой воспламеняется: 2K0 + S0 → K2+ S-2 (сульфид калия) ↑ ↓ в-ль о-ль Соединяется м водородом образуя гидриды: 2К0 + H20 → 2К+H- (гидрид калия) ↑ ↓ в-ль о-ль Калий в воде сразу воспламеняется, а потом взрывается, при этом разбрызгиваются частицы раскалённого пероксида калия и капли щёлочи. 2К0 + 2Н2 +1О→ 2К+ ОН + Н20 ↑ ↓ в-ль о-ль С азотом и инертными газами не взаимодействует: K + N2↛ Калий при взаимодействии с растворами солей и кислот в первую очередь будет реагировать с водой. Цинк. Цинк на воздухе устойчив т.к. покрывается слоем оксида. При повышенной температуре цинк становится активным и взаимодействует с простыми веществами: галогенами, кислородом и серой. 𝑡 2Zn0 + O20 → 2Zn+2 O-2 (оксид цинка) ↑ ↓ в-ль о-ль 𝑡 Zn0 + Cl20 → Zn+2Cl2-1 ↑ ↓ в-ль о-ль 𝑡 Zn0 + S0 → Zn+2 S-2 ↑ ↓ в-ль о-ль Со сложными веществами – растворами кислот, щелочей и водой цинк реагирует по-разному в зависимости от условий. 𝑡 Zn0 + H2+1 O → Zn+2 O + H20 ↑ ↓ в-ль о-ль 𝑡 Zn0 + 2H+ Cl- → Zn+2O + H20↑ ↑ ↓ в-ль о-ль 𝑡 Zn0 + 2H2S+6O4 → Zn+2SO4 + S+4O2↑ + 2H2O ↑ ↓ в-ль о-ль 3Zn0 +8HN+5O3 (конц) → 3Zn+2 (NO3)2 +2N+2 O↑ +4H2O 0 +2 Zn -2𝑒̅→Zn 3 р.о-ния, Zn0 в-ль (о-ся). N+5 +3𝑒̅ →N+2 2 р.в-ния, N+5 (HNO3) о-ль (вся) 𝑡 Zn0 +2NaOH+ (крист) → Na2Zn+2O2 + H20↑ 𝑡 Zn0 + 2NaOH +2H2+1 O → Na2[Zn+2 (OH)4] + H20↑ 5.Формулы характерных соединений элементов, их химический характер. Калий. Цинк. Гидрид калия – с водой реагирует как Оксид цинка проявляет амфотерные основание, с выделением водорода. свойства. KH +H2O → KOH + H2↑ ZnO + 2HCl → ZnCl2 +H2O Оксид калия – K2O проявляет сильные основные основные свойства. С водой образует св-ва. щёлочь ZnO +2H+ +→ Zn2+ + H2O K2O + H2O → 2KOH Гидроксид калия – KOH сильное основание, проявляет свойства щелочей. KOH↔ K+ + OHKOH + HCl → KCl + H2O H+ + OH- ↔ H2O 2KOH + CuSO4 → Cu(OH)2↓ + K2SO4 Cu2+ +2OH- ↔ Cu(OH)2↓ 2KOH + CO2 → K2CO3 + H2O CO2 + 2OH- ↔ CO32- + H2O 2KOH + Zn(OH)2 → K2[Zn(OH)4] Zn(OH)2 +2OH- ↔ [Zn(OH)4]2K+ - окрашивают пламя в фиолетовый цвет. ZnO + 2KOH→K2 ZnO2 + H2O кислотные св-ва. Гидроксид цинка Zn(OH)2 - амфотерные свойства. Zn(OH)2↓ + 2HCl → ZnCl2 + 2H2O Zn(OH)2↓ +2H+ → Zn2+ + 2H2О Все соли цинка в растворах подвергаются гидролизу: Zn2+ + HOH→ ZnOH+ + H+ реакция среды кислотная. Задание № 5. Дано. Решение. 1. Запишем уравнение реакции: Me + CoCl2 = MeCl2 + Co m р-ра 1 (CoCl2) = 162,5г 2.Вычисляю массу и количество вещества хлорида кобальта в ω1 (CoCl)2 = 40% = 0,4 исходном, растворе: m1 (CoCl2) = mр-ра1(CoCl2)• ω(CoCl2) = ω2 (CoCl2) = 8,75%= 0,0875 = 162,5г • 0,4 = 65 г. Δm (Me) =14г ν1 (CoCl2) = m1(CoCl)2/ M (CoCl2) = 65 г/ 130 г/ моль = 0,5 моль. Me - ? 3. Найду массу раствора после реакции. mр-ра 2 (CoCl2) = mр-ра 1(CoCl)2 – 14г = 162,5г-14г = 148,5 г. 4. Вычисляю массу и количество вещества хлорида кобальта (II) после реакции: m2 (CoCl)2 = mр-ра 2 (СoCl2) • ω2 (CoCl2) = 148,5г • 0,0875 = 13 г. ν (CoCl2) = m2 (CoCl2) / M(CoCl2) = 13 г / 130 г/моль = 0,1 моль. 5. Нахожу массу и количество вещества хлорида кобальта (II), вступившего в реакцию с неизвестным металлом: ν (CoCl2) = ν1(CoCl2 )- ν2(CoCl2 ) = 0,5 моль-0,1моль= 0,4моль. 6.Найду массу кобальта, выделившегося в результате реакции: m (Co) = ν (Co) • M (Co) = = 0,4моль • 59 г/моль = 23,6 г. 7.По условию задачи масса образца увеличилась на 14 г. Это результат процесса растворения неизвестного металла и осаждение кобальта на поверхности на поверхности образца. Тогда получаю выражение: m исх – m(Ме) + m (Co) = mисх + 14 г , или m(Со) – m (Ме) = 14г. Зная массу прореагировавшего кобальта, найду массу прореагировавшего металла: m (Me) = m (Co) – 14г = 23,6 г – 14г = 9,6 г. 8. Вычисляю молярную массу металла: M(Me) = m (Me) / ν (Me) = 9,6 г / 0,4 моль = 24 г/ моль. 9.По Периодической системе определяю, что это металл – магний. Ответ: Mg. Выполнение практической работы Тема. Решение экспериментальных задач. Задание. Решите следующие экспериментальные задачи. Задача №1.Экспериментально осуществите следующие превращения: CuSO4 → Cu (OH)2 → CuCl2. ↓ CuO Цель. Основываясь на знаниях о получении и свойствах веществ разных классов с помощью химического эксперимента осуществить цепочку превращений. Гипотеза. Зная, способы получения нерастворимых оснований и их химические свойства, я смогу осуществить цепочку превращений. Последовательность действий. Теоретическая часть. Пронумеровать каждое звено цепи Оформление решения. CuSO4 →1 Cu (OH)2 →2 CuCl2. ↓3 CuO Составить уравнения реакций для каждого звена цепи, основываясь на знаниях о получении и свойствах веществ разных классов. 1. CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4 сульфат гидроксид гидроксид меди (II) натрия меди(II) 2+ Cu + 2OH → Cu(OH)2↓ синего цвета. Cu(OH)2↓ + 2HCl → CuCl2 + 2H2O гидроксид соляная хлорид меди (II) кислота меди (II) Cu (OH)2↓ + 2H+ → Cu2+ + 2H2O раствор синего цвета. 𝑡 Проверить наличие необходимых реактивов, а при их отсутствии продумать другой вариант решения задачи с использованием имеющихся реактивов Продумать условия протекания каждой реакции и количества используемых веществ Экспериментальная часть. Осуществить все превращения экспериментально и зафиксировать изменения, происходящие с веществами. Cu (OH)2 → CuO + H2O порошок чёрного цвета. гидроксид оксид меди (II) меди (II) Вместо реагента NaOH можно использовать KOH, а вместо одной кислоты (HCl) – другую (H2SO4) Разложение гидроксида меди (II) происходит при нагревании. CuSO4 →1 Cu (OH)2↓ →2 CuCl2. раствор синий раствор синего осадок синего 3 цвета. ↓ цвета CuO чёрного цвета. Вывод. С помощью химического эксперимента, основываясь на знаниях о получении и свойствах веществ разных классов веществ, подтвердили: 1.Нерастворимые основания в лаборатории получают взаимодействием раствора соли данного металла со щёлочью. 2. Нерастворимые основания взаимодействуют с растворами кислот с образованием соли и воды, а также разлагаются при нагревании на основной оксид и воду. Задача №2. В трёх пробирках находятся растворы сульфата натрия, карбоната натрия, хлорида натрия. Используя необходимые реактивы, распознайте каждый из растворов. Цель. Доказать наличие солей сульфата натрия, карбоната натрия, хлорида натрия. Гипотеза. Я смогу определить наличие в растворе солей с помощью характерных реакций. Последовательность действий Оформление решения Теоретическая Na2SO4 ↔ 2Na+ + SO42– часть. Проанализировать состав Ионы натрия окрашивают пламя в желтый каждого вещества и определить реактивы на катион и анион. цвет. На SO42– реактив Ba2+: Ba2+ + SO42 = BaSO4↓, белый осадок, нерастворимый в HNO3. Na2CO3 ↔ 2Na+ + CO32Ионы натрия окрашивают пламя в желтый цвет. CO32- + 2H+ → CO2↑ + H2O Бурное выделение газа без запаха. NaCl ↔ Na+ + Cl- Выбрать путь решения задачи (распознавания веществ) Рассмотреть другие возможные пути решения задачи и выбрать из них оптимальный Экспериментальная часть Взять пробы выданных веществ в чистые пробирки, пронумеровать их и добавить во все пробирки первый реактив. Зафиксировать наблюдения. Сделать вывод. В чистые пробирки взять порции веществ из тех пробирок, которые еще не определены, и добавить второй реактив. Зафиксировать наблюдения. Сделать вывод В чистую пробирку взять порцию следующего вещества и доказать, какое это вещество. Ионы натрия Na+ окрашивают пламя в желтый цвет. Ag+ + Cl– = AgCl↓, белый осадок, нерастворимый в HNO3 В растворах этих солей содержится катион натрия Na+, следовательно, растворы солей можно отличить только по анионам. Составляем план: а) определить Na2SO4 при помощи BaCl2; б) определить Na2CO3 при помощи HCl; в) определить NаCl при помощи AgNO3. При определении Na2CO3 можно воспользоваться раствором серной кислоты H2SO4. При добавлении раствора BaCl2 к пробе во второй пробирке образовался белый осадок, нерастворимый в HNO3. Вывод: во второй пробирке находится раствор Na2SO4 При добавлении раствора HСl к раствору вещества в первой пробирки бурное выделение газа без запаха. Вывод: в первой пробирке находится раствор Na2CO3. Добавить к раствору вещества в пробирке раствор нитрата серебра. Образовался белый осадок, нерастворимый в HNO3. Вывод: в Сделать общий вывод, в какой пробирке находится какое вещество третьей пробирке находится раствор NаCl. Вывод: с помощью характерных реакций на ионы я доказал (а): в первой пробирке находится раствор сульфата натрия, во второй – карбоната натрия, в третьей – хлорида натрия.
