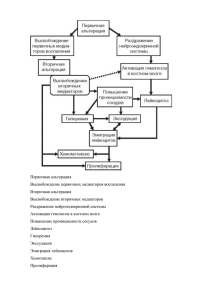
ОПРЕДЕЛЕНИЕ ПОНЯТИЯ «РЕАКТИВНОСТЬ ОРГАНИЗМА» Цель лекции: Сформулировать определение понятия гемато-ликворного «барьера», гемато-офтальмического «барьера» и оценить их роль в неспецифичной резистентности организма. Выявить и оценить «барьерную» роль слизистой желудочно-кишечного тракта и печени путем введения раствора сернокислой магнезии в желудок и в спинной лимфатический мешок. Распознать специфическую и неспецифичную реактивность. План лекции: 1. ОПРЕДЕЛЕНИЕ ПОНЯТИЯ «РЕАКТИВНОСТЬ ОРГАНИЗМА» 2. РЕАКТИВНОСТЬ И РЕЗИСТЕНТНОСТЬ 3. ОСНОВНЫЕ МЕХАНИЗМЫ РЕАКТИВНОСТИ (РЕЗИСТЕНТНОСТИ)ОРГАНИЗМА 4. Факторы неспецифической пассивной резистентности. Система комплемента 5. Иммунологическая реактивность 6. Клеточный иммунный ответ 7. Иммунопогическая толерантность. Первичные и вторичные иммунодефициты 8. Аллергия 9. Классификация. Патогенез. 10. Патогенез аллергических реакций I типа 11. Патогенез аллергических реакций II типа 12. Патогенез аллергических реакций III типа 13. Патогенез IV типа гиперчувствительности 14. Лечение Все живые объекты обладают свойством изменять свое состояние или деятельность, т.е. реагировать на воздействия внешней среды. Это свойство принято называть раздражимостью. Однако не все реагируют одинаково на одно и то же воздействие. Одни виды животных изменяют жизнедеятельность на внешние воздействия не так, как другие виды; одни группы людей (или животных) реагируют на одно и то же воздействие не так, как другие группы; и каждый индивидуум в отдельности имеет свои особенности реагирования. Известный отечественный патофизиолог Н.Н. Сиротинин более 30 лет назад писал в связи с этим: «Под реактивностью организма обычно понимают его свойство реагировать определенным образом на воздействия окружающей среды». Итак, реактивность организма (от лат. reactia - противодействие) - это его способность определенным образом отвечать изменениями жизнедеятельности на воздействие факторов внутренней и внешней среды. Реактивность присуща всему живому. От реактивности в большой степени зависит приспособляемость организма человека или животного к условиям среды, поддержание гомеостаза. Именно от реактивности организма зависит, возникнет или не возникнет болезнь при воздействии болезнетворного фактора, как она будет протекать. Вот почему изучение реактивности, ее механизмов имеет важное значение для понимания патогенеза заболеваний и целенаправленной их профилактики и лечения. ВИДЫ РЕАКТИВНОСТИ Видовая реактивность Реактивность зависит от вида животного. Иными словами, реактивность различна в зависимости от филогенетического (эволюционного) положения животного. Чем выше в филогенетическом отношении стоит животное, тем сложнее его реакции на различные воздействия. В качестве примеров биологической реактивности можно назвать: направленное движение (таксис) простейших и сложнорефлекторные изменения (инстинкты) жизнедеятельности беспозвоночных (пчелы, пауки и др.); сезонные миграции (передвижения, перелеты) рыб и птиц; сезонные изменения жизнедеятельности животных (анабиоз, зимняя спячка и др.), особенности протекания патологических процессов (воспаление, лихорадка, аллергия) у разных представителей животного мира. Ярким проявлением биологической реактивности является восприимчивость (или невосприимчивость) к инфекции. Так, чума собак и ящур крупного рогатого скота не угрожают человеку. Столбняк опасен для человека, обезьян, лошадей и не представляет опасности для кошек, собак, черепах, крокодилов. У акул не встречаются инфекционные заболевания, никогда не нагнаиваются раны; крысы и мыши не болеют дифтерией, собаки и кошки - ботулизмом. На основе видовой реактивности формируется реактивность группы индивидов в пределах вида (групповая) и каждого отдельного индивида (индивидуальная). Групповая реактивность Групповая реактивность - это реактивность отдельных групп особей в пределах одного вида, объединенных каким-либо признаком, определяющим особенности реагирования всех представителей данной группы на воздействия факторов внешней среды. К таким признакам могут относиться: особенности возраста, пола, конституции, наследственности, принадлежность к определенной расе, группы крови, типы высшей нервной деятельности и др. Индивидуальная реактивность Кроме общих (т.е. видовых и групповых свойств реактивности) имеются и индивидуальные особенности реактивности у каждого индивида в отдельности. Так, воздействие какого-либо фактора (например, инфекционного агента) на группу людей или животных никогда не вызывает у всех индивидов этой группы совершенно одинаковые изменения жизнедеятельности. Например, при эпидемии гриппа некоторые люди болеют тяжело, другие - легко, а третьи не болеют вовсе, хотя возбудитель и находится в их организме (вирусоносительство). Объясняется это индивидуальной реактивностью каждого организма. В проявлении индивидуальной реактивности существуют циклические изменения, связанные со сменой времен года, дня и ночи (так называемые хронобиологические изменения). Помнить о них необходимо врачу любой специальности. Например, смертность при ночных операциях втрое выше, чем при дневных. Кроме того, следует рассчитывать оптимальное время приема лекарств. Физиологическая реактивность Физиологическая реактивность - это реактивность, изменяющая жизнедеятельность организма под действием факторов среды, не нарушая его гомеостаза; это реактивность здорового человека (животного). Например, адаптация к умеренной физической нагрузке, системы терморегуляции - к изменению температуры, выработка пищеварительных ферментов в ответ на прием пищи, естественная эмиграция лейкоцитов и т.п. Физиологическая реактивность проявляется как у отдельных индивидуумов (в виде особенностей физиологических процессов), так и у разных видов животных (например, особенности размножения и сохранения потомства, видовые особенности теплообмена). Физиологическая реактивность различна у отдельных групп людей (животных). Например, такие физиологические процессы, как кровообращение, дыхание, пищеварение, секреция гормонов и др., различны у детей и стариков, у людей с разным типом нервной системы. Патологическая реактивность Под воздействием болезнетворных факторов, вызывающих в организме повреждение и нарушение гомеостаза, возникает патологическая реактивность, которая характеризуется понижением приспособляемости болеющего организма. Ее еще называют вторичной (или болезненно измененной) реактивностью. По сути, развитие болезни и есть проявление патологической реактивности, которая выявляется как у отдельных особей, так и у групп и видов животных. Неспецифическая реактивность Способность организма сопротивляться воздействиям окружающей среды, сохраняя при этом постоянство гомеостаза, тесно связана с функционированием механизмов как неспецифической, так и специфической защиты. Сопротивляемость организма инфекциям, его защита от проникновения микробов зависят от непроницаемости нормальных кожных и слизистых покровов для большинства микроорганизмов, наличия бактерицидных субстанций в кожных секретах, количества и активности фагоцитов, присутствия в крови и в тканях таких ферментных систем, как лизоцим, пропердин, интерферон, лимфокины и др. Все эти изменения в организме, возникающие в ответ на действие внешних факторов и не связанные с иммунным ответом, служат проявлением неспецифической реактивности. Например, изменения в организме при геморрагическом или травматическом шоке, гипоксии, действии ускорений и перегрузок; воспаление, лихорадка, лейкоцитоз, изменения функции поврежденных органов и систем при инфекционных заболеваниях; спазм бронхиол, отек слизистой оболочки, гиперсекреция слизи, одышка, сердцебиение и др. Специфическая реактивность Вместе с тем сопротивляемость организма, его защита зависят также от его способности развивать высокоспециализированную форму реакции - иммунный ответ. Способность иммунной системы к распознаванию «своего» и «несвоего» является центральным биологическим механизмом реактивности. Специфическая реактивность - это способность организма отвечать на действие антигена выработкой антител или комплексом клеточных реакций, специфичных по отношению к этому антигену, т.е. это реактивность иммунной системы (иммунологическая реактивность). Ее виды: активный специфический иммунитет, аллергия, аутоиммунные заболевания, иммунодефицитные и иммунодепрессивные состояния, иммунопролиферативные заболевания; выработка и накопление специфических антител (сенсибилизация), образование иммунных комплексов на поверхности тучных клеток - проявления специфической реактивности. ФОРМЫ РЕАКТИВНОСТИ Понятие реактивности прочно вошло в практическую медицину в основном с целью общей оценки состояния организма больного. Еще древние врачи заметили, что различные люди одними и теми же болезнями болеют по-разному, с присущими каждому индивидуальными особенностями, т.е. неодинаково реагируют на болезнетворное воздействие. Реактивность может проявляться в форме: нормальной - нормергии, повышенной - гиперергии, пониженной - гипергии (анергии), извращенной - дизергии. При гиперергии (от греч. hyper - больше, ergon - действую) чаще преобладают процессы возбуждения. Поэтому более бурно протекает воспаление, интенсивнее проявляются симптомы болезни с выраженными изменениями деятельности органов и систем. Например, пневмония, туберкулез, дизентерия и т.д. протекают интенсивно, бурно, с ярко выраженными симптомами, с высокой лихорадкой, резким ускорением скорости оседания эритроцитов, высоким лейкоцитозом. Дизергия проявляется нетипичным (извращенным) реагированием больного на какоелибо лекарство, действие холода (расширением сосудов и увеличением потоотделения). РЕАКТИВНОСТЬ И РЕЗИСТЕНТНОСТЬ С понятием «реактивность» тесно связано другое важное понятие, также отражающее основные свойства живого организма, - «резистентность». Резистентность организма - это его устойчивость к действию патогенных факторов (от лат. resisteo - сопротивление). Резистентность организма к болезнетворным воздействиям выражается в различных формах. Естественная (первичная, наследственная) резистентность (толерантность) проявляется в виде абсолютной невосприимчивости (например, человека - к чуме рогатого скота, к собственным тканевым антигенам, животных - к венерическим заболеваниям человека) и относительной невосприимчивости (например, человека - к чуме верблюда, заболевание которой возможно при контакте с источником заражения на фоне переутомления и связанного с ним ослабления иммунологической реактивности). Приобретенная (вторичная, индуцированная) резистентность, которая может возникнуть в результате: перенесенных инфекционных заболеваний, после введения вакцин и сывороток, антигенной перегрузки в ответ на введение в организм большого количества белкового антигена (иммунологический паралич) либо при многократном введении малых количеств антигена - низкодозовая толерантность. Резистентность к неинфекционным воздействиям приобретается путем тренировок, например к физическим нагрузкам, действию ускорений и перегрузок, гипоксии, низким и высоким температурам и т.д. Резистентность может быть активной и пассивной. Активная резистентность возникает в результате активной адаптации (активного включения механизмов защиты) к повреждающему фактору. К таковым относятся многочисленные механизмы неспецифической (например, фагоцитоз, устойчивость к гипоксии, связанная с усилением вентиляции легких и увеличением числа эритроцитов) и специфической (образование антител при инфекции) защиты организма от болезнетворных влияний среды. Пассивная резистентность - не связанная с активным функционированием механизмов защиты, обеспечивается его барьерными системами (кожа, слизистые оболочки, гематоэнцефалический барьер). Примером может служить препятствие проникновению микробов и многих ядовитых веществ в организм со стороны кожи и слизистых оболочек, осуществляющих так называемую барьерную функцию, которая в целом зависит от их строения и свойств, полученных организмом по наследству. Эти свойства не выражают активных реакций организма на болезнетворные влияния, например устойчивость к инфекциям, возникающая при передаче антител от матери к ребенку, при заместительном переливании крови. Резистентность, как и реактивность, может быть: специфической - к действию какоголибо одного определенного патогенного агента (например, устойчивость к определенной инфекции) и неспецифической - по отношению к самым различным воздействиям. Нередко понятие «реактивность организма» рассматривается вместе с понятием «резистентность» (Н.Н. Сиротинин). Связано это с тем, что довольно часто реактивность представляет собой выражение активных механизмов возникновения резистентности организма к различным болезнетворным факторам. Однако бывают состояния организма, при которых реактивность и резистентность изменяются разнонаправленно. Например, при гипертермии, некоторых видах голодания, зимней спячке животных реактивность организма снижается, а его резистентность к инфекциям возрастает. ОСНОВНЫЕ МЕХАНИЗМЫ РЕАКТИВНОСТИ (РЕЗИСТЕНТНОСТИ)ОРГАНИЗМА Одной из важнейших задач патологии является раскрытие тех механизмов, которые лежат в основе реактивности (резистентности), поскольку от них зависит сопротивляемость и устойчивость организма к воздействию болезнетворных агентов. Как уже говорилось ранее, различные индивиды неодинаково восприимчивы к той или иной инфекции. Возникшее заболевание в зависимости от реактивности организма протекает по-разному. Так, заживление ран, при прочих равных условиях, у разных людей имеет свои характерные особенности. При повышенной реактивности заживление ран совершается относительно быстро, тогда как при пониженной реактивности оно происходит вяло, часто принимая затяжную форму. Функциональная подвижность и возбудимость нервной системы в механизмах реактивности Реактивность человека и животных всецело зависит от силы, подвижности и уравновешенности основных процессов (возбуждения и торможения) в нервной системе. Ослабление высшей нервной деятельности вследствие ее перенапряжения резко снижает реактивность (резистентность) организма к химическим ядам, бактериальным токсинам, инфицирующему действию микробов, антигенам. Функция эндокринной системы и реактивность В механизмах реактивности особое значение имеют гипофиз, надпочечники, щитовидная и поджелудочная железы. Наибольшее воздействие на проявления реактивности организма оказывают гормоны передней доли гипофиза (тропные гормоны), стимулирующие секрецию гормонов коры надпочечников, щитовидной, половых и других желез внутренней секреции. Значение надпочечников в механизме реактивности определяется в основном гормонами коркового вещества (кортикостероидами). Значительное влияние на проявление реактивности оказывает щитовидная железа, что обусловлено ее функциональной взаимосвязью с гипофизом и надпочечниками. Животные после удаления щитовидной железы становятся более устойчивыми к гипоксии, что связано с понижением обмена веществ и потребления кислорода. При недостаточной функции щитовидной железы утяжеляется течение слабовирулентных инфекций. Функция иммунной системы Иммунные механизмы являются центральным звеном реактивности организма, поддерживающим его гомеостаз (прежде всего антигенный). Противоинфекционный иммунитет (в дальнейшем, иммунитет) – это резистентность организма к действию инфекционных факторов. Как и резистентность вообще иммунитет разделяют на: (а) пассивный и активный, (б) неспецифический и специфический, (в) врожденный (видовой) и приобретенный (индивидуальный). С учетом этого деления можно выделить четыре группы основных механизмов, лежащих в основе иммунитета: * неспецифические факторы пассивного иммунитета (ареактивность клеток, физические и физически-химические факторы, биологические барьеры); • неспецифические механизмы активного иммунитета (гуморальные – комплемент, интерферон; клеточные – фагоцитоз); • специфические механизмы активного иммунитета, то есть те, что основываются на иммунологические реактивности (гуморальные антитела, клеточные – T-лимфоциты); • специфические факторы пассивного иммунитета (введенные извне антитела, сыворотки, иммунные T-лимфоциты). Рассмотрим три основные группы факторов, обеспечивающих неспецифическую резистентность организма к инфекциям. Факторы неспецифической пассивной резистентности. Система комплемента Нечувствительность к инфекционным агентам может быть обусловлена факторами, которые делают невозможным проникновение, размножение и, в конечном итоге, взаимодействие микробов со структурами организма. К таковым, в частности, относятся ареактивность клеток, физически-химические факторы, биологические барьеры. Ареактивность клеток. Под этим термином понимают неспособность клеток взаимодействовать с микробом и (или) его продуктами. Ареактивность клеток лежит в основе видового иммунитета. Она может быть обусловлена: Физические и физически-химические факторы. Таковыми, в частности, являются: а) температура тела. б) pH среды. в) напряжение кислорода в тканях. Биологические барьеры. В общих чертах, это - структурные образования, которые разделяют две разных среды и обеспечивают непроницаемость одних (собственно барьерная функция) и проницаемость других (транспортная функция) факторов из одной среды во вторую. В основе собственно барьерной функции этих структур лежит их способность быть (а) механической преградой, (б) химическим барьером (напр., бактерицидность поверхности барьера), (в) содержать на своей поверхности клетки (лейкоциты) и вещества (антитела – IgA), которые связывают и уничтожают микроорганизмы. Все биологические барьеры, в зависимости от того, какие среды они разграничивают, можно разделить на такие виды: 1) внешние барьеры – структуры, отделяющие внутреннюю среду организма от внешней (кожа, слизистые оболочки). Барьерные свойства кожи обусловлены (а) ее способностью быть механическим барьером для многих микробов и (б) бактерицидными свойствами молочной и жирных кислот, входящих в состав секретов потовых и сальных желез. Слизистые оболочки, кроме того, что (а) механическим барьером, имеют способность (б) удалять микробы со своих поверхностей благодаря специальным образованием (напр., реснички цилиндрического эпителия дыхательных путей) и рефлекторным реакциям (кашель, чихание), (в) убивать инфекцию с помощью бактерицидных компонентов, содержащихся в секретах (лизоцим, желчь, пищеварительные ферменты); (г) уничтожать микроорганизмы с помощью секреторного типа антител – IgA и лейкоцитов, что постоянно эмигрируют на поверхность слизистых оболочек; 2) гематопаренхиматозные (гистогематические) барьеры – структуры, разделяющие кровь и другие ткани. Они, в свою очередь, бывают неспециализированными и специализированными. Неспециализированные гематопаренхиматозные барьеры представляют собой стенку кровеносного капилляра, состоящее из эндотелия и базальной мембраны. Такие структуры, как правило, не являются препятствием для микробов: последние легко проникают из крови в ткани, распространяются по организму, становятся причиной вторичных (метастатических) очагов инфекции. Специализированные гематопаренхиматозные барьеры имеют значительно более сложное строение. Кроме капиллярной стенки в их состав входят дополнительные структуры (напр., клетки микроглии – астроциты – в тканях головного мозга, два слоя цилиарного эпителия в тканях глаза). Важное для барьерной функции значение имеет и особая укладка эндотелиальных клеток на базальной мембране: они теснее, чем в других капиллярах, прилегающих друг к другу, а в сосудах головного мозга даже накладываются одна на одну, образуя поверхность, похожую на крышу, покрытую черепицей. В организме человека существует пять специализированных гематопаренхиматозных барьеров: (1) гематоэнцефалический, (2) гематоофтальмический, (3) гематотиреоидный, (4) гематотестикулярный и (5) гематокохлеарный. 3) клеточные и внутриклеточные барьеры. Они представлены плазматической мембраной, отделяющей цитоплазму клетки от интерстиция, и мембранами органелл (митохондрий, лизосом, эндоплазматического ретикулума, ядра и др.), которые разделяют клетку на отдельные ее отсеки (компартменты). Часто для проникновения микробов и их продуктов в клетку нужны специфические белковые молекулы – клеточные рецепторы. Отсутствие таковых (см. выше – ареактивность) делает клетки нечувствительными к инфекционным возбудителям. 2. Гуморальные механизмы неспецифической активной резистентности. В осуществлении противомикробной защиты важную роль играют гуморальные факторы, способные самостоятельно или в содружестве с другими факторами (антителами, фагоцитами) уничтожать инфекцию. Среди них, бесспорно, центральное место занимает система комплемента. Комплемент – это система белков сыворотки крови, последовательная активация которых вызывает повреждение (перфорацию) клеточных мембран и, как следствие, уничтожение (лизис) бактерий. В состав комплемента входит 20 белков, 9 из которых являются основными компонентами комплемента; их обозначают С1, С2,... С9 (фракция C1 представлена тремя белками: C1q, C1r и C1s). При ферментативном расщеплении компонентов комплемента образуются промежуточные и побочные продукты: первые обозначают добавлением к названию буквы "b" (напр., C3b, C5b), вторые – буквы "a" (напр., C3a, C5a). Компоненты комплемента синтезируются гепатоцитами и макрофагами, они являются глобулинами, на которые приходится около 10% от общего количества белков плазмы крови. Большинство компонентов комплемента по своим функциональным признакам – неактивные протеазы или составные части ферментативных протеолитических комплексов. Активация комплемента принципиально не отличается от активации других протеолитических систем плазмы крови, в частности системы свертывания и заключается сначала в образовании активных протеаз, а в конечном итоге – продукта, который и осуществляет основную функцию комплемента – повреждения и уничтожения микробных клеток. Иммунологическая реактивность Иммунологическая реактивность-это способность организма отвечать на действие антигенов образованием антител и комплексом клеточных реакций, специфических в отношении данного антигена. Иными словами, это свойство организма давать иммунный ответ, главное предназначение которого заключается в сохранении антигенного гомеостаза. В основе иммунологической реактивности лежит способность иммунной системы различать "свое" от "чужого" и инициировать процессы уничтожения последнего. Существует два механизма иммунологической реактивности: гуморальный и клеточный. Гуморальный тип иммунного ответа направлен на внеклеточные антигены, а именно (1) бактерии (2) бактериальные токсины, (3) вирусы. Эффекторным звеном этого типа ответа являются антитела (иммуноглобулины) – продукты деятельности в-лимфоцитов. Клеточный тип иммунного ответа направлен на защиту от внутриклеточных антигенов и клеток, несущих чужеродную генетическую информацию. Эта защита осуществляется выявлением и уничтожением (1) клеток, пораженных вирусами и некоторыми бактериями (напр., микобактериями туберкулеза); (2) патогенных грибов, (3) паразитов, (4) перерожденных, то есть опухолевых клеток; (5) клеток трансплантированных органов и тканей. Его эффекторным звеном являются иммунные Т-лимфоциты, которые несут специфические рецепторы к данному антигену. Клеточный иммунный ответ Иммунопогическая толерантность. Первичные и вторичные иммунодефициты Иммунологическая толерантность (ИТ) (tolerantia - терпимость) - отсутствие иммунного ответа на определенный антиген, т.е. специфическая ареактивность иммунной систиемы, не связанная с ее повреждением (иммунодепрессией), при сохранении способности развивать иммунного ответана другие антигены. Благодаря феномену иммунологической толерантности не происходит специфическая элиминация антигена. Виды иммунологической толерантности: I. Врожденная или естественная ИТ - развивается при контакте с антигеном в эмбриональном или неонатальном периоде развития особи. II. Приобретенная ИТ: а) иммунологическая толерантность "низкой дозы", б) иммунологическая толерантность "высокой дозы". Механизмы иммунологической толерантности: 1. Естественная иммунологическая толерантность обусловлена селекцией клонов, активацией в период внутриутробного развития T-супрессоров аутореактивных клонов лимфоцитов. а) приобретенная иммунологическая толерантность "низкой дозы" опосредована активацией антиген-специфических T-супрессоров, блокирующих ИО, б) иммунологическая толерантность "высокой дозы" отчасти опосредована активацией T-супрессоров, реагирующих на супраоптимальные дозы антигена, кроме того действует механизм "иммунологического паралича". Первичные и вторичные иммунодефициты. Иммунодефициты разделяют на две группы — первичные (врожденные), как правило, имеющие наследственную природу, и вторичные (приобретенные), вызванные различными воздействиями, как эндогенными (болезни), так и экзогенными (действием агрессивных физических и химических факторов). Формы и механизмы первичных иммунодефицитов: - первично повреждение локализовано в иммунной системе и обусловлено аномальным генотипом (унаследованным). Ранними симптомами при первичных ИД являются поражения кожных и слизистых оболочек в виде пятен цвета "кофе с молоком", депигментации, экземы, нейродерматита, ангионевротического отека. I. Комбинированная иммунологическая наследственная недостаточность: а) ретикулярная дисгенезия представляет собой дефект системы костномозгового кроветворения, в результате которого не образуются клетки-предшественницы миелои лимфопоэза, б) агаммаглобулинемия швейцарского типа. II. T-клеточный иммунодефицит : а) синдром Ди Джорджи, характеризуется гипоплазией тимуса, в результате чего нарушается дальнейшая дифференцировка претимических T-предшественников, б) синдром Незелоф характеризуется гипоплазией тимуса, очевидно из-за нарушения процесса миграции T-предшественников в тимус, в) наследственная недостаточность фермента пурин-нуклеозид-фосфорилазы, из-за чего страдают процессы дифференцировки T-клеток в тимусе, г) синдром Луи-Бар (атаксия-телеангиоэктазия) нарушена посттимическая дифференцировка T-клеток, что сочетается с недостаточностью IgE и IgA. III. B-клеточный иммунодефицит: а) агаммаглобулинемия Брутона обусловлена нарушением дифференцировки клетокпредшественниц лимфопоэза в клетки предшественницы B-лимфопоэза. б) гипоиммуноглобулинемия с макроглобулинемией нет IgG и IgA. в) селективный дефицит IgA. IV. Дефицит клеток миелоидного ряда: а) хронический гранулематоз, наследственный дефект ферментов гексозомонофосфатного цикла ведет к снижению микробоцидного потенциала нейтрофилов и они фагоцитируют, но не убивают микроорганизмы, б) синдром Вискотта-Олдрича. Нарушена способность макрофагов презентировать антиген, в) синдром Чедиака-Хигаси - нарушена структура и функциональная активность лизосом, г) наследственная недостаточность миелопероксидазы, д) синдром "ленивых лейкоцитов" - нарушена реакция нейтрофилов на хемотаксические стимулы. V. Дефицит системы комплемента: а) дефицит ингибиторов и инактиваторов, стабилизирующих систему, что приводит к перерасходу компонентов комплемента, б) дефицит начальных факторов отменяет активацию комплемента в целом, в) дефицит терминальных компонентов C5-C9 нарушает образование МАК (мембранноатакующего комплекса). Основные механизмы вторичных иммунодефицитов. Повреждение системы имеет первичный или вторичный характер и может быть обусловлено инфекциями иммунной системы, лимфопролиферативными заболеваниями, истощением ИС вследствие ее патологических реакций и многими другими факторами: 1) химическая, в том числе лекарственная и токсическая иммунодепрессия, 2) лучевая иммунодепрессия, 3) иммунодепрессия гормонами и биологически активными веществами, 4) метаболическая иммунодепрессия, 5) иммунодепрессия в процессе старения, 6) истощение звеньев ИС вследствие иммунопатологических реакций, 7) истинная блокада РЭС, 8) лимфопролиферативные заболевания, 9) инфекционная иммунодепрессия, 10) иммунологическая иммунодепрессия, 11) хирургическая иммунодепрессия. Основные проявления ИД: 1) рецидивирующие инфекции, вызванные различными инфекционными агентами в зависимости от вида ИД. При нарушении В-звена - рецидивирующие бактериальные инфекции (сепсис, пневмония), при недостаточности Т-звена - вирусные и грибковые инфекции, 2) опухолевый рост, лимфопролиферативные заболевания, 3) склонность к аутоиммуноагрессии и аллергии, 4) нарушение гемопоэза, 5) патология желудочно-кишечного тракта - расстройства переваривания, 6) при первичных ИД часто встречаются врожденные уродства, патология опорнодвигательного аппарата и нервной системы. При вторичных ИД нередко также страдает пролиферация и дифференцировка клеток, может сокращаться численность клеток-эффекторов или возникать их функциональная неполноценность, избыток одних гуморальных факторов регуляции и недостаток других факторов, патологическая активация Т-супрессоров и избирательное подавление хелперного потенциала. Принципы патогенетической терапии ид: 1. Заместительная терапия - восполнение дефектного звена. 2. Предупреждение инфекционных осложнений (антибиотики, безмикробная среда). 3. Коррекция нарушений обмена веществ (белки, витамины, микроэлементы). 4. Иммуностимуляторы: Т-активин, В-активин, нуклеинат Na, левамизол, тафтсин, диуцифон и др. Аллергия Аллергия, или повышенная чувствительность (англ. hypersensitivity) к веществам антигенной природы, – это патологический процесс, основу которого составляют иммунные реакции организма, сопровождающиеся повреждением собственных тканей. Понятие "аллергия" и "иммунитет" имеют много общего и отличного. Общее заключается в том, что их основу составляют иммунные реакции гуморального и клеточного типа, которые обеспечивают защиту организма против антигенов. Однако, в условиях иммунитета уничтожение антигена происходит без повреждения собственных тканей, в то время как при аллергии такое повреждение всегда имеет место, что, в конце концов, и отличает аллергию от иммунитета. Таким образом, иммунитет является исключительно защитным явлением (резистентностью), зато, аллергия – это патологический процесс, потому что сочетает в себе два противоположных компонента: (1) защитный (уничтожение антигена так же, как и в условиях иммунитета) и (2) собственно патологический (повреждение тканей организма). Причины. Причиной аллергии являются вещества антигенной природы-аллергены. В зависимости от строения они могут быть (1) полными и (2) неполными (гаптенами). По происхождению различают (1) экзогенные и (2) эндогенные аллергены. Экзогенные аллергены – это вещества, поступающие в организм извне. Для их характеристики используются различные принципы классификации. 1. По способу проникновения в организм различают (а) ингаляционные, (б) продукты, (в) контактные, (г) инъекционные аллергены. 2. По происхождению экзогенные аллергены бывают (а) растительные, б) животные, (в) инфекционные (бактериальные, вирусные, грибковые), (г) синтетические. 3. В зависимости от источника поступления в организм выделяют аллергены (а) бытовые (домашняя пыль, библиотечная пыль), (б) промышленные (бензол, формалин и др.), (в) пищевые (содержащихся в продуктах питания), (г) лекарственные (антибиотики, сульфаниламиды и др.), (д) пыльцевые (пыльца трав, цветов), (д) эпидермальные (компоненты шерсти животных). Эндогенные аллергены, или аутоаллергены, - это молекулы собственного организма, имеющие или приобретшие способность вызывать аллергию. Их разделяют на две группы: (1) естественные и (2) приобретенные. 1. Природные эндоаллергены – это нормальные, неизмененные белки некоторых органов и тканей, в частности, (а) головного мозга, (б) глаза, (3) семенник, (4) щитовидной железы и (5) внутреннего уха. Общая черта этих структур заключается в том, что все они являются забарьерными органами, то есть имеют, в отличие от других органов и тканей, особым образом устроенные (специализированные) гистогематические барьеры: гематоэнцефалический, гематоофтальмический, гематотестикулярный, гематотиреоидный, гематокохлеарный . Их существование делает невозможным контакт иммунокомпетентных клеток с антигенами тканей забарьерных органов в период эмбриогенеза, когда происходит становление иммунологической толерантности к собственным белкам (см. ниже). Невозможность такого контакта и является причиной того, что к антигенам пяти указанных выше структур не сформировалась иммунологическая толерантность, то есть в организме в течение жизни существуют клоны лимфоцитов, способные реагировать на них так же, как и на чужие белки. 2. Приобретенные эндоаллергены – собственные макромолекулы организма, которые изменили свою пространственную структуру под воздействием факторов внешней среды, вследствие чего приобрели новые антигенные свойства. В зависимости от природы внешних факторов, вызывающих перестройку белковых молекул, приобретенные эндоаллергены бывают (а) неинфекционными (напр., ожоговые, холодовые, лучевые) и (б) инфекционными. Последние представляют собой молекулы макроорганизма (а не микробов!), изменившиеся под влиянием инфекционных агентов или продуктов их жизнедеятельности. Инфекционные эндоаллергены могут быть (а) простыми и (б) комплексными (тканьмикроб, ткань-токсин). Стоит отметить, что термины "холодовая аллергия", "лучевая аллергия" и подобные не совсем точно отражают суть процессов, происходящих в организме. Ведь можно было бы думать, что аллергенами в этих случаях выступают физические факторы (низкая температура, лучи и тому подобное). На самом же деле эти факторы являются причиной не аллергии, как таковой, а изменений структуры собственных белков организма, в результате чего те становятся эндоаллергенами и начинают весь комплекс нарушений, характерных для аллергических реакций. Классификация. Патогенез. Существуют различные классификации аллергических реакций. Одни из них (напр., за Куком) имеют, скорее, историческое значение, другие (скажем, классификация Кумбса и Джелла) – широко используются в настоящее время как в экспериментальной, так и в клинической медицине. I. По происхождению аллергенов можно выделить (а) аллергические реакции, вызванные экзогенными аллергенами, и (б) автоалергічні реакции. II. По клиническим признакам (классификация Кука) различают (а) аллергические реакции немедленного типа и (б) аллергические реакции замедленного типа. В основу этой классификации положено время появления признаков аллергической реакции после контакта организма с аллергеном. Реакции немедленного типа возникают сразу или в первые 15-20 мин после контакта аллергена с сенсибилизированным организмом. Такими, например, являются анафилактический шок, бронхиальная астма, аллергия на пыльцу растений и др. Реакции замедленного типа проявляют себя через 24-48 ч после контакта аллергена с сенсибилизированным организмом. Примером таких реакций могут быть туберкулиновая проба, реакция отторжения трансплантата и др. III. По характеру и месту взаимодействия аллергена с эффекторами иммунной системы (классификация Кумбса и Джелла) аллергические реакции разделяют на четыре типа: I тип-анафилактические реакции; II тип-цитотоксические реакции; III тип-иммунокомплексные реакции; IV тип-гиперчувствительность замедленного типа IV. По механизмам иммунологической реактивности, лежащие в основе патогенеза аллергии, можно выделить (а) реакции гуморального типа (к ним относят I, II и III типы реакций за Кумбсом и Джеллом) и (б) реакции клеточного типа (IV тип реакций за Кумбсом и Джеллом). Патогенез. В развитии аллергических реакций различают три последовательные стадии: (1) иммунологическую, (2) патохимическую и 3) патофизиологическую (стадию клинических проявлений). I. Иммунологическая стадия. Она охватывает период времени от первого контакта аллергена с организмом к взаимодействию этого же аллергена (как правило, при повторном поступлении его в организм) с эффекторами иммунной системы (антителами или Т-лимфоцитами). Суть этой стадии заключается в сенсибилизации организма, то есть в создании состояния повышенной его чувствительности к данному антигену. Основу сенсибилизации составляют два последовательных процесса: (1) активация антигенспецифических лимфоцитов, их пролиферация и образование антител или сенсибилизированных Т-лимфоцитов и (2) распределение образованных эффекторов иммунного ответа в тканях организма. Сенсибилизация может быть (а) активной и (б) пассивной. При активной – в организме самостоятельно продуцируются антитела или сенсибилизированные Т-лимфоциты, в то время как при пассивной – сенсибилизация возникает вследствие введения извне специфических к данному антигену готовых антител или сенсибилизированных Тклеток. II. Патохимическая стадия. Это период времени от начала взаимодействия аллергена с эффекторами иммунной системы (антителами или Т-лимфоцитами) до появления биологически активных веществ – медиаторов аллергических реакций. Сущность этой стадии заключается в (а) образовании, (б) высвобождении и (в) активации указанных медиаторов. III. Патофизиологическая стадия, или стадия клинических проявлений. Она охватывает период времени от начала действия медиаторов аллергических реакций на клеточные и тканевые структуры организма до появления клинических признаков. Ее сущность-в развитии комплекса структурных и функциональных нарушений в организме, проявляющих себя определенными клиническими признаками. Все три стадии аллергических реакций имеют свои особенности в зависимости от типа реакций по классификации Кумбса и Джелла. А потому остановимся подробно на каждом из этих типов. Патогенез аллергических реакций I типа Патогенез аллергических реакций II типа Патогенез аллергических реакций III типа Патогенез IV типа гиперчувствительности Лечение В лечении наиболее важным моментом является устранение контакта с аллергенами из окружающей среды. Медикаментозное лечение аллергии довольно ограничено. Так как на протяжении уже довольно длительного периода времени поиски эффективного метода лечения аллергии так и не принесли очевидного результата, следует признать, что современная медицина пока не проникла в суть аллергии, процесса её возникновения и развития. Гипосенсибилизация и десенсибилизация -- специфические формы иммунотерапии при которой пациент постепенно вакцинируется нарастающими дозами специфического антигена. Это может привести как к снижению тяжести, так и к полной ликвидации гиперчувствительности. Суть метода состоит в стимуляции секреции IgG («блокирующие антитела»), которые связывают попавший в организм антиген до того, как он прореагирует с IgE (секретируемые в избытке при гиперчувствительности I типа) и тем самым предотвращают развитие аллергической реакции. Другая форма иммунотерапии включает внутривенные инъекции моноклональных антител анти-IgE, которые связывают свободные IgE и IgE на поверхности лимфоцитов В, что служит сигналом к разрушению IgE. Они не связываются с IgE, фиксированными на поверхности базофилов и мастоцитов посредством Fc рецепторов, в противном случае они вызвали бы развитие аллергической реакции. Первым агентом из этой группы является омализумаб (omalizumab). Такие инъекции делаются регулярно, при этом дозу постоянно увеличивают. При проведении иммунотерапии в течение нескольких месяцев 2 раза в неделю следует посещать врача. Доза препарата повышается с каждым разом до тех пор, пока не установится точная доза лекарства. Если инъекции помогают, то посещение врача должно быть каждые 2-4 недели в течение нескольких лет. В это время симптомы аллергии будут более слабыми, менее частыми и аллергия может совсем пройти. Псевдоаллергия Псевдоаллергия – патологический процесс, клинически сходный с проявлениями аллергической реакции, но не имеющий иммунологической стадии развития. Патохимическая и патофизиологическая стадии сходны при псевдоаллергии и истинной аллергии. К псевдоаллергическим процессам относятся те, в развитии которых ведущую роль играют такие медиаторы, которые образуются также и в период патохимической стадии истинных аллергических реакций. Вещество, вызывающее развитие псевдоаллергии, называют псевдоаллергеном. Псевдоаллерген действует непосредственно на клетки-эффекторы (тучные клетки, базофилы) или биологические жидкости и вызывает высвобождение из клеток или образование в жидкостях медиаторов. Псевдоаллергические реакции встречаются чаще всего при лекарственной и пищевой непереносимости. В патогенезе псевдоаллергии принимают участие следующие механизмы: 1. гистаминовый; 2. нарушение активации комплемента; 3. нарушения метаболизма арахидоновой кислоты. В каждом конкретном случае ведущую роль играет один из этих механизмов. 1. Гистаминовый тип псевдоаллергии заключается в увеличении в биологических жидкостях концентрации свободного гистамина, который оказывает через Н1-и Н2рецепторы клеток-мишеней патогенное действие. Н1-рецепторы выявлены на гладких мышцах бронхов и сосудов; Н2-рецепторы – на париетальных клетках слизистой оболочки желудка. 2. Нарушение активации системы комплемента. Псевдоаллергические механизмы второго типа связаны с неадекватным усилением классического или альтернативного пути активации комплемента. В результате активации комплемента образуются медиаторные пептиды с анафилактической активностью, которые вызывают высвобождение медиаторов из тучных клеток, базофилов, тромбоцитов, нейтрофилов, приводят к агрегации лейкоцитов, спазму гладких мышц и другим эффектам. 3. Нарушение метаболизма арахидоновой кислоты. Механизмы третьего типа, участвующие в развитии псевдоаллергии, связаны с нарушением метаболизма ненасыщенных жирных кислот и, в первую очередь, арахидоновой. Она высвобождается из фосфолипидов клеточных мембран нейтрофилов, макрофагов, тучных клеток, тромбоцитов и др. под действие внешних стимулов (повреждение лекарством, эндотоксином и др.). Освободившаяся арахидоновая кислота метаболизируется. В первом пути метаболизма вначале образуются циклические эндопероксиды, которые затем переходят в простагландины Е2, F2 альфа и D2, простациклин и тромбоксаны. Во втором пути – образуются лейкотриены А4, В4, С4. Образующиеся продукты метаболизма арахидоновой кислоты оказывают выраженное биологическое действие на функцию клеток, тканей, органов и систем организма. ВОСПАЛЕНИЕ В общей патологии воспаление рассматривают как типовой общепатологический процесс, т. е. универсальную, стандартную форму ответа организма на действие различных болезнетворных факторов. Особенность воспаления как биологического процесса заключается в его защитноприспособительной функции, которая состоит в сосудисто-мезенхимальной реакции на повреждение, направленной на ликвидацию повреждающего агента, и восстановление поврежденной ткани. Воспалительная реакция организма сложилась в ходе эволюционного развития животного мира. Это одна из самых древних реакций организма. По мере развития живых организмов она усложнялась и превращалась в сложную сосудистотканевую реакцию. История учения о воспалении начинается с древнегреческого врача Гиппократа, который "воспаление" и "болезнь" употребляет как тождественные понятия. Для Гиппократа воспаление было только наиболее характерной формой болезни, без труда обнаруживаемой при визуальном наблюдении. Воспаление - типовой патологический процесс, возникающий в ответ на повреждение и проявляющийся комплексом структурных, функциональных и метаболических нарушений и расстройством микроциркуляции. Римский ученый А. Цельс в своем трактате "О медицине" описал следующие основные симптомы воспаления (внешние признаки): красноту (rubor), припухлость (tumor), жар (calor) и боль (dolor). Римский врач и естествоиспытатель К.Гален к этим четырем признакам воспаления прибавил пятый - нарушение функции (functio laesa). Воспаление – это сложная реакция целостного организма, которая возникает обычно в месте воздействия болезнетворного фактора как экзогенного, так и эндогенного происхождения. При этом отмечается целый комплекс сосудисто-тканевых изменений как функционального, так и морфологического характера. Это наиболее частая форма среди типовых патологических процессов, лежащая в основе многих клинически различных заболеваний. В эволюционном плане воспалительная реакция сложилась как защитная реакция организма, носит приспособительный характер. Одной из особенностей воспаления является повышение обмена веществ в очаге воспаления, отсюда происходит его латинское название «inflammatio» (воспаление). Название воспаления отдельных органов складывается из названия самого органа с окончанием «ит» (itis), обозначающем в латинском языке воспаление. Например, воспаление плевры – плеврит, воспаление аппендикулярного отростка – аппендицит и т.д. Хотя есть и исключения из этого правила, например, пневмония – воспаление легких, флегмона – воспаление клетчатки и т.д. Патогенез воспаления Динамика воспалительного процесса, независимо от вызывающих его причин, всегда достаточно стандарта. Патогенетическую основу воспаления составляют три взаимосвязанных компонента – альтерация, сосудистые расстройства с явлениями экссудации и эмиграции лейкоцитов и пролиферация. Альтерация (от лат. alteration – изменение, alter – иной) – это комплекс обменных, физико-химических, структурно-функциональных изменений в очаге воспаления, а также образование и (или) активация медиаторов воспаления. Иначе говоря, это комплекс структурных и функциональных изменений вследствие нарушение питания и обмена веществ в очаге воспаления. Выделяют первичную и вторичную альтерацию (дистрофию) в очаге воспаления. Первичная альтерация возникает в ответ на прямое воздействие флогогенного агента. Реакция первичной альтерации как бы пролонгирует действие причины воспаления. Вторичная альтерация возникает под действием факторов первичной альтерации. Эти воздействия опосредованы нервной системой, физико-химическими факторами (ацидоз, дисиония и т.д.), а в основном – медиаторами воспаления. Воспаление начинается с нарушения обмена веществ в очаге, которое носит как качественный, так и количественный характер. В частности, по выражению немецкого ученого Шаде, в очаге воспаления происходит «пожар обмена», т.е. все интенсивно горит, но не сгорает. Интенсификация обмена веществ обусловлена выходом лизосомальных ферментов из клеток поврежденной ткани, что приводит к усилению распада белков, жиров, углеводов и, таким образом, возрастанию потребности в кислороде для обеспечения биологического окисления (относительная недостаточность кислорода). В последующем вследствие замедления кровотока в микроциркуляторном русле снижается доставка кислорода. В результате дефицита кислорода (относительного и абсолютного) наблюдается усиление анаэробного гликолиза и тканевого дыхания, разобщение окисления и фосфорилирования, снижение анаболизма, недоокисление продуктов, медленное выведение кислых продуктов (молочной кислоты, пировиноградной кислоты, жирных кислот, кетоновых тел, аминокислот, БАВ) и накопление их в очаге воспаления (ацидоз или по Шаде Н+ гипериония). Следствием указанных изменений является увеличение теплопродукции, дефицит макроэргов, накопление продуктов обмена, образование медиаторов воспаления. Нарушение минерального обмена в очаге воспаления сопровождается увеличением концентрации K+, Na+, Ca2+, что способствует усилению проницаемости сосудов, повышению экссудации и местному отеку и повышению осмотического давления (гиперосмия по Шаде). Этим объясняются главные признаки воспаления – припухлость и боль. Изменение соотношения K+, Na+, Ca2+ определяет высвобождение ацетилхолина. Комплекс физико-химических изменений в очаге воспаления сводится к следующему. Накопление недоокисленных продуктов (молочной кислоты, аминокислот и проч.) приводит ацидозу (Н+ - гипериония). Кислотность среды снижается до 6,8-6,0 и ниже. Ацидоз вначале носит компенсированный характер (за счет буферных систем ткани и крови), затем может переходить в некомпенсированный («пожар обмена» нарастает, отток крови замедляется), и тогда наступает гибель клеток, мертвая ткань подвергается автолизу (расплавлению) с образование аммиака, поэтому в гнойном фокусе воспаления реакция ткани щелочная. Ацидоз и другие нарушения обмена, являющиеся следствием интенсификации обмена, ведут к повышению концентрации молекул в очаге воспаления, которые в растворе определяют осмотическое давление. Т.е. в очаге воспаления возникает осмотическая гипертония (гиперосмия по Шаде). Давление при этом увеличивается до 19-20 атм. (при норме 8 атм.). Этот факт способствует выходу жидкой части крови из сосуда в ткань (экссудации) и нарастанию механического давления. Кроме того, ацидоз ведет к повышению дисперсности и гидрофильности коллоидов, набуханию их, таким образом повышению онкотического давления (гиперонкия по Шаде). Эти три явления в очаге воспаления названы Шаде гиперплетией ткани (от слова греч. hyper – сверх, слишком, plethysmus – увеличение). Медиаторы воспаления Медиаторы воспаления – это комплекс физиологически активных веществ, опосредующих действие флогогенных факторов, определяющих развитие и исходы процесса воспаления. Вследствие действия этиологического фактора происходит первичная альтерация, в частности, повреждение лизосом. Вследствие этого происходит высвобождение ферментов, продолжающих деструкцию (вторичная альтерация) и приводящих к образованию медиаторов. Т.е. лизосомы можно считать стартовой площадкой воспаления. По происхождению условно различают клеточные и плазменные (гуморальные) медиаторы. К клеточным медиаторам относят группу веществ, которые образуют клетки, принимающие участие в развитии воспаления: 1. Полиморфноядерные лейкоциты (ПЯЛ), в основном нейтрофилы и базофилы, являются источником: высокоактивных лизосомальных гидролаз; клеточных белков; простагландинов; лейкотриенов; интерлейкинов; биогенных аминов. Эозинофилы в очаге воспаления участвуют, в основном, в обезвреживании оксидантов и лейкотриенов. Эти клетки играют важную роль в развитии аллергического компонента воспаления. 2. Мононуклеарные клетки – лимфоциты, моноциты, тканевые макрофаги – вырабатывает лимфокины и монокины, а также выделяют большое количество ферментов (протеазы, эстеразы, гидролазы). 3. Тромбоциты являются источником: адгезивных белков; АДФ; серотонина; лизосомальных ферментов; фактора Виллебранда. 4. Тучные клетки (лаброциты) выделяют: биогенные амины; фактор активации тромбоцитов (ФАТ); лейкотриены (входят в состав МРС анафилаксии); эозинофильный хемотаксический фактор; нейтрофильный хемотаксический фактор; гепарин. 5. Другие клетки тканей, подвергающихся активации или разрушению, могут быть источниками: лизосомальных ферментов; простагландинов; продуктов перекисного окисления липидов и др. Группу плазменных медиаторов составляют вещества, поступающие в очаг воспаления в основном из плазмы крови. К ним относятся компоненты системы комплемента, кинины, факторы свертывающей системы крови и др. Клеточные и плазматические медиаторы взаимодействуют. Например, многие продукты ПЯЛ опосредуют свое влияние на проницаемость сосудов через плазменные факторы: фактор Виллебранда системы свертывания крови является активатором тромбоцитов. Сосудистая реакция при воспалении Сосудистая реакция при воспалении возникает одновременно с альтерацией и обусловлена как действием самого флогогенного агента, так и БАВ, образующихся в очаге воспаления. Микроциркуляцию в очаге изучают в опыте Конгейма, где можно наблюдать пять этапов сосудистых расстройств. Вначале наступает кратковременный спазм сосудов, который носит рефлекторный характер (до 30 минут). Вслед за этим наступает артериальная гиперемия. Она является результатом: 1. образования в воспалительном очаге большого количества медиаторов воспаления, вызывающих расслабление мышечных элементов стенки артериол и прекапиляров; 2. доминирование холинергических влияний на стенку сосуда; 3. ацидоза; 4. гиперкалийионии; 5. разрушения соединительнотканных муфт вокруг сосудов. Стадия артериальной гиперемии характеризуется: 1. расширением сосудов в микроциркуляторном русле; 2. усилением скорости кровотока в них; 3. раскрытием в норме нефункционирующих сосудов; 4. повышением в этом участке КД. Затем артериальная гиперемия сменяется венозной. Венозная гиперемия является следствием: 1. микротромбоза вен и лимфатических сосудов вследствие активации фактора Хагемана и уменьшения содержания гепарина; 2. набухания эндотелия; 3. потери венулами эластичности (они становятся более податливыми к сдавливающему действию воспалительного инфильтрата); 4. выхода жидкой части крови в воспаленную ткань и сгущению крови; 5. сдавления сосудов экссудатом; 6. краевого стояния лейкоцитов; 7. сладжирования крови; 8. несоответствия притока крови оттоку. В этой стадии наблюдается замедление тока крови, застой, гипоксия и цианоз воспаленного участка. Меняется характер кровотока – лейкоциты начинают уходить из осевого слоя в пристеночный, изменяются реологические свойства крови – она становится густой и вязкой, эритроциты набухают и образуют агрегаты, которые медленно движутся. Центральным явлением этой стадии является выход жидкой части крови за пределы сосудов (экссудация) и начинающаяся эмиграция форменных элементов. Престатическая фаза расстройств микроциркуляции характеризуется феноменом краевого стояния лейкоцитов, толчкообразным кровотоком и маятникообразным движением крови в сосудах. Она является закономерным следствием возникающих расстройств микроциркуляции в предшествующих стадиях и нарушения обмена веществ (формируется «порочный круг» патогенеза). Наконец, движение крови прекращается полностью и наступает стаз. С одной стороны, в результате стаза формируется своеобразный барьер, обеспечивающий ограничительную функцию очага воспаления (локализация). С другой стороны, следствием стаза могут быть необратимые изменения клеток крови и ткани. Центральным явлением расстройств микроциркуляции (сосудистой реакции) при воспалении является процесс экссудации жидкой части крови, эмиграции форменных элементов и явления фагоцитоза. Экссудация Экссудацией называется процесс выхода жидкой части крови (в том числе растворимых белков, электролитов и клеток) из сосудов в окружающую ткань. Вышедшая в воспаленную ткань жидкость называется экссудатом. Экссудат отличается от транссудата (отечной или водяночной жидкости) тем, что в нем содержится большое количество белка (не меньше 3-5%), ферменты, иммуноглобулины, клетки крови, остатки тканевых элементов, снижается показатель рН до 6,8-6,0 и ниже, меняется соотношение альбуминов и глобулинов в пользу глобулинов. Экссудация происходит главным образом в капиллярах, отчасти – артериолах. На процессы экссудации влияют, в основном, следующие факторы: 1. Фильтрационное давление крови. При венозном полнокровии увеличивается гидродинамическое давление (ГД) в венулах (в артериальную фазу в артериолах), вследствие этого увеличивается площадь функционирующих сосудов, смещается «поворотный» пункт капилляров, увеличивается фильтрационное давление, жидкость устремляется за пределы сосудов. 2. Физико-химические свойства ткани и крови. Под влиянием описанных выше физико-химических и биохимических изменений в воспаленной ткани происходит накопление ионов, набухание коллоидов, увеличение дисперсности белков, т.е. увеличивается КОД (коллоидно-осмотическое давление) в воспаленной ткани, что способствует процессу экссудации. Кроме того, вследствие нарушенной проницаемости сосудов, из кровеносного русла теряются белки и ионы, падает КОД крови – сила, удерживающая жидкость в кровеносном русле. 3. Вышедшая в ткань плазма крови и лимфа затрудняют отток жидкости обратно вследствие сдавления сосудов из вне. 4. Под действием биологически активных веществ (гистамина, серотонина и др.), увеличивается проницаемость сосудистой стенки. В ходе развития воспаления возможны различные пути прохождения вещества через эндотелиальную стенку сосудов: 1. В ходе воспаления гистамин и другие медиаторы вызывают сокращение актомиозиновых нитей эндотелиальных клеток (изменяется форма эндотелиоцитов), вследствие чего увеличиваются межэндотелиальные щели, образуются фенестры и поры, что способствуют выходу экссудата и лейкоцитов. 2. Трансцеллюлярный путь (через эндотелиальную клетку), происходит диффузия и фильтрация. В плазме этих клеток имеются поры, которые под действием гидродинамического давления и БАВ (гистамина, серотонина, брадикинина, простагландинов, факторов проницаемости) могут изменять размеры и исчезать совсем. 3. Везикулярный транспорт — это процесс активного захватывания и проведения через эндотелиальную стенку мельчайших капель плазмы (везикуляция или ультрапиноцитоз). Медиаторы (кинины) вызывают образование в клетке эндотелиальных пузырьков (везикул), которые проводят через клетку вещества. Это энергозависимый процесс, реализуется при участии макроэргических соединений (АТФ). 4. Комбинированный путь. Процесс экссудации Процесс экссудации при воспалении носит защитный характер: - экссудат разбавляет и вымывает токсические вещества; - сам процесс экссудации способствует процессу эмиграции лейкоцитов; - отсюда следует активация протеолитических и амилолитических ферментов в очаге воспаления, расплавление и гибель флогогенных факторов и повреждение клеток зачастую с образованием гноя и выходом его наружу; - сдавливая лимфатические и кровеносные сосуды, экссудат препятствует всасыванию в общий кровоток токсинов и, таким образом, отграничивает очаг воспаления. В зависимости от состава (качества и количества белков, форменных элементов) выделяют серозный, фибринозный, геморрагический, гнойный экссудат. Если каждый из перечисленных экссудатов инфицируется гнилостными микроорганизмами, то он превращается в гнилостный экссудат. Серозный экссудат нередко образуется при воспалении серозных полостей организма (плевральный, брюшной, оболочек мозга, яичек и др.), проницаемость сосудов, эмиграция лейкоцитов увеличиваются. Удельный вес такого экссудата больше, чем 1,018, в нем обнаруживаются белки типа альбуминов и глобулинов, рН снижается только до 7,2, количество лейкоцитов около 3000 в/мкл. Осмотическое давление повышается. Если при воспалении накапливается много слизи, говорят о катаральном воспалении. Фибринозный экссудат образуется при дифтерии, скарлатине, дизентерии, когда проницаемость сосудов повышается более резко и в экссудате накапливается крупномолекулярный белок крови - фибриноген. В очаге воспаления он может свертываться с образованием фибриновых нитей. Геморрагический экссудат возникает при выраженном повреждении сосудистой стенки, что ведет к выходу их сосудов эритроцитов, кровоизлияниям. Геморрагический экссудат наблюдается при чуме, сибирской язве, феномене Шварцмана. Гнойный экссудат встречается при обширных воспалительных процессах, в особенности вызванных стрепто-, стафилококками и другими биологическими флогогенами. Образующиеся при этом хемотаксические вещества способствуют выходу большого количества лейкоцитов и лейкоцитарной инфильтрации. В результате резкого снижения рН многие ПЯЛ гибнут, а при рН 6,7 гибнут все виды лейкоцитов. Из лизосом выделяется большое количество гидролитических ферментов, которые и вызывают лизис лейкоцитов, расщепление белков, жиров и углеводов. Возникают гнойные расплавления и образуется гной. В нем содержатся преимущественно нейтрофильные лейкоциты на различных стадиях разрушения (гнойные тельца). Гнойное воспаление характерно для фурункула, карбункула, флегмоны, абсцесса, эмпиемы. Такое воспаление может быть и на слизистых оболочках. В гное нередко содержатся колонии микроорганизмов, грибки. Другим центральным звеном сосудистых расстройств при воспалении (расстройств микроциркуляции) является процесс эмиграции форменных элементов в очаг воспаления и явление фагоцитоза. Эмиграцией называют процесс выхода форменных элементов крови (в частности, лейкоцитов) из сосудов в очаг воспаления. Она происходит одновременно с началом экссудации, особенно выражена в престатическую стадию сосудистых расстройств и в стадию стаза и предшествует фагоцитозу и пиноцитозу. Эмигрируют в очаг воспаления микрофаги (нейтрофилы, эозинофилы), макрофаги (моноциты, лимфоциты) и иногда эритроциты (в особенности, при аллергическом воспалении). Эмиграция проходит в три стадии (три этапа): 1. Краевое стояние лейкоцитов у внутренней поверхности эндотелия капилляров воспаленной стенки; 2. Прохождение их через эндотелиальную стенку; 3. Собственно продвижение в очаг воспаления (хемотаксис). Краевое стояние заключается в том, что лейкоциты располагаются у внутреннего края эндотелиальной стенки. При нормальном кровообращении они не соприкасаются с пленкой фибрина, покрывающей эндотелиальные клетки изнутри, а вместе с эритроцитами находятся в осевом слое. При повреждении капилляров в воспаленной ткани в их просвете появляется клейкое вещество в виде нежелатинированного фибрина. Нити этого фибрина могут перекидываться через просвет капилляра от одной его стенки к другой. При замедлении кровотока в капиллярах воспаленной ткани лейкоциты соприкасаются с фибринной пленкой и удерживаются ее нитями некоторое время. Причем, первые секунды соприкосновения лейкоцитов с фибринной пленкой позволяют ему некоторое время как бы «перекатываться» по этой поверхности. Следующим фактором удержания лейкоцитов у внутренней поверхности эндотелиальной стенки являются электростатические силы. Поверхностный заряд (дзета-потенциал) лейкоцита и эндотелиальной клетки в норме имеет отрицательный заряд. Однако в ходе воспаления лейкоцит теряет свой отрицательный заряд (разряжается) за счет действия на него ионов Са2+ и других положительных ионов. В механизме прилипания лейкоцитов к эндотелию участвуют также процессы прямой химической связи через ионы Са2+. Эти ионы связываются с карбоксильными группами поверхности лейкоцита и эндотелиальной клетки и образуют «кальциевые мостики». Сами лейкоциты в пристеночном их расположении при контакте с эндотелием выделяют катионные белки и гистоны, которые укрепляют эти контакты наподобие десмосом. Далее лейкоцит проникает через стенку капилляра двумя путями. ПЯЛ уже через 6-8 минут выходят через эндотелиальные щели, выпуская между эндотелиальными клетками свои псевдоподии, а затем все тело. Эндотелиоциты при этом округляются, увеличивая интервалы между собой. Это процесс активный, требует расхода энергии. После выхода лейкоцитов контакты восстанавливаются. Максимум эмиграции ПЯЛ достигается через 6 часов. Мононуклеары (моно- и лимфоциты) используют другой путь эмиграции – трансцеллюлярный (энергозависимая микровезикуляция). Этот процесс более длительный и объясняет, почему мононуклеары, в отличие от ПЯЛ, в очаге воспаления появляются позже (эмиграция их начинается только через 6 часов и достигает максимума через 24 часа). Определенное влияние на последовательность эмиграции оказывает и рН очага воспаления. По данным Менкина, при рН, равной 7,4-7,2, накапливаются ПЯЛ, при рН 7,0-6,8 – преимущественно моно- и лимфоциты. При рН 6,7 в очаге воспаления гибнут все лейкоциты с образованием гноя. После прохождения через слой эндотелия лейкоцит преодолевает базальную мембрану. При прохождении через базальную мембрану ПЯЛ своими ферментами (эластазой, коллагеназой, гиалуронидазой) увеличивают ее проницаемость. Кроме ферментов, определенную роль играют и содержащиеся в нейтрофилах катионные белки. Они временно переводят коллоидное вещество мембран из геля в золь, тем самым увеличивая его проходимость для клетки. Таким образом, проникновение лейкоцитов через стенку капилляра пределяется проницаемостью сосуда и подвижностью лейкоцитов, которая, в свою очередь, зависит от активности ферментов лейкоцита и затраты им энергии. Кроме того, проникновению лейкоцитов способствует ток жидкости при экссудации. Вид эмигрирующих лейкоцитов зависит от стадии воспаления (описанной выше) и характера воспаления. Так, гнойное воспаление сопровождается выходом преимущественно нейтрофильных лейкоцитов, хроническое, специфическое воспаление – преимущественным выходом лимфоцитов и т.д. В эмиграции лейкоцитов в очаг воспаления наблюдается определенная очередность: сначала эмигрируют ПЯЛ, затем моноциты и, наконец, лимфоциты (закон И.И.Мечникова). Важное значение в эмиграции лейкоцитов принадлежит хемотаксису, наличию химической чувствительности, обеспечивающей направленное движение лейкоцита к чужеродному агенту или химическому веществу (положительный хемотаксис) или наоборот, удаление от них (отрицательный хемотаксис по И.И.Мечникову). При воспалении наблюдается положительный хемотаксис (процесс направленного движения лейкоцитов в воспаленную ткань). Вещества, привлекающие лейкоциты, разделяются на две группы: цитотаксины (обладающие свойством привлекать лейкоциты непосредственно) и цитотаксигены (способствующие превращению веществ, не стимулирующих хемотаксис, в цитотаксины). Разные виды лейкоцитов привлекаются различными цитотаксинами. Для нейтрофилов цитотаксинами являются, например, компоненты комплемента (СЗа, С5а и др.), калликреин, денатурированные белки, бактериальные токсины, казеин, пептон и др. Цитотаксигенами для нейтрофилов являются трипсин, плазмин, коллагеназа, комплексы антиген-антитело, крахмал, гликоген, бактериальные токсины и др. Для эозинофилов цитотаксинами являются эозинофильный фактор хемотаксиса при анафилаксии, продукты повреждения лимфоцитов - лимфокины и др. Цитотаксигенами для эозинофилов являются различные иммунные комплексы, продукты агрегации иммуноглобулинов JqG и JgM. Для макрофагов цитотаксинами являются С5а-комплемент, белковые фракции фильтратов культур бактерий и др. Цитотаксигенами для макрофагов являются лизосомальные фракции лейкоцитов, протеиназы макрофагов, липополисахариды микробов кишечной группы, микобактерий и др. Торможение хемотаксиса вызывают гидрокортизон, простагландины Е1 и Е2, цАМФ, колхицин, пуромицин, актиномицин Д, алкоголь. В механизме движения лейкоцитов имеют значение некоторые физико-химические факторы. Например, понижение поверхностного натяжения и выпячивание цитоплазмы в сторону раздражителя. Кроме того, положительно заряженные макромолекулы ткани могут уменьшать отрицательный заряд лейкоцита и вызывать электростатическую неустойчивость их мембран (катафорез). Наконец, влияние веществ на саму цитоплазму лейкоцита приводит к изменению ее коллоидного состояния (перехода из геля в золь), т.к. изменяется энергетика лейкоцита и масса становится более жидкой (активная подвижность самого лейкоцита с потреблением энергии фосфатных связей макроэргов). Сущность хемотаксиса сводится к активации микротабулярного аппарата цитоплазмы лейкоцита, а также сокращению актомиозиновых нитей псевдоподии. Этот процесс требует участия Са2+ и Мg2+ (ионы Са2+ потенциируют действие ионов Mg2+) и сопровождается увеличением поглощения О2 лейкоцитами. Эмигрировавшие в очаг воспаления лейкоциты имеют большое значение. Они участвуют в выработке антител, доставляют в очаг воспаления энергетические вещества (в частности, гликоген), богаты ферментами, способствующими эмиграции и пролиферации ткани (т.н. трефонами), отграничивают здоровые ткани (т.н. «лейкоцитарный вал»), являются источниками пирогенов и, основная их роль, участвуют в процессе фагоцитоза. Фагоцитоз Фагоцитоз – эволюционно выработанная защитно-приспособительная реакция организма, которая состоит в распознавании, активном захвате (поглощении) и переваривании микроорганизмов, разрушенных клеток и инородных частиц специализированными клетками-фагоцитами. К ним относятся ПЯЛ (в основном нейтрофилы), клетки системы фагоцитирующих мононуклеаров (моноциты, тканевые макрофаги), а также клетки Купфера в печени, мезангиальные клетки почек, глиальные клетки в ЦНС, альвеолярные фагоциты в легких, свободные и частично фиксированные макрофаги в лимфоузлах и селезенке, перитонеальные и плевральные макрофаги и др. Различают 4 стадии фагоцитоза 1) стадия - приближение фагоцита к инородному агенту. Основу этого движения составляют описанные выше явления хемотаксиса лейкоцитов; 2) стадия - прилипания фагоцита к объекту. Она объясняется способностью фагоцитов образовывать такие цитоплазматические выпячивания, которые выбрасываются по направлению к объекту фагоцитоза и с помощью которых осуществляется прилипание. Определенное значение при этом имеет поверхностный заряд лейкоцитов. Имея отрицательный заряд, лейкоциты лучше прилипают к объекту с положительным зарядом. Прилипанию предшествует опсонизация, т.е. покрытие иммуноглобулинами М и J и фрагментами СЗ, С5, С6, С7 бактерий и поврежденных клеток, вследствие этого они прилипают к фагоциту. Процесс прилипания сопровождается усилением метаболической активности лейкоцитов, (нарастает аэробный и анаэробный гликолиз) и повышением способности к поглощению в 2-3 раза; 3) стадия - поглощение объекта лейкоцитами (обволакивание) может происходить двумя способами. Контактирующий с объектом участок цитоплазмы втягивается внутрь клетки, а вместе с ним втягивается и объект. Второй способ заключается в том, что фагоцит присасывается к объекту своими длинными и тонкими псевдоподиями, а потом всем телом подтягивается в сторону объекта и обволакивает его. И в том, и в другом случае инородная частица окружена цитоплазматической мембраной и вовлечена внутрь клетки. В итоге образуется свободный мешочек с инородным телом (фагосома). Образованию фагосомы предшествует повышение метаболизма с активацией НАДН-зависимой оксидазы, что обеспечивает синтез перекиси водорода. В результате дегрануляции лейкоцитов выделяются лизосомальные ферменты и бактерицидные белки. Перекись водорода распадается под влиянием оксидаз с образованием активной молекулы кислорода, которая взаимодействует с компонентами мембраны клетки, разрушая ее путем перекисного окисления; 4) стадия - внутриклеточного расщепления и переваривания фагоцитированных микробов и остатков поврежденных клеток. Лизосома приближается к фагосоме, их мембраны сливаются, образуя единую вакуоль, в которой находится поглощенная частица и лизосомальные ферменты (фаголизосома). В фаголизосомах устанавливается оптимальная для действия ферментов реакция (рН около 5) и начинается переваривание поглощенного объекта. В лизосомах содержатся ферменты (протеазы, карбоангидразы, липазы и пр.), обеспечивающие гидролиз веществ, содержащихся в клетках, в том числе и микробных, их бактерицидное действие, обусловлено, в основном, наличием миелопероксидазы. Наряду с перевариванием инородных объектов и поврежденных клеток под влиянием гидролитических ферментов, выделившихся в фагосому, гибнут и сами фагоциты, являясь источником образования гноя, а продукты разрушения стимулируют процессы пролиферации в очаге воспаления. Особенно отчетливо значение фагоцитоза в патогенезе воспаления выявляется при его нарушении, когда даже слабовирулентные микроорганизмы могут вызвать сепсис. Фагоцитоз в этом случае носит характер незавершенного, и микробы, поступая с лейкоцитами из очага воспаления в различные органы, вызывают явление сепсис. При наследственной энзимопатии, обусловленной рецессивным геном, сцепленным с Х-хромосомой, снижается активность НАДН-зависимой оксидазы и нарушается образование активной молекулы кислорода. Мембрана бактериальной клетки не повреждается, фагоцитоз остается незавершенным. Это ведет к хроническому воспалению, особенно в легких, к деструкции ткани и гибели организма. Нарушения фагоцитоза выявленные при циррозе печени, гломерулонефрите, обусловлены активацией ингибиторов хемотаксиса, снижением эмиграции лейкоцитов. Торможение фагоцитоза обнаруживается при сахарном диабете, гиперкортицизме, патологии щитовидной железы. Макрофаги осуществляют фагоцитоз аналогично нейтрофилам и обладают способностью секретировать в очаге воспаления лизосомальные ферменты, плазмин, коллагеназу, эластазу, лизоцим, белки комплемента, интерферон и др. Они выполняют важнейшую роль в очищении очага воспаления от погибших клеток и разрушении веществ антигенной природы, а также в формировании иммунного ответа. Пролиферация Пролиферация (от лат. proliferatio – размножение) заключается в размножении и созревании в очаге воспаления в основном соединительнотканных клеток, образовании рубца: фибробласты образуют проколлаген и коллагеназу (расщепляет коллаген). Нарушение взаимодействия между синтезом проколлагена и коллагеназой может привести к развитию склеропатий. На процесс пролиферации влияют лимфокины, монокины, простагландины (Е), кейлоны и антикейлоны, глюкортикоиды, циклические нуклеотиды. Влияние очага воспаления на организм в целом (общая реакция при воспалении) Прежде всего, меняется обмен веществ (в особенности углеводный и белковый) во всем организме. Усилены процессы гликолиза, вследствие чего образуется много промежуточных продуктов (молочной, пировиноградной кислоты и проч.), что приводит к развитию ацидоза. Вследствие распада белка наблюдается отрицательный азотистый баланс. В периферической крови развивается лейкоцитоз (при большинстве воспалительных процессов), реже лейкопения (при воспалении вирусного происхождения). Лейкоцитоз обусловлен активацией лейкопоэза и перераспределением лейкоцитов в кровеносном русле. При воспалении изменяются белковые фракции крови. Наблюдается гиперглобулинемия, гиперфибриногенемия, гипоальбуминемия, что ведет к увеличению СОЭ. При хроническом воспалении нарушается белковосинтетическая функция печени (гипопротеинемия). При остром воспалении в крови накапливаются синтезированные печенью "белки острой фазы" (БОФ) воспаления - С-рективный белок, церулоплазмин, гаптоглобин, компоненты комплемента и др. Увеличение скорости оседания эритроцитов (СОЭ) при воспалении наблюдается вследствие потери отрицательного заряда эритроцитов, повышения вязкости крови, агломерации эритроцитов, изменения белкового спектра крови и т.д. Лихорадка при воспалении развивается под влиянием на терморегулирующий центр пирогенных факторов: интерлейкина-1, липополисахаридов, катионных белков. Изменения ферментного состава крови проявляются в увеличении активности трансаминаз (например, АЛТ при гепатите, АСТ при миокардите), гиалуронидазы, тромбокиназы и т.д. Нарушения содержания гормонов состоят в увеличении концентрации катехоламинов, кортикостероидов. Иммунобиологический статус организма характеризуется активизацией фагоцитоза, нарастанием титра антител, появлением сенсибилизированных лимфоцитов в крови, развитием местных и общих аллергических реакций. Очаг воспаления может быть источником патологических рефлексов (например, аритмии и коронароспазма при воспалении органов брюшной полости, в частности, аппендиците, холецистите). Нарушение обмена веществ, преобладание альтерации, нарушение кровотока при длительном хроническом воспалении приводит к интоксикации организма («тканевая чахотка») и истощению организма. Состояние реактивности организма оказывает существенное влияние на течение и исход воспаления: - нарушение иммунитета; - эндокринные расстройства (сахарный диабет, патология надпочечников, гипофиза, щитовидной железы); - нарушения нервной трофики. Общие принципы патогенетической терапии воспаления сводятся к использованию противовоспалительных средств, которые оказывают влияние на одно или несколько звеньев патогенеза воспаления: нестероидные противовоспалительные препараты (НПВП), глюкокортикоиды, иммуносупрессоры (см. схему выше). В зависимости от характера воспаления используется специфическая и неспецифичная терапия. Первая направлена на уничтожение биологического возбудителя (антибиотики, лечебные сыворотки и проч.), которые обладают бактерицидным действием. Неспецифическое лечение направлено на повышение резистентности, восстановление нарушений микроциркуляции, поврежденной ткани, дезинтоксикацию организма. Биологическое значение воспаления сводится к тому, что этот процесс включает комплекс как собственно патологических, так и защитноприспособительных явлений. Повреждающее действие воспалительного процесса состоит в повреждении клеток и тканей того органа, где развивается воспаление. Это приводит к изменению функций органа или тканей. Например, воспаление печени (гепатит) вызывает нарушение многочисленных функций этого органа, что влечет за собой различные расстройства обмена веществ, секреции желчи и др. В то же время воспалительная реакция имеет и защитное, приспособительное значение для организма. Так, воспалительный отек (скопление экссудата в воспаленной ткани) – фактор, способный связывать, фиксировать бактериальные токсины в очаге воспаления и не допускать их всасывания и распространения в организме. В особенности большое защитное значение имеют фагоцитарная и пролиферативная функции соединительнотканных клеток - гистиоцитов, макрофагов. Грануляционная ткань, которую они образуют, представляет мощный защитный барьер против инфекции. Представление о воспалении, как о патологическом процессе, в котором "защитное" и "собственно патологическое" находятся в единстве и борьбе, соответствует действительности. Оно же дает врачу и руководство к действию. Гипоксия Под кислородным голоданием понимают такое состояние организма, при котором его потребность в кислороде в данный момент не покрывается его обеспечением либо усвоением (утилизацией). По сравнению с другими видами голодания этот вид наиболее тяжелый для организма. Если в условиях полного прекращения поступления в организм пищи (при свободном доступе к воде) организм человека способен прожить 50-70 дней за счет собственных резервов (углеводы, жиры), то прекращение поступления кислорода приводит к смерти через 5-7 минут. Это время определено незначительными запасами кислорода в организме 2-2,5 л (4 г) . В состоянии покоя человек использует 250 смЗ за 1 минуту, при тяжелой физической работе это количество возрастает до 3-4 л за 1 минуту. Патологический процесс, наступающее в организме при неадекватном снабжении тканей и органов кислородом или при нарушении утилизации в них кислорода, называется гипоксией или кислородным голоданием. Гипоксия встречается весьма часто и служит патологической основой или важным компонентом множества заболеваний. Как верно отмечал академик Н.Н.Сиротинин: «Вся жизнь человека от рождения до смерти сопровождается частыми явлениями кислородного голодания. Рождение осуществляется в условиях сильной гипоксии; различные заболевания на протяжении жизни как правило сопровождаются недостаточностью кислорода; сама по себе старость, особенно при атеросклерозе и гипертонии, характеризуется гипоксией. Наконец, при умирании всегда наблюдается аноксия» (1958). Кислородное голодание проявляется в двух явлениях(терминах): 1) гипоксемия (аноксемия) - недостаточное содержание кислорода в крови. Происходит от hypo-пониженный, охуgenum-кислород, hеima-кровь; 2) гипоксия (аноксия) – недостаточное содержание кислорода в тканях. Между этими понятиями существует взаимосвязь. Так, гипоксемия неизбежно приводит к недостаточному снабжению тканей кислородом (гипоксии). В то же время гипоксия не всегда связана с гипоксемией. Так, при нормальном содержании кислорода в крови утилизация кислорода тканями может затрудняться в результате действия различных ингибиторов ферментов биологического окисления, нарушения синтеза ферментов и т.д. Виды гипоксии: Первая классификация гипоксии была предложена Баркрофтом (1920, 1925г). Он предложил выделить в зависимости от уровня нарушении функции переноса кислорода: 1)аноксигенную форму (недостаток кислорода в воздухе и/или нарушение газообмена в легких); 2)анемическую (нарушение способности гемоглобина связывать и транспортировать кислород); 3) застойную форму (нарушение циркуляции крови). В 1922 году Питерс и Ван Слайк добавили к этой классификации четвертую форму гипоксии, назвав ее гистотоксической, т. к. считали ее результатом токсического разъединения клеточного метаболизма через блокаду цепи дыхательных ферментов, в первую очередь цитохромоксидазы. Преимуществом этой классификации БаркрофтаВан Слайка является ее простота, универсальность, четкая практическая и патогенетическая направленность. Она помогает клиницистам понять патогенез гипоксии и проводить патогенетическое лечение. Эта классификация принята во всем мире, т. к. удовлетворяет всех. В 1948г. на конференции по проблеме кислородного голодания организма в Киеве по предложению Н.Н. Сиротина была принята патогенетическая классификация Баркрофта-Ван Слайка. Согласно этой классификации, получившей название Киевской, выделяют следующие формы гипоксии: 1. Гипоксическую (от понижения парциального давления кислорода во вдыхаемом воздухе); 2. Дыхательную: а) в результате затруднения проникновения кислорода в кровь через дыхательные пути; б) вследствие нарушения диффузии и перфузии; 3. Гемическую: а) от недостатка гемоглобина (анемическая); б) от инактивации гемоглобина; 4. Циркуляторную: а) застойная форма; б) ишемическая форма; 5. Тканевую (гистотоксическую). Эта классификация по этиологии и патогенезу шире и точнее, чем классификация Баркрофта. В 1958г. И.Р. Петров предложил еще одну классификацию кислородного голодания: 1. Гипоксия от недостаточности парциального давления кислорода во вдыхаемом воздухе; 2. Гипоксия при патологических процессах: а) дыхательная; б) сердечно-сосудистая; в) кровяная; г) тканевая; д) смешанная. К факторам, определяющим реакцию организма на гипоксию, относят скорость ее развития, стадию и продолжительность. По скорости развития различают молниеносную, острую и хроническую формы гипоксии. Как и любой патологический процесс острая и хроническая формы проходят следующие стадии развития: латентную, компенсированную, субкомпенсированную, декомпенсированную и терминальную. Этиология и патогенез отдельных видов гипоксии I. Гипоксическая гипоксия. В основе ее лежит уменьшение насыщения артериальной крови кислородом (гипоксемия), возникает при снижении парциального давления кислорода в воздухе. При этом состав крови и ее количество не изменяются. Причины, которые ведут к развитию гипоксической гипоксии: - подъем в горы, полеты на летательных аппаратах; - увеличение парциального давления других газов, которые вытесняют кислород из окружающего воздуха, например, при работе в шахтах (метан), в колодцах (углекислый газ), при наркозе закисью азота (азот); II. Дыхательная (возникает при нарушении вентиляции легких и диффузии газов через альвеоло-капиллярную мембрану): - нарушение вентиляции легких возникает при деформации грудной клетки, при эмфиземе, бронхоспазме, параличе дыхательных мышц, столбняке, отравлением стрихнином, пневмотораксе, плеврите, депрессии ЦНС; -нарушение диффузии и перфузиикислорода в кровь возникает при уплотнении стенки альвеолы или капилляра вследствие пневмоторакса, склеротического уплотнения сосудистой стенки, пневмонии, фиброза, отека легких. Характерной чертой этой формы кислородного голодания является развитие недостаточности дыхательной функции легких, что сопровождается резким уменьшением объема воздуха, который принимает участие в вентиляции легких. Вследствие этого насыщение кислородом гемоглобина крови в легких резко уменьшается, что может привести к недостаточному снабжению кислородом. Эта форма гипоксии возникает также при наличии сосудистых шунтов, при врожденных пороках сердца (смешивание артериальной и венозной крови при не заращении отверстий между желудочками или предсердиями). При такой форме гипоксии содержание кислорода в крови снижается, а углекислоты увеличивается, что приводит к гипервентиляции, а вследствие этого к гипоксии. А поскольку углекислота усиливает диссоциацию оксигемоглобина, значит затруднена отдача кислорода тканям. Нарушается кислотно-основное равновесие, в крови накапливаются недоокисленные продукты. II. Гемическая гипоксия. В основе ее лежит уменьшение кислородной емкости организма, крови, то есть уменьшение количества функционирующего гемоглобина. В зависимости от причины, которая ее вызывает, гемическая гипоксия развивается либо при снижении содержания гемоглобина в крови (анемическая форма), либо при его инактивации, что ведет к уменьшению сродства гемоглобину к кислороду (токсическая форма). Анемическая форма характеризуется уменьшением циркулирующего гемоглобина в результате кровопотери, гемолиза эритроцитов или угнетения активности костного мозга, то есть она сопровождает анемии самого разного происхождения. При этом кислородная емкость крови снижается. При токсической форме происходит уменьшение циркулирующего гемоглобина, который способен превращаться в оксигемоглобин, в результате частичного перехода его в карбоксигемоглобин, метгемоглобин, сульфгемоглобин и т.п. Например, образование карбоксигемоглобина. Угарный газ (СО) легко диффундирует через альвеолярную стенку потому, что его парциальное давление в крови ровняется 0. Угарный газ в 350 раз быстрее связывается с гемоглобином по сравнению с кислородом. Гемоглобин, связанный с СО, не может уже служить переносчиком кислорода. Вследствие действия метгемоглобинообразователей (сильных окислителей) двухвалентное железо переходит в трехвалентную форму и образуется прочное не диссоциирующее соединение – метгемоглобин (нитриты, нитраты, фенацитин, анилин и др.) – кровь при этом приобретает шоколадный цвет. При отравлении сероводородом блокируется гемоглобин с образованием сульфгемоглобина – необратимого соединения – следствие чего нарушается передача кислорода тканям. Встречается при работах в канализационных люках, трюмах кораблей и требует заменного переливания крови. III. Циркуляторная гипоксия Возникает при замедлении кровотока. При этом виде гипоксии кровь нормально насыщается кислородом в альвеолах, но кислород в недостаточном количестве поступает в ткани вследствие замедления скорости кровотока, особенно в системе микроциркуляции. За единицу времени меньшее количество эритроцитов с гемоглобином проходит через капилляры и отдает кислород тканям. По причинам развития различают местную и общую формы циркуляторной гипоксии. Местная форма наблюдается в условиях местных расстройств кровообращения (венозная гиперемия, стаз, ишемия). Общая форма развивается при условиях сердечной (застой крови в венах большого или малого круга кровообращения) или сосудистой (травматический шок) недостаточности. IV. Тканевая гипоксия. Возникает вследствие нарушения способности тканей использовать кислород. В отличие от всех других форм гипоксии в этом случае транспорт кислорода не нарушен, содержание его и парциальное давление в артериальной крови нормальные, но резко снижена способность тканей усваивать кислород в результате нарушений, которые влияют на химические реакции тканевого дыхания. Клетки не способны воспринимать кислород из крови или утилизировать его в клетке. Тканевая гипоксия обусловлена: а) полной или частичной блокадой дыхательных ферментов б) нарушением синтеза этих ферментов Способность угнетать функцию дыхательных ферментов свойственна цианидам, сероводороду, монойодацетату, некоторым наркотическим веществам (эфир, уретан, люминал, хлорэтан), алкоголю. В условиях переохлаждения или перегревания также происходит угнетение функции дыхательных ферментов. Снижение синтеза дыхательных ферментов наблюдается при гипо- и авитаминозах: витамин В1 (тиамин) является коферментом декарбоксилазы, пировиноградной кислоты; В2 (рибофлавин) входит в состав флавиновых ферментов; витамин РР(никотиновая кислота) входит в состав дегидрогеназ. Явления тканевой гипоксии наблюдается при патологии центральной нервной системы, эндокринных желез, что ведет к нарушению трофической функции. Тканевая гипоксия может сопровождаться и нарушения водно-электролитного баланса - значительные отеки затрудняют диффузию кислорода к тканям. Как известно, конечным звеном транспорта кислорода к клеточным ферментам является участок кровь-клетка-митохондрия, который богат биологическими мембранами с высоким содержанием в них липидов, которые имеют большое средство к кислороду. Тут и в нормальных условиях идут процессы перекисного окисления липидов, интенсивность которых регулируется системой антиоксидантов. Дефицит природных антиоксидантов (токоферолов, рутина, убихинона, аскорбиновой кислоты, глютатиона и др.) приводит к интенсификации процессов свободнорадикального окисления и развитию тканевой гипоксии. В условиях недостаточности организма развивается кислородное голодание с характерными патологическими нарушениями. Наиболее чувствительна к недостатку кислорода нервная система, особенно ее филогенетически молодые образования - кора головного мозга, мозжечок. Этим объясняется то, что первыми симптомами гипоксии являются нарушения нервной деятельности (сонливость, головная боль, нарушение координации движений, резкое изменение почерка (писчая проба)). Субъективные ощущения начинаются с эйфории, которая сменяется депрессией. Характерна утрата самокритики и способность реально оценивать ситуацию, снижение памяти, потеря сознания, повышение проницаемости гемато-энцефалического барьера. Для кислородного голодания также характерно нарушение функций вегетативной нервной системы, о чем свидетельствует тахикардия, одышка, повышение артериального давления. Эти изменения связаны с нарушением регуляторной деятельности ЦНС. Учащение пульса (тахикардия) - ранний симптом гипоксии и наиболее тонкий биологический показатель изменений кровообращения. Наряду с резким учащением пульса появляются аритмия и изменения на ЭКГ. Артериальное давление вначале повышается, а затем снижается (результат угнетения функции вазомоторного центра) . Частое и глубокое дыхание (полипное) приводит к снижению парциального давления углекислоты и гипокапнии, которая утяжеляет течение гипоксии. В условиях гипокапнии снижается возбудимость сосудодвигательного и дыхательного центров, затрудняется диссоциация оксигемоглобина, развивается алкалоз. Торможение дыхательного центра приводит к появлению дыхания Чейна-Стокса. Кислородное голодание приводит к потере аппетита, диспептическим явлениям, угнетению функций всех желез пищеварительного тракта, нарушению моторики и секреции, развитию поносов. Нарушается работа почек: диурез снижается (при сильном воздействии), либо повышается (при невыраженной гипоксии). Гипоксия приводит к изменению функций эндокринных желез, в первую очередь гипофиза, надпочечников, щитовидной железы (активация). Общая реакция организма на кислородное голодание зависит от возраста, пола, тренированности, общей резистентности, уровня развития нервной системы, уровня обменных процессов и других факторов. Компенсация Гипоксия вызывает сложную перестройку функционирования различных систем организма, направленную на борьбу за поддержание парциального давления кислорода и общего количества кислорода в крови от слишком резкого его снижения. Выделяют дыхательные, гемодинамические, гемические и тканевые компенсаторноадаптационные реакции: 1. Дыхательные: Увеличение объема легочной вентиляции. За счет возбуждения дыхательного центра импульсами с хеморецепторов синокаротидной и аортальной зон в ответ на понижение р02 в альвеолярном воздухе и/или в крови и накопления в крови СО2 развивается гипервентиляция, благодаря которой минутный дыхательный объем может возрастать до 80-120 л/мин (в состоянии покоя этот показатель равен 20-25 л/мин). 2. Гемодинамические: а) перераспределение крови за счет централизации кровообращения (преимущественное кровоснабжение головного мозга, сердца, легких); б) увеличение минутного объема крови (тахикардия, увеличение ударного объема); в) повышение тонуса периферических сосудов. Компенсаторное повышение сосудистого тонуса и компенсаторная тахикардия возникают рефлекторно в ответ на раздражение рецепторов сосудов. 3. Гемические: а) увеличение количества эритроцитов крови за счет мобилизации их из депо (перераспределительный эритроцитоз, относительный); б) абсолютный эритроцитоз за счет усиления эритропоэза в костном мозге вследствие выработки почками в условиях гипоксии эритропоэтина развивается при относительно длительном течении гипоксии; в) ускорение диссоциации оксигемоглобина (развивается при накоплении С02 и Н+); г) увеличение сродства кислорода к гемоглобину. 4 . Тканевые: а) активация тканевых дыхательных ферментов; увеличение их количества; б) переход на анаэробное окисление; в) снижение основного обмена; г) увеличение массы митохондрий; д) повышение чувствительности тканей к действию ацетилхолина, которому присуще кислородосберегающее действие. Перечисленные компенсаторноприспособительные механизмы носят аварийный характер, они эффективны в условиях острой гипоксии. Хроническая гипоксия требует увеличения интенсивности функционирования структур, ответственных за поддержание клеточного гомеостаза. Со временем в этих структурах осуществляются процессы гипертрофии (это стадия стойкой адаптации по Ф.З.Меерсону) - увеличивается масса дыхательных мышц, легочных альвеол, миокарда, нейронов дыхательного центра, наблюдается увеличение количества функционирующих капилляров, увеличивается содержание миоглобина, количество и масса митохондрий. При гипоксии включаются факторы, индуцируемые гипоксией, называемые HIFs (сокр. от англ. Hypoxia-inducible factors) — группа транскрипционных факторов, которая реагируют на уменьшение количества кислорода в клетках или на гипоксию. Каскад сигнализации HIF опосредует влияние гипоксии на клетку. Гипоксия часто препятствует дифференцировке клеток. Однако гипоксия способствует образованию кровеносных сосудов и имеет важное значение для формирования сосудистой системы у эмбрионов и злокачественных опухолей. Гипоксия в ранах также способствует миграции кератиноцитов и восстановлению эпителия. Факторы, индуцируемые гипоксией, способствуют экспрессии генов, отвечающих за синтез ферментов дыхательной цепи, неоваскуляризации, факторов роста сосудов, фибробластов и других ростовых факторов. Т.о. гипоксия – это сложный типовой патологический процесс, в котором, по сути, задействованы все органы и системы организма и, в первую очередь, системы крови, кровообращения и дыхания. Кислород, необходимый организму для функционирования, является одновременно и токсическим веществом, если из него образуются так называемые активные формы. К активным формам кислорода относят: -ОН· - гидроксильный радикал; - О· 2- супероксидный анион; - Н2О2 - пероксид водорода. Реакции перекисного окисления липидов (ПОЛ) являются свободнорадикальными и постоянно происходят в организме. Свободнорадикальное окисление нарушает структуру многих молекул. В белках окисляются некоторые аминокислоты. В результате разрушается структура белков, между ними образуются ковалентные «сшивки», всё это активирует протеолитические ферменты в клетке, гидролизирующие поврежденные белки. ПОЛ - цепные реакции и защита от них ПОЛ - цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления. Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон за счёт образования гидропероксидов жирных кислот в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация перекисного окисления характерна для многих заболеваний: дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга; атеросклероза, развития опухолей. Перекисное окисление активируется также в тканях, подвергшихся сначала ишемии, а затем реоксигенации, что происходит, например, при спазме коронарных артерий и последующем их расширении. Такая же ситуация возникает при образовании тромба в сосуде, питающем миокард. Формирование тромба приводит к окклюзии просвета сосуда и развитию ишемии в соответствующем участке миокарда (гипоксия ткани). Если принять быстрые лечебные меры по разрушению тромба, то в ткани восстанавливается снабжение кислородом (реоксигенация). Показано, что в момент реоксигенации резко возрастает образование активных форм кислорода, которые могут повреждать клетку. Таким образом, даже несмотря на быстрое восстановление кровообращения, в соответствующем участке миокарда происходит повреждение клеток за счёт активации перекисного окисления. Изменение структуры тканей в результате ПОЛ можно наблюдать на коже: с возрастом увеличивается количество пигментных пятен на коже, особенно на дорсальной поверхности ладоней. Этот пигмент называют липофусцин, представляющий собой смесь липидов и белков, связанных между собой поперечными ковалентными связями и денатурированными в результате взаимодействия с химически активными группами продуктов ПОЛ. Этот пигмент фагоцитируется, но не гидролизуется ферментами лизосом, и поэтому накапливается в клетках, нарушая их функции. ПОЛ происходит не только в живых организмах, но и в продуктах питания, особенно при неправильном приготовлении и хранении пищи. Прогоркание жиров, образование более тёмного слоя на поверхности сливочного масла, появление специфического запаха у молочных продуктов - всё это признаки ПОЛ. В продукты питания, содержащие ненасыщенные липиды, обычно добавляют антиоксиданты вещества, иигибирующие ПОЛ и сохраняющие структуру компонентов пищи. Системы защиты клеток от активных форм кислорода: Ферменты антиоксидантного действия К ферментам, защищающим клетки от действия активных форм кислорода, относят супероксиддисмутазу, каталазу и глутатионпероксидазу; Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксисом особенно велико. Супероксиддисмутаза (СОД) превращает супероксидные анионы в пероксид водорода. Изоферменты СОД находятся и в цитозоле и в митохондриях и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода при утечке электронов из дыхательной цепи. СОД - индуцируемый фермент, т.е. синтез его увеличивается, если в клетках активируется перекисное окисление. Пероксид водорода, который может инициировать образование самой активной формы «ОН», разрушается ферментом каталазой. Каталаза находится в основном в пероксисомах, где образуется наибольшее количество пероксида водорода, а также в лейкоцитах, где она защищает клетки от последствий «респираторного взрыва» Глутатионпероксидаза - важнейший фермент, обеспечивающий инактивацию активных форм кислорода, так как он разрушает и пероксид водорода и гидропероксиды липидов. Он катализирует восстановление пероксидов с помощью трипептида глутатиона (γ-глутамилцистеинилглицин). Окисленный глутатион восстанавливается глутатионредуктазой. Глутатионпероксидаза, которая восстанавливает гидропероксиды липидов в составе мембран, в качестве кофермента использует селен (необходимый микроэлемент пищи). При его недостатке активность антиоксидантной защиты снижается. Витамины, обладающие антиоксидантным действием Витамин Е (α-токоферол) - наиболее распространённый антиоксидант в природе является липофильной молекулой, способной инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и таким образом предотвращать развитие цепи перекисного окисления. Различают 8 типов токоферолов, но α токоферол наиболее активен. Витамин Е отдаёт атом водорода свободному радикалу пероксида липида, восстанавливая его до гидропероксида, таким образом останавливает развитие ПОЛ. Свободный радикал витамина Е, образовавшийся в результате реакции, стабилен и не способен участвовать в развитии цепи. Наоборот, радикал витамина Е непосредственно взаимодействует с радикалами липидных перекисей, восстанавливая их, сам превращается в стабильную окисленную форму - токоферолхинон. Витамин С (аскорбиновая кислота) также является антиоксидантом и участвует с помощью двух различных механизмов в иигибировании ПОЛ. Во-первых, витамин С восстанавливает окисленную форму витамина Е и, таким образом, поддерживает необходимую концентрацию этого антиоксиданта непосредственно в мембранах клеток. Во-вторых, витамин С, будучи водорастворимым витамином и сильным восстановителем, взаимодействует с водорастворимыми активными формами кислорода - инактивирует их. β-Каротин, предшественник витамина А, также обладает антиоксидантным действием и ингибирует ПОЛ.