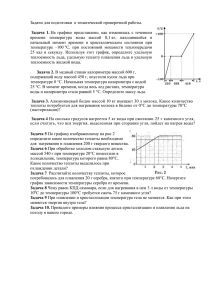
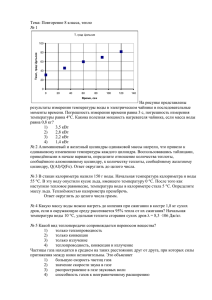
Тема №3. Найти постоянства калориметра Цель работы: определение теплоты плавления солей калориметрическим способом. Оборудование и реагенты: калориметр, мерные цилиндры, часы, KCl и одна из следующих хорошо растворимых солей – NH4Cl, KBr, NaNO3, K2SO4 Строение калориметра для измерения теплового эффекта различных физико-химических процессов используются специальные приборыкалориметры. Самый простой устройство калориметра показано на рисунке 1. Оно состоит из следующих частей; химический стакан 4, в котором происходит растворение солей, помещается в толстостенный стакан 5. При этом необходимо добиться того, чтобы тепло или поглощенное тепло, образующееся в процессе плавления, не рассеивалось во внешнюю среду и не передавалось в систему из среды. Стакан (5) закрывается крышкой с двумя отверстиями: одно из отверстий предназначено для термометра (1), а другое-для пробирки с надутым дном, в которую помещается образец соли, который необходимо растворить. Дно пробирки надувают и разжижают, чтобы ее было легко сломать. Его разбивают металлической или стеклянной палочкой. Это позволяет соли быстро переходить в раствор и растворяться. Калориметр устанавливается на магнитную мешалку (8). Скорость вращения магнита (7) зависит от вязкости жидкости в стакане (4). Оптимизация скорости магнита осуществляется через регулятор (9), установленный на приборе. Определение постоянной калориметра. Чтобы определить тепловой эффект процесса, происходящего в калориметре, необходимо знать постоянную калориметра (K), то есть количество тепла, необходимое для изменения температуры всей части калориметра на 1°C. Значение константы калориметра находят с помощью раствора хлорида калия, величина теплоты плавления, которого известна. Значение постоянной калориметра рассчитывается по следующему уравнению: 𝑞(𝐾𝐶𝑙) 𝐾= (1) ∆𝑡 где Q (KCl) - удельная теплота плавления хлорида калия. Рассчитывается по формуле: 𝑚𝑄(𝐾𝐶𝑙) 𝑞(𝐾𝐶𝑙) = (2) 𝑀(𝐾𝐶𝑙) m – масса соли, g; Q(KCl) – молярная теплота плавления соли (молярная теплота плавления хлорида калия равна 18,828 кДж/моль); M(KCl) молекулярная масса хлорида калия ; ∆t-изменение температуры раствора в процессе плавления соли (ее величина определяется графически). Для графического определения значения ∆t на оси абсцисс помещают значения времени, а на оси ординат – значения температуры. (Рис. 2). Соединяя точки на графике с помощью прямых, получаются две отклоненные прямые. Полученную прямую AB продолжают вправо, а линию CDвлево до пересечения с перпендикулярной линией, проведенной к оси абсцисс на 10-й минуте. Интервал MN, пересекаемый линиями AB и CD перпендикуляра, соответствует изменению температуры ∆t. Все работы по определению теплоты плавления соли выполняются так же, как и при определении постоянной калориметра. Соль, температура плавления которой должна быть определена, берут по указанию воспитателя и взвешивают в стеклянной пробирке, дно которой надувают, очищают, промывают и просушивают. При плавлении соли изменение температуры с изменением времени записывают в таблицу, а значение ∆t определяют с помощью графика. Теплота плавления исследуемой соли рассчитывается по формуле: КМ(соль)∙∆𝑡 𝑄(соль) = (3) 𝑚