Вопрос 18. Сущность процесса электролиза и его применение.
advertisement

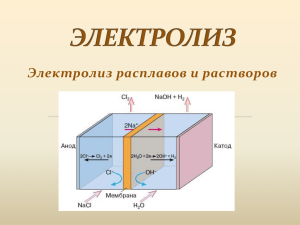
Вопрос 18. Сущность процесса электролиза и его применение. Электролизом называется совокупность окислительно – восстановительных реакций (ОВР), протекающих на электродах при пропускании постоянного электрического тока через раствор или расплав электролита. Для проведения электролиза применяют устройство – электролизер (рис.1), который состоит из электролитической ванны, заполненной раствором или расплавом электролита, двух электродов и источника постоянного электрического тока. Рис.1. Прибор для проведения электролиза. Электрод, на котором идет реакция восстановления (катод), подключен к отрицательному полюсу внешнего источника тока. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока. Электроды изготовлены из токопроводящего материала. Они делятся на инертные (нерастворимые), материал которых (графит, платина, золото) не участвует в ОВР, и растворимые, участвующие в процессе. Последние обычно изготовлены из металла (свинца, никеля, меди), окисляющегося при электролизе. Рассмотрим электродные реакции, протекающие при электролизе, на примерах. Электролиз расплава хлорида натрия на инертных электродах При плавлении происходит диссоциация соли на ионы: NaCl = Na+ + Cl- . При подключении погруженных в расплав соли графитовых электродов к полюсам внешнего источника тока в нем начнется направленное движение ионов, сопровождающееся следующими химическими реакциями: o на катоде (отрицательном электроде) восстановление положительных ионов натрия до металлического натрия: Na+ + е = Naо; o на аноде (положительном электроде) окисление хлорид – ионов до газообразного хлора: 2Cl- - 2е = Cl2о. Суммарная реакция выражается уравнением: 1 электролиз 2NaCl → 2Naо + Cl2о. Исходя из рассмотренного примера, можно сделать следующий вывод: при электролизе расплавов солей на инертных электродах происходит разложение солей на металл и продукт окисления аниона. Электролиз широко используется в различных отраслях промышленности. К числу областей его применения относятся следующие: металлургия. Электролизом растворов солей получают медь, цинк, кобальт, марганец. Электролизом расплавов солей - алюминий, магний, натрий, литий, бериллий, кальций и сплавы металлов. С помощью электролиза осуществляют рафинирование меди, золота, серебра, олова, свинца. химическая промышленность. Электролизом хлорида натрия получают важные промышленные продукты, такие как хлор, едкий натр, электролизом расплава смеси фтороводорода и фторида натрия – фтор, диоксид марганца - из раствора его сульфата, окислители для различных химических производств (пероксид водорода, перманганат калия, гипохлориты натрия и кальция, хлораты, хроматы, органические вещества (анилин из нитробензола) и т.д.). нанесение гальванопокрытий. Гальваническими называются металлические покрытия, наносимые на поверхность изделия методом электролиза. Их толщина составляет 1 – 100 мкм. Такие покрытия защищают от коррозии (цинкование, лужение), придают изделию красивый внешний вид (хромирование, никелирование, золочение), повышают электропроводность (меднение, серебрение), твердость и износостойкость (родирование, палладирование), улучшают отражательную способность поверхности (серебрение, хромирование), уменьшают коэффициент трения (свинцевание, осаждение сплавов олово – свинец, индий - свинец), придают поверхностным пленкам магнитные свойства (осаждение сплавов никель – кобальт, железо – никель). Электролиз проводят в гальванической ванне, делая катодом изделие, на которое наносится покрытие. Электролитом может служить раствор, содержащий смесь ионов различных металлов. Большие достоинства имеет электролиз с растворимым анодом, при этом потенциалы катода и анода одинаковы, а содержание ионов металла в растворе постоянно (расход компенсируется растворением анода). В состав электролита для получения гальванопокрытий вводят специальные добавки для увеличения электропроводности раствора (серную кислоту), обеспечивающие постоянный рН, блескообразователи (органические вещества, позволяющие получать покрытия, не требующие полировки). электрохимическая анодная обработка металлов (ЭХОМ). Метод позволяет обрабатывать изделия сложной конфигурации, а также очень твердые металлы и сплавы, которые не могут быть обработаны механически. Такая обработка не изменяет структуры металла, экономична (катод не изнашивается), но требует большого расхода электроэнергии для обеспечения высокой плотности тока. ЭХОМ используют для обработки лопастей турбин, штампов, пресс – форм, заточки режущего инструмента. Анодирование широко применяется для обработки алюминия (окисление металла приводит к образованию на аноде устойчивой пленки оксида алюминия Al2O3), магния, меди, титана. 2 3