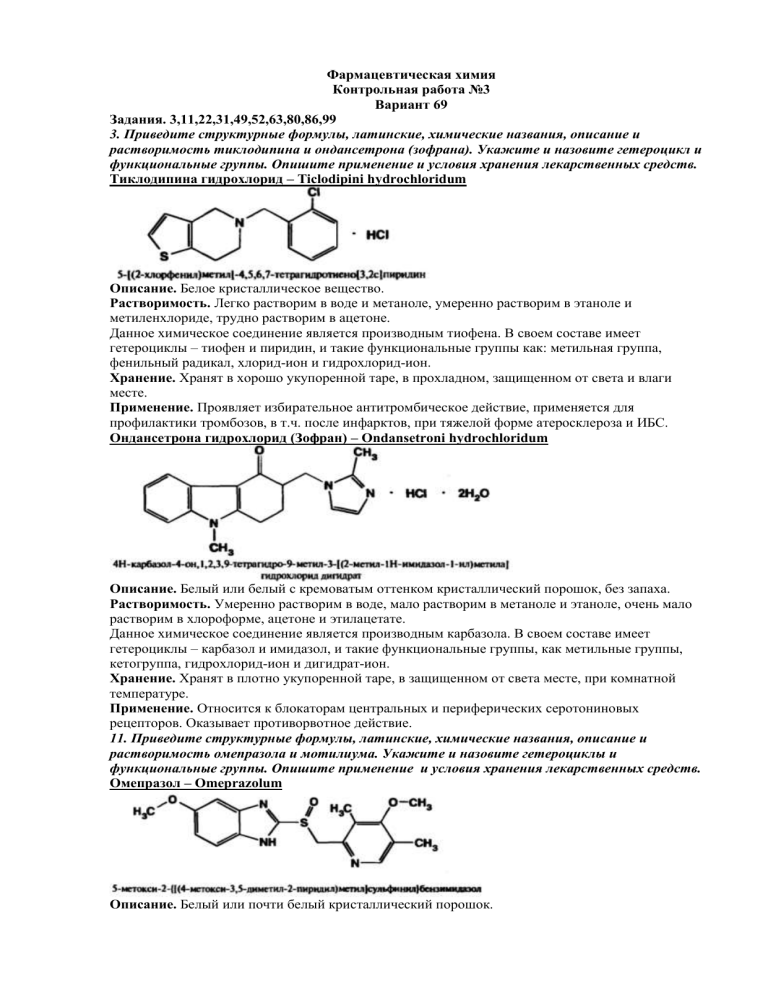
Фармацевтическая химия Контрольная работа №3 Вариант 69 Задания. 3,11,22,31,49,52,63,80,86,99 3. Приведите структурные формулы, латинские, химические названия, описание и растворимость тиклодипина и ондансетрона (зофрана). Укажите и назовите гетероцикл и функциональные группы. Опишите применение и условия хранения лекарственных средств. Тиклодипина гидрохлорид – Ticlodipini hydrochloridum Описание. Белое кристаллическое вещество. Растворимость. Легко растворим в воде и метаноле, умеренно растворим в этаноле и метиленхлориде, трудно растворим в ацетоне. Данное химическое соединение является производным тиофена. В своем составе имеет гетероциклы – тиофен и пиридин, и такие функциональные группы как: метильная группа, фенильный радикал, хлорид-ион и гидрохлорид-ион. Хранение. Хранят в хорошо укупоренной таре, в прохладном, защищенном от света и влаги месте. Применение. Проявляет избирательное антитромбическое действие, применяется для профилактики тромбозов, в т.ч. после инфарктов, при тяжелой форме атеросклероза и ИБС. Ондансетрона гидрохлорид (Зофран) – Ondansetroni hydrochloridum Описание. Белый или белый с кремоватым оттенком кристаллический порошок, без запаха. Растворимость. Умеренно растворим в воде, мало растворим в метаноле и этаноле, очень мало растворим в хлороформе, ацетоне и этилацетате. Данное химическое соединение является производным карбазола. В своем составе имеет гетероциклы – карбазол и имидазол, и такие функциональные группы, как метильные группы, кетогруппа, гидрохлорид-ион и дигидрат-ион. Хранение. Хранят в плотно укупоренной таре, в защищенном от света месте, при комнатной температуре. Применение. Относится к блокаторам центральных и периферических серотониновых рецепторов. Оказывает противорвотное действие. 11. Приведите структурные формулы, латинские, химические названия, описание и растворимость омепразола и мотилиума. Укажите и назовите гетероциклы и функциональные группы. Опишите применение и условия хранения лекарственных средств. Омепразол – Omeprazolum Описание. Белый или почти белый кристаллический порошок. Растворимость. Очень мало растворим в воде, трудно растворим в этаноле, растворим в метиленхлориде и разведенных растворах щелочей. Практически нерастворим в эфире и хлороформе. Данное химическое соединение является производным бензимидазола,В своей химической структуре имеет гетероциклы – бензимидазол, пиридин и такие функциональные группы как: метильные группы, метоксигруппы, сульфинильная группа. Хранение. Хранят в хорошо укупоренной таре, в защищенном от света месте, при температуре 25оС. Применение. Применяется как сильные ингибитор желудочной секреции, при язве желудка и двенадцатиперстной кишки, гастритах. Домперидон (Мотилиум) – Domperidonum Описание. Белый или почти белый кристаллический порошок. Растворимость. Практически нерастворим в воде, трудно растворим в этаноле, Практически нерастворим в эфире и хлороформе, растворим в ДМФА. Данное химическое соединение является производным бензимидазола. В своей химической структуре имеет гетероциклы пиперидин, бензимидазол и такие функциональные группы, как: хлорид-ион, оксигруппа, пропильная группа. Хранение. Хранят в хорошо укупоренной таре, в защищенном от света месте, при температуре 25оС. Применение. Антагонист дофаминовых рецепторов, назначается при расстройствах ЖТ, тошноте, гипотонии желудка. 22. Напишите формулу лекарственного средства, исходя из химического названия: Тропинового эфира дифенилуксусной кислоты гидрохлорид Приведите нумерацию гетероцикла, названия радикалов и функциональных групп, химические свойства (способность к гидролизу, кислотно-основные и окислительно-восстановительные свойства). Дифенилтропина гидрохлорид (Тропацин) – Diphenyltropini hydrochloridum Данное химическое соединение является производным тропана, имеет в своем составе тропановый гетероцикл, и такие радикалы и функциональный группы как: метильная группа, сложно-эфирная группа, фенильные радикалы и гидрохлорид-ион. Проявляет основные свойства, за счет наличия в своей химической структуре третичного атома азота в гетероцикле, сложноэфирной группы и фенильных радикалов. При гидролизе образуются вещества, которые в дальнейшем можно идентифицировать. Дает реакции на хлориды с нитратом серебра, на третичные атом азота и на сложноэфирную группу. Применение. Применяется при паркинсонизме, спастических порезах и параличах, при бронхиальной астме. Лекарственные формы: таблетки по 0,01 г. 31. Приведите способы идентификации фурациллина и фурадонина, основанные на особенностях структуры. Напишите соответствующие уравнения химических реакций с указанием эффекта. Идентификация фурациллина 1. ИК-спектроскопия 2. УФ-спектрофотометрия 3. Определение температуры плавления 4. Реакция с разбавленным раствором натрия гидроксида – образуется ацисоль, окрашенная в оранжево-красный цвет. 5. Реакция с раствором натрия гидроксида при нагревании происходит разрыв фуранового цикла с образованием натрия карбоната, гидразина и аммиака. Выделившийся аммиак определяют по синему окрашиванию красной лакмусовой бумажки. 6. Реакция с раствором 2,4-динитрофенилгидразином в среде ДМФА и 2М хлористоводородной кислоты, при кипячении выпадает осадок 2,4-динитрофенилгидразона, определяемого по температуре плавления (273оС) Идентификация фурадонина 1. ИК-спектроскопия 2. УФ-спектрофотометрия 3. Определение температуры плавления 4. Групповая реакция с раствором натрия гидроксида при небольшом нагревании наблюдается темно-красное окрашивание. 5. Реакция с раствором сульфата меди в среде ДМФА, в присутствии пиридина и хлороформа – хлороформный слой окрашивается в зеленый цвет. 6. Реакция с раствором 2,4-динитрофенилгидразином в среде ДМФА и 2М хлористоводородной кислоты, при кипячении выпадает осадок 2,4-динитрофенилгидразона, определяемого по температуре плавления (273оС) 49. Приведите способы идентификации солей хинина и хинидина, основанные на особенностях структуры. Укажите реакции отличия хинина от хинидина. Напишите соответствующие уравнения химических реакций с указанием эффекта. Идентификация солей хинина 1. ИК-спектроскопия 2. УФ-спектрофотометрия 3. ТСХ 4. Талейохинная проба. К раствору соли хинина добавляют несколько капель бромной воды и 1 мл раствора аммиака – появление изумрудно-зеленого окрашивания. 5. Реакция на третичный атом азота с реактивом Майера – образуется комплексное соединение в виде белого осадка. 6. Реакция на третичный атом азота с реактивом Бушарда – образуется комплексное соединение в виде бурого осадка. 7. Реакция на третичный атом азота с реактивом Драгендорфа – образуется комплексное соединение в виде оранжевого осадка. Идентификация солей хинидина 1. ИК-спектроскопия 2. УФ-спектрофотометрия 3. ТСХ 4. ВЭЖХ 5. Реакция на третичный атом азота с реактивом Майера – образуется комплексное соединение в виде белого осадка. 6. Реакция на третичный атом азота с реактивом Бушарда – образуется комплексное соединение в виде бурого осадка. 7. Реакция на третичный атом азота с реактивом Драгендорфа – образуется комплексное соединение в виде оранжевого осадка. Отличие хинина от хинидина. 52. Опишите определение примеси аминоантипирина в амидопирине (условия, реактивы, способ обнаружения примеси), приведите уравнения химических реакций. 63. Приведите условия (растворитель, титрант, индикатор) и уравнения химических реакций количественного определения дибазола и индометацина методами нейтрализации и кислотно-основного титрования в неводных средах. а) рассчитайте факторы эквивалентности и молярные массы эквивалентов; б) рассчитайте титры рабочих растворов по определяемому веществу, если используются 0,1 М. титранты. Количественное определение дибазола 1. Ацидиметрия в неводной среде, прямое титрование. Титрантом данного метода является 0,1М раствор хлорной кислоты, индикатор – кристаллический фиолетовый. Титрование проводят в среде ледяной уксусной кислоты, в присутствии ацетата ртути. Конечную точку титрования определяют потенциометрически. 2. Аргентометрия, метод Мора, прямое титрование. Титрантом данного метода является 0,1М раствор нитрата серебра, индикатор – хромат калия. Конечную точку титрования определяют по появлению бурового окрашивания раствора. 3. Алкалиметрия, прямое титрование. Титрантом данного метода является 0,1М раствор натрия гидроксида, индикатор – фенолфталеин. Конечную точку титрования определяют по появлению слабо-розового окрашивания. Количественное определение индометацина 1. УФ-спектрофотометрия 2. ВЭЖХ 3. Алкалиметрия, метод нейтрализации, прямое титрование. Титрантом данного метода является 0,1М раствор натрия гидроксида, индикатор – фенолфталеин. 4. Ацидиметрия в неводной среде, прямое титрование. Титрантом данного метода является 0,1М раствор хлорной кислоты, индикатор – кристаллический фиолетовый. Титрование проводят в среде ледяной уксусной кислоты. 80. Назовите титриметрические и физико-химические методы количественного определения (для титриметрических приведите условия: растворитель, титрант, индикатор) хинина дигидрохлорида и серотонина адипината. Напишите соответствующие уравнения химических реакций. а) рассчитайте факторы эквивалентности и молярные массы эквивалентов; б) рассчитайте титры рабочих растворов по определяемому веществу, если используются 0,1 М. титранты. Количественное определение хинина дигидрохлорида 1. Гравиметрия, которая базируется на осаждении основания хинина раствором натрия гидроксида, экстрагировании ее хлороформом и взвешивании остатка после отгонки хлороформа 2. УФ-спектрофотометрия 3. Алкалиметрия, прямое титрование. Титрантом данного метода является 0,1М раствор натрия гидроксида, индикатор – фенолфталеин. 4. Ацидиметрия в неводной среде, прямое титрование. Титрантом данного метода является 0,1М раствор хлорной кислоты. Титрование проводят в среде ледяной уксусной кислоты в присутствии ацетата ртути, индикатор – кристаллический фиолетовый. Количественное определение серотонина адипината 1. УФ-спектрофотометрия 2. ВЭЖХ 3. Ацидиметрия в неводной среде, прямое титрование. Титрантом данного метода является 0,1М раствор хлорной кислоты. Титрование проводят в среде ледяной уксусной кислоты, индикатор – кристаллический фиолетовый. 86. Опишите применение спектрофотометрии для идентификации и количественного определения цианокобаламина в субстанции и лекарственных формах ( ГФ Х, ст. 192 и 193). а) Если анализируется раствор, содержащий 200 мкг цианокобаламина в 1 мл раствора: - рассчитайте разведение лекарственной формы для получения раствора, содержащего 0,02 мг вещества в 1 мл, - рассчитайте количественное содержание цианокобаламина в мг/мл, если 1,0 мл анализируемого раствора разводят водой до 10,0 мл, а величина оптической плотности при 361 нм - 0,41. - соответствуют ли полученные результаты требованиям ГФ Х. Если анализируется раствор, содержащий 100 мкг цианокобаламина в 1 мл раствора, то разведение лекарственной формы для получения раствора, содержащей 0,02 мг цианокобаламина в 1 мл, составляет: 200/(1000 х 0,02) = 10 раз 99. Напишите на латинском языке состав лекарственной формы: Пилокарпина гидрохлорида 1%-10 мл Резорцина 0,05 Натрия хлорида 0,055 Предложите методики качественного и количественного анализа компонентов лекарственной формы (напишите соответствующие уравнения химических реакций). Рассчитайте молярные массы эквивалентов пилокарпина гидрохлорида и резорцина, титры рабочих растворов по определяемым веществам. Rp.: Pilocarpini hydrochloridi 1% - 10 ml Resorcini 0,05 Natrii chloridi 0,055 M.D.S. Идентификация пилокарпина гидрохлорида 1. ИК-спектроскопия 2. УФ-спектрофотометрия 3. Определение температуры плавления 4. Гидроксамовая проба на сложно-эфирную группу с раствором гидроксиламина, в присутствии натрия гидроксида, образуется гидроксамовая кислота, с последующем взаимодействии которой с раствором хлорида железа наблюдается фиолетово-красное окрашивание. 5. Реакция на хлорид-ионы с раствором нитрата серебра – образуется белый творожистый осадок, нерастворимый в азотной кислоте, но растворимый в избытке аммиака. НCl + AgNO3 → AgCl↓ + NaNO3 AgCl + 2NH4OH → [Ag(NH3)2]Cl + 2H2O 6. Реакция Легаля на лактонный цикл, со щелочным раствором нитропруссида натрия – появляется красно-вишневое окрашивание, не исчезающее при добавлении хлористоводородной кислоты. 7. Реакция Раймонда с раствором м-динитробензолом – наблюдается красно-фиолетовое окрашивание. Количественное определение пилокарпина гидрохлорида 1. УФ-спектрофотометрия 2. Ацидиметрия в неводной среде. Титрантом данного метода является 0,1М раствор хлорной кислоты, индикатор – кристаллический фиолетовый. Титрование проводят в среде ледяной уксусной кислоты, в присутствии ацетата ртути. 3. Алкалиметрия, прямое титрование. Метод нейтрализации по связанной хлористоводородной кислоте. Титрантом данного метода является 0,1М раствор натрия гидроксида, индикатор – фенолфталеин. Титрование проводят в водно-спиртовой среде в присутствии хлороформа. 4. Аргентометрия, метод Фаянса. Титрантом данного метода является 0,1М раствор нитрата серебра, индикатор – бромфеноловый синий. Титрование проводят в уксуснокислой среде. Идентификация резорцина 1. ИК-спектроскопия 2. УФ-спектрофотометрия 3. Определение температуры плавления 4. Реакция азосочетания с солями диазония, в присутствии раствора аммиака наблюдается желтое окрашивание. 5. Реакция с раствором хлорида железа – образуется комплексное соединение окрашенное в синий цвет 6. Реакция конденсации резорцина с раствором фталевого ангидрида (или гидрофталатом калия) образуется плав флуоресцеина желто-красного цвета, который при взаимодействии с гидроксидом натрия наблюдается интенсивная зеленая флуоресценция 7. Реакция конденсации резорцина с формальдегидом или хлороформом, в присутствии концентрированного раствора натрия гидроксида - появляется красно-фиолетовое окрашивание, которое переходит в светло-жёлтое при добавлении разведенной кислоты хлороводородной. Количественное определение резорцина 1. УФ-спектрофотометрия 2. ВЭЖХ 3. Броматометрия, обратное титрование. Титрантом данного метода является 0,1М раствор натрия тиосульфата, индикатор – крахмал. Точку эквивалентности определяют по обесцвечиванию раствора или потенциометрически. KBrO3 + 5KBr + 3H2SO4 → 3Br2 + 3K2SO4 + 3H2O Идентификация натрия хлорида 1. ИК-спектроскопия 2. Определение температуры плавления. 3. С ацетатом диоксоуран (VI) цинка с образованием жёлтого кристаллического осадка или жёлтых кристаллов тетра- и октаэдрической формы: NaCl + Zn(UO2)3(CH3COO)8 + CH3COOH + 9H2O → NaZn(UO2)3(CH3COO)9 · 9H2O↓ + HCl 4. Окрашивание бесцветного пламени горелки в жёлтый цвет 5. Реакция с гексагидроксостибатом (V) калия с образованием белого кристаллического осадка, растворимого в щелочах: NaCl + K[Sb(OH)6] → Na[Sb(OH)6]↓ + KCl В кислой среде реагент разрушается с образованием белого аморфного осадка метасурьмяной кислоты HSbO3: K[Sb(OH)6] +HCl → KCl + H3SbO4 + 2H2O H3SbO4 → HSbO3↓ + H2O 6. Реакция на хлориды с раствором серебра нитрата – выпадение белого творожистого осадка, растворимого в избытке аммиака Cl- + Ag+ → AgCl↓ AgCl + 2NH4OH → [Ag(NH3)2]Cl + 2 H2O Количественное определение натрия хлорида 1. Аргентометрия, метод Мора, прямое титрование. Титрантом данного метода является 0,1М раствором нитрата серебра, индикатор – хромат калия. 2. Аргентометрия, метод Фольгарда, обратное титрование. Титрантом данного метода является 0,1М раствор тиоцианата аммония, индикатор – железоаммонийные квасцы. Список литературы: 1. Беликов В.Г. Фармацевтическая химия в 2-х частях, 3 изд., перераб. и доп. — Пятигорск: 2003. 720 с. 2. Арзамасцев А.П. (ред.) Фармацевтическая химия, М.: ГЭОТАР-МЕД, 2004. — 640 с. 3. И. И. Краснюк, Г. В. Михайлова, Е.Т. Чижова. — Под. ред. Краснюка И.И., Михайловой Г.В. Учебник. — М.: Академия, 2004. — 464 с. — ISBN 5-7695-1407-8. — Для студентов образовательных учреждений среднего профессионального образования, обучающихся по специальности 0405 «Фармация». 4. Кулешова М.И., Гусева Л.Н., Сивицкая О.К. Анализ лекарственных форм, изготовленных в аптеках.-М.: Медицина, 1989 5. 6. Государственная Фармакопея СССР Х издание 7. Государственная Фармакопея Российской Федерации ХIII издание







