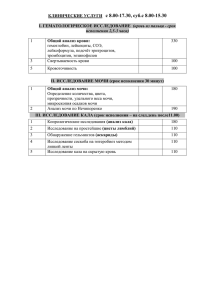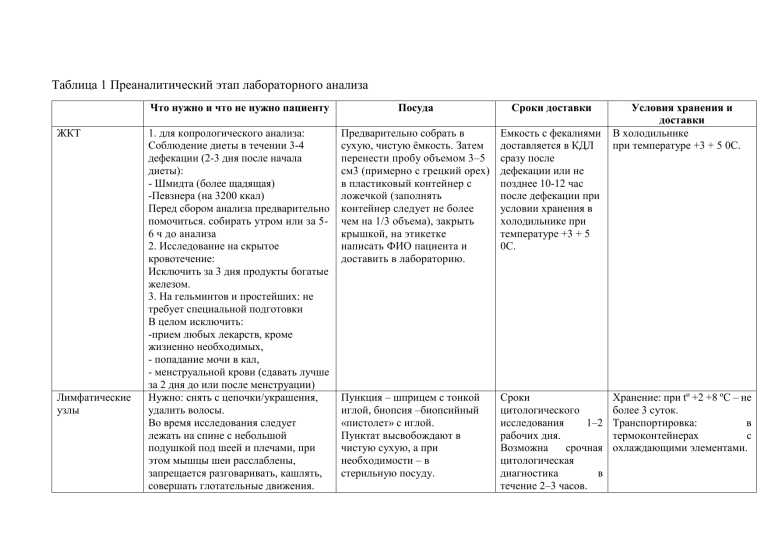
Таблица 1 Преаналитический этап лабораторного анализа ЖКТ Лимфатические узлы Что нужно и что не нужно пациенту Посуда Сроки доставки 1. для копрологического анализа: Соблюдение диеты в течении 3-4 дефекации (2-3 дня после начала диеты): - Шмидта (более щадящая) -Певзнера (на 3200 ккал) Перед сбором анализа предварительно помочиться. собирать утром или за 56 ч до анализа 2. Исследование на скрытое кровотечение: Исключить за 3 дня продукты богатые железом. 3. На гельминтов и простейших: не требует специальной подготовки В целом исключить: -прием любых лекарств, кроме жизненно необходимых, - попадание мочи в кал, - менструальной крови (сдавать лучше за 2 дня до или после менструации) Нужно: снять с цепочки/украшения, удалить волосы. Во время исследования следует лежать на спине с небольшой подушкой под шеей и плечами, при этом мышцы шеи расслаблены, запрещается разговаривать, кашлять, совершать глотательные движения. Предварительно собрать в сухую, чистую ёмкость. Затем перенести пробу объемом 3–5 см3 (примерно с грецкий орех) в пластиковый контейнер с ложечкой (заполнять контейнер следует не более чем на 1/3 объема), закрыть крышкой, на этикетке написать ФИО пациента и доставить в лабораторию. Емкость с фекалиями доставляется в КДЛ сразу после дефекации или не позднее 10-12 час после дефекации при условии хранения в холодильнике при температуре +3 + 5 0С. Пункция ‒ шприцем с тонкой иглой, биопсия ‒биопсийный «пистолет» с иглой. Пунктат высвобождают в чистую сухую, а при необходимости – в стерильную посуду. Сроки цитологического исследования 1‒2 рабочих дня. Возможна срочная цитологическая диагностика в течение 2‒3 часов. Условия хранения и доставки В холодильнике при температуре +3 + 5 0С. Хранение: при tº +2 +8 ºС ‒ не более 3 суток. Транспортировка: в термоконтейнерах с охлаждающими элементами. Бронхо-легочная система Половая система женщины Материал распределяют на стеклах тонким слоем (если получают обильный кровянистый материал, то готовят несколько стекол). Также биопсийный материал могут помещать в одноразовые стерильные пробирки типа «Эппендорф» объемом 1,5 мл, содержащие 0,5 мл транспортной среды. Необходимо проводить до Чистая, стерильная, Доставить мокроту антибактериальной терапии. широкогорлая, хорошо необходимо в Желательно собирать материал во закрывающаяся посуда лабораторию время приступа кашля. Лучше немедленно, не собирать утром, когда бронхи позднее одного часа максимально заполнены отделяемым. после её получения Рекомендуется пить много воды в течении дня за сутки до анализа. Полоскать рот кипяченой волов с 2% рром соды, почистить зубы. Собрать мокроту а не слюну. Исследование следует проводить Предметные стекла, чашки Материал должен перед менструацией или через 1-2 дня Петри или транспортные быть после ее окончания. Накануне контейнеры, Эпендорф с доставлен в исследования не следует проводить транспортной средой лабораторию в спринцевание. Материал берется до течение 2 ч. проведения мануального исследования Хранить необходимо в прохладном и темном месте Не допускать воздействие низких температур На гонорею материал должен быть доставлен в лабораторию в течение 12 ч, не допускается его охлаждение ниже 30 С. Мазки -Допускается увеличение сроков транспортировки до 48 ч при хранении материала при температуре 4-8 С Половая система мужчины Кожа Железы воздержание в течение 2,5-4,5 суток, не более 7 дней; регулярные семяизвержения в течение 1-2 месяцев перед исследованием. При наличии воспалительных заболеваний - провести санацию и выждать не менее 2 недель алкоголь в течение 6-7 дней; токсические факторы в течение 2,5 месяцев; Различные заболевания в течение 7-10 дней и гипертермия; тяжелые физические нагрузки, конфликтные ситуации; Использование кремов, масла, вазелина в процессе сдачи анализа Нужно взять чистую Незамедлительно сухую стеклянную лаборатории (или одноразовую пластмассовую) посуду с достаточно широким горлом, нагретую до температуры тела в Пункция, особых требований нет Материал распределяют на стеклах тонким слоем. Если при пункции железы получают обильный кровянистый материал, его распределяют на нескольких стеклах, готовя тонкие однослойные препараты, как готовят мазки крови. Материал, содержащий жидкость, необходимо центрифугировать и готовить препараты из осадка. Значительно улучшается качество мазков при использовании цитоцентрифуги. Емкость должна быть плотно закрыта для предотвращения испарения формалина и высыхания биоматериала. Образцы ткани незамедлительно помещают в специальную фиксирующую жидкость. Это необходимо для сохранности материала до гистологического исследования. Время с момента получения материала до его консервации не должно составлять более 2 часов. Фиксирующей жидкостью для хранения и транспортировки материала для гистологического исследования является 10% формалин, в соотношении материал: жидкость не менее чем 1:10. Материал необходимо сохранять при температуре +4..+6 °C до доставки в патоморфологическую лабораторию. Таблица 2 Преаналитический лабораторный этап Урогенитальный тракт Моча: Первая утренняя порция мочи Случайные пробы мочи Нюансы забора Дополнительные реактивы Возрастные и гендерные особенности 3 мазка (уретра, задний свод влагалища, цервикальный канал). При взятии биоматериала пользовать одноразовые стерильные зонды-тампоны с волокнистой головкой или же зонды (при ПЦР). Забор из влагалища происходит также при помощи медицинского зеркальца, далее б/м на зонд-тампоне помещают в транспортную среду или на предметное стекло. После 4х месяца при применении антибиотиков перорально и не раньше, чем через 10 дней после лечения; За 1,5-3 часа не мочеиспускаться; До или после менстуации за 4-5 дней цикла В течение ночи собирается в мочевом пузыре предпочтительно использовать для общего анализа; Анализ мочи следует провести в течение 2-х часов после получения материала; Первую порцию мочи не используют Можно собирать в любое время для общеклинического исследования и пробы Нечипоренко. Перед сбором мочи проводят тщательный туалет наружных половых органов. Если планируется посев с целью выделения гонококков, оптимально использовать транспортную среду Эймс с активированным углем, а в случае ее отсутствия – дакроновые тампоны, тампоны с альгинатом кальция либо ватные тампоны, импегрированные углем, поскольку хлопковая вата может быть токсичной для этих микроорганизмов. нет Моча должна быть собрана после тщательного туалета наружных половых органов в сухую, чистую, посуду или в посуду разового пользования. Нельзя исследовать во время менструации. После проведения цитоскопии анализ можно назначать не ранее, чем через 5-7 дней. Для сбора проб мочи у новорожденных детей применяются Пробы за определенный промежуток времени Собирают после первого утреннего мочеиспускания Сбор мочи за определенный промежуток времени используется при проведении пробы Зимницкого, исследовании глюкозурического профиля Для исследования суточной мочи Пациент собирает мочу в течение 24 часов на обычном питьевом режиме. Емкость объемом не менее 2 л. Следует напомнить пациенту, что первую утреннюю порцию не берут, а собирают все последующие порции; Последняя порция берется в то же время, когда накануне был начат сбор. Время начала и конца сбора отмечают. Определение глюкозы в моче Следует выполнить не позднее 2-х часов после мочеиспускания. В течение 8-12 час (в суточной моче) потеря глюкозы составляет примерно 40 %, если не добавлять стабилизатор. Кровь Кровь на все виды исследований берется натощак (последний прием пищи спустя 8-12 ч), до выполнения диагностических. Следует избегать интенсивной физической нагрузки. Перед взятием крови нельзя курить. При взятии крови важное значение имеет положение пациента (сидя, лежа). Взятую кровь необходимо сохранять в закрытой пробирке, вертикально в штативе и как можно быстрее (не менее 45 мин) доставить в лабораторию. Общее правило получения проб крови – как можно быстрее отцентрифугировать доставленный материал. Капиллярную кровь берут при мелких или мешки с гипоаллергенным приклеивающимся к коже покрытием. Катетер или пункция мочевого пузыря могут быть использованы только в крайних случаях. Наиболее часто применяют окраску по Романовскому, Нохту и ПаппенгеймуКрюкову. Для фиксации продолжают использовать спирт. В метиловом спирте фиксация продолжается 5-10 мин., в этиловом спирте – не менее 30 мин. При окраске по Паппенгейму фиксация мазков проводится раствором эозин-метиленового синего по Май-Грюнвальду. В настоящее время практически все клиникодиагностические лаборатории приобретают коммерческие красители, которые имеются в У стационарных больных кровь забирается в основном в положении лежа, а у пациентов амбулаторнополиклинического звена – в положении сидя. Капиллярную кровь собирают у младенцев. Кал СМЖ труднодоступных венах, при необходимости ежедневного мониторинга за показателями крови, капиллярной крови При взятии капиллярной крови возможен ряд особенностей, которые бывает трудно стандартизировать: физиологические – холодные, цианотичные пальцы, методические – малый объём исследуемой крови и, в связи с этим необходимость разведения образца для анализа. Венозная кровь берется из кубитальной вены, жгут накладывается не более 1 мин, кулак разжимается после попадания первых капель крови в пробирку. Кровь должна поступать свободным током непосредственно в пробирку, содержащую антикоагулянт. Перед сбором обязательно проводятся гигиенические процедуры. Собирать следует утром, если это затруднительно, можно подготовить пробу заранее, но не более чем за 8 часов перед сдачей кала в лабораторию. Пациент испражняется в чистый горшок. Если стул оформленный, то ложкой, входящей в комплект, берется проба фекалий весом около 1‒3 г, размером с зерно фасоли и переносится в контейнер без консерванта. Нельзя накануне принимать лекарственные препараты (слабительные, активированный уголь). Люмбальная пункция проводится между III и IV поясничными позвонками по линии Quincke (линия, соединяющая самые высокие части гребней двух подвздошных костей). Пункцию можно также проводить между L4-L5; L5-S1 и между L2 -L3. широком ассортименте. Последующее автоматическое дозирование фиксаторакрасителя и буферных растворов обеспечивает стандартную и равномерную окраску мазков. Определение наличия простейших паразитов в кале в некоторых тестах проводится с применением консерванта Турдыева, применение которого увеличивает срок хранения полученного материала до трех недель (при этом цисты сохраняют типичный вид и поддаются в течение этого срока идентификации), что повышает процент выявления простейших в кале. Гендерных или возрастных особенностей не имеется нет Нельзя проводить забор при беременности Мокрота Субокципитальная (цистернальная) пункция проводится между основанием черепа и 1-м шейным позвонком на высоте линии, соединяющей сосцевидные отростки. При проведении люмбальной пункции необходимо: - первые 3-5 капель ликвора удалить - собрать 3 порции (в исключительных случаях две) в стерильные пробирки, плотно закрыть, на каждой пробирке указать ее порядковый номер, имя, отчество и фамилию больного, время пункции, диагноз и перечень необходимых исследований Собирать во время приступа кашля, обязательно в чистую, широкогорлую, хорошо закрывающуюся посуду. Для полноценного исследования необходимо 3-5 мл материала, но можно и меньше. Для сбора диагностического материала используют специальные контейнеры. Размораживать и повторно замораживать материал нельзя. Выпад (Трансудат/Эксудат) Волосы/ногти Трихоскопия. Материал получают удалением хирургическим зажимом 50-100 волосинок. Выщипанные волосы размещают на предметном стекле, предварительно добавив минеральное масло. Препарат накрывают покровным стеклом. Вычёсывание щёткой. Вычесанные волосы помещаются на влажную фильтровальную бумагу, при наличии экскрементов блох легко обнаруживаются красно-коричневые точки на белой бумаге. Кожные соскобы. Возможна окраска азур-эозином и/или по Цилю-Нильсену. С помощью длинных штапелей отдельные составные фрагменты мокроты переносятся на предметное стекло. Приготавливают несколько нативных препаратов. Нет Минеральное масло Просветление ногтя (оставляют на 30-60 минут в растворе КОН). в некоторых случаях питательная среда для дерматофитов. нет Сначала надо подстричь волосы с выбранных участков кожи. Для получения поверхностного соскоба достаточно поскоблить кожу лезвием скальпеля или шпателем, смоченным минеральным маслом. Материал наносится на предметное стекло с каплей минерального масла, накрывается покровным и исследуется микроскопией. Ногти. Стерильными ножницами отрезают кусочек ногтя и помещают между стекол или в эпиндорф. Слюна Таблица 3 Методы клинических лабораторных исследований Метод Принцип Фотоколориметрический Основан на определении содержания веществ в растворах по поглощению немонохроматического излучения света в видимой области спектра. По интенсивности окраски установить концентрацию в растворе (чем ниже интенсивность света, проходящего через раствор, тем выше концентрация) Прибор Фотоколориметр: измерения ведутся в луче полихроматического узкоспектрального света, формируемого специальными светофильтрами. Обычно фотоколориметры используются для измерения оптической плотности растворов в диапазоне 315 – 630 нм и последующего определения концентрации этих растворов при помощи построения калибровочного графика. Характеристика прибора Тесты, бх жикости Наиболее Ферменты (АЛТ, АСТ, и распространенными тд), Общий белок являются две принципиальные схемы фотоэлектроколориметров: -схема прямого действия с одним фотоэлементом; -дифференциальная схема с двумя фотоэлементами, рассчитанная на попадание пучков света, проходящих соответственно через испытуемый раствор и нулевой растворы, на два разных фотоэлемента. В качестве приёмников излучения в них Турбодиметрический Принцип метода основан на измерении интенсивности света определённой длины волны, прошедшего через кювету, содержащую коллоидный раствор, чаще всего через суспензию, образованную частицами определяемого вещества. При этом интенсивность проходящего света уменьшается вследствие поглощения и рассеяния светового потока. Для турбидиметрических измерений можно использовать любой фотометр или спектрофотометр. Нефелометрический Измерение рассеянного Нефелометр света, позволяющее измеряющий определять характер и свет. концентрацию рассеивающих частиц. – используются фотоэлементы (селеновые и вакуумные), фотоэлектронные умножители, фоторезисторы (фотосопротивления) и фотодиоды. Конструктивно оптическая часть прибора состоит из различных линз, диафрагмы, ослабителей, светорассеивающих пластинок, а также приёмника. Фотометры называются «визуальными», если в качестве приёмника используется глаз, и «физическими», если применяется физический приёмник. Турбидиметрия применяется для анализа взвесей, суспензий и других мутных сред. ‒ В химии для определения количества веществ, выпавших в осадок; ‒ В биологии для подсчета количества клеток в растворе; ‒ В биохимии для изучения агрегации белков. В кдл используют иммунотурбидиметрические исследования, основанные на регистрации образования иммунных комплексов антигенантитело. прибор, Лампа накаливания Полимеры белковой рассеянный расположена под углом к природы приемнику света. (СРБ,РФ,фибриноген, Используют лазерные протеины плазмы крови), источники антител, антигенов. Измерение светорассеивания под разными углами дает информацию о размерах частиц в растворе. Иммунохимический Микроскопия световая Основанных на специфическом взаимодействии антигенов и антител с образованием иммунных комплексов. Способ идентификации и количественной оценки биомаркеров различных заболеваний с помощью антител. Расходящийся пучок света проходит сквозь образец, полученное изображение увеличивается объективом, ARCHITECT i2000SR Alinity хемилюминесцентный иммуноанализ. на парамагнитных частицах, а также современные уникальные технологии: система детекции сгустка, усовершенствованная акридиновая метка. иммуноферментный анализ (ИФА), иммунофлюоресценцию (ИФЛ), иммунохемилюминисценцию (ИХЛ), радиоиммунный анализ (РИА). Основная часть - окуляр, за счет него происходит увеличение объекта. Объектив (обычно их излучения.Лазер имеет высокую интенсивность излучения, строгую направленность излучения и фиксированную длину волны. Оптическая плотность от 0,5 до 4 единиц Один из компонентов АТ реакционной смеси АГ является определяемым веществом (образец), другой обладает специфичностью по отношению к определяемому веществу и является узнающим. Современные иммунохимические методы способны в процессе анализа выявлять как один аналит (определять один показатель), так и несколько диагностических показателей (мультиплексный анализ). Объективное увеличение: объективы малого и большого увеличения (8х и 40х), иммерсонные (90х Урогенитальные мазки, кровь, моча, кал, мокрота преломляется для поступления в тубус окуляра, где увеличивается еще раз. После этого пучок света поступает на сетчатку глаза, формируя картинку. Микроскопия электронная несколько) состоящий из системы линз в металлической оправе. Зеркало для направления пучка света на препарат. Предметный столик для закрепления препарата. Микроструктура твердых Используется поток тел, их электрические и электронов в вакуумной магнитные поля среде, роль оптических линз отведена электронному полю, оно фокусируется по по электронам Просвечивающая трансмиссионная или Двумерные изображения Сканирующая растровая - СЭМ или Получают картинки и 100х), окулярное увеличение: окуляры 7х, 10х,15х. Разрешающая способность – 0,2 мкм Поле формируется через электромагнитные катушки. Изображение передается на флюоресцирующий экран, фотоаппарат, 0,15 нанометров. четкие На объект (0,1мкм ) Электронный прожектор, воздействует пучок конседорные линзы, электронов (50-200 кэВ) , те проекционная система электроны которые не пройдут через образец, отклонятся на небольшой угол, и вместе с остальными попадут на магнитные линзы, и сформируют фотоотпечаток на люминесцентной пленке трехмерные Работает с образцами, Электронный прожектор, которые могут находиться в конседорные линзы, твердом состоянии в вакууме проекционная система, контроллеры вакуумной среды, мощные фотосистемы, дополнительные усилители поля Ультратонкие срезы тканей, микробов, строение вирусов, клеточная томография, локализация белков Строение вирусов, клеточная томография, локализация белков, деформация внутриклеточных структур ИФА Ионоселективный анализ Анализ газов крови Он основан на использовании ионоселективных электродов, которые представляют собой электрохимические системы, формирующие потенциал в растворе электролита, зависящий от концентрации ионов. С помощью ионоселективных электродов определяется активность ионизированных молекул. Ионы, связанные с белками, другими анионами и находящиеся в комплексе, не регистрируются ионоселективными электродами, т.е. общая концентрация микроэлемента не регистрируется. Это важно, так как биологически активными являются именно ионизированные молекулы. Основным элементом ионоселективного электрода является мембрана, проницаемая только для определенного иона. Измеряется парциальное давление газообразного В стеклянных электродах формируется кристаллическая решетка, ячейки которой чувствительны к тестируемому иону. В мембранных электродах в состав полимера вводится индуктор проводимости для соответствующего иона, который формирует каналы специфической проницаемости Ионоселективные электроды представляют собой электрохимические системы, формирующие потенциал в растворе электролита, зависящий от концентрации ионов. Анализаторы ионоселективные измеряют активность ионов в сыворотке, плазме, цельной крови, диализатах, моче. В клинической биохимии широко определяемыми катионами являются Н+ (pH), К+, Na+, Ca2+, Mg2+, Li+ и анион Cl-. Пространство между стеклянной мембраной и рСО2-электрод, который состоит из стеклянного Измеряет СО2, растворенного в крови – рСО2. Для этого используется рСО2-электрод. Измеряется рО2 амперометрически при помощи электрода Кларка. Молекулярногенетический Клоттинговый метод Фазово-контрастная микроскопия Основан на определении промежутка времени от добавления стартового реактива, запускающего каскад плазмы, до момента образования сгустка (выпадения фибрина). Образование фибрина приводит к увеличению мутности образца, которое детектируется оптической системой. Результатом измерения является время (в секундах) от старта до точки перегиба кривой. Изображения в микроскопе получается при сдвиге фаз электромагнитной волны. Контраст живых проницаемой для СО2 мембраной заполнено раствором хлорида и гидрокарбоната натрия. Диоксид углерода, физически растворенный в пробе, диффундирует в электролитный раствор NaCl и NaHCO3, где происходит образование угольной кислоты и диссоциация ее с образованием протона. электрода для измерения pH, газы крови, рН, отделенного от электролиты, метаболиты, исследуемого раствора показатели оксиметрии. мембраной, селективно проницаемой для диоксида углерода Анализаторы для оценки гемостаза можно разделить две группы: полуавтоматические коагулометры и полностью автоматизированные аналитические системы. Анализаторы гемостаза подразделяют, по способу регистрации момента образования сгустка, на оптические и механические. В основе регистрации момента выпадения сгустка в коагулометрах используются несколько принципов: механический, турбидиметрический, оптико-механический протромбинового теста (протромбиновое отношение, по Квику, MHO), определение концентрации фибриногена, АЧТВ, тромбинового теста, антитромбина III, определение активности VIII и IX факторов свертывающей системы и др. Для этих типов микроскопии часто применяют инвертированные микроскопы. Фазово-контрастное устройство может быть установлено на любом световом микроскопе и Применяется для изучения клеток культуры ткани, наблюдения действий различных вирусов на клетки. не больше при длине волны 128 для полной оксиметрии неокрашенных усиливается клеток Дифференциально интерференционноконтрастная микроскопия Поляризованный луч из источника света разделяется на 2 луча которые проходят разные оптические пути через образец, далее лучи сливаются, интерферируют и получается объемное 3D изображение. ДИКмикроскоп позволяет определить оптическую плотность исследуемого объекта, используя интерференцию света, и таким образом увидеть недоступные глазу детали. Экспресс методы Иммунохроматографический Тест представляет собой тест. В основе теста лежит иммунологическую полоску, состоящую из состоит из 1) набора объективов со специальными фазовыми пластинками; 2) конденсора с проворачивающимся диском в котором установлены кольцевые диафрагмы; 3) вспомогательного микроскопа между поляризатором и анализатором устанавливается призма Номарского. Преобразуется эллиптически поляризованный свет в амплитудный сдвиг волны, с помощью анализатора (поляризатора). Таким образом, можно сделать видимыми фазовые сдвиги разностей длин волн до 1/200 длины волны (или даже 1/1000 длины волны с использованием камеры) и всей длины волны. Прибор маленького размера, полоски должны храниться в закрытой Анализ используется для визуализации живых и неокрашенных биологических образцов, таких как мазок из культуры ткани или отдельных одноклеточных организмов, переносимых водой. Используется для определения тропонина, сердечного белка, принцип взаимодействия антигенов и антител. Анализируемый образец абсорбируется поглощающим участком теста. При наличии в анализируемом образце искомого антигена он связывается с нанесённым на полоску конъюгатом моноклональных антител, связанных с наночастицами золота. Образовавшийся комплекс движется по пористым материалам за счет капиллярных сил и в тестовой зоне взаимодействует с моноклональными детектирующими антителами Автоматический подсчёт Счетчики крови оценивают клеток крови размеры, структурные, цитохимические и другие характеристики клеток; комбинации моноклональных антител и пористых материалов. В зоне тестовой линии на мембране теста закреплены специфические антитела против искомого аналита. емкости, избегать попадания влаги. связывающего жирные кислоты (СБСЖК), МВ изофермента креатинкиназы (КК-МВ), миоглобина, возбудителей различных инфекционных заболеваний. Анализируют около 10000 клеток в одном образце и имеют несколько различных каналов подсчета клеточных популяций и концентрации гемоглобина; автоматического подсчета клеток основана на подсчете числа и определении По обе стороны которого расположены два изолированных друг от друга электрода. Если через узкий канал, заполненный электропроводящим раствором, проходит клетка крови, то в этот момент сопротивление I класс - до 20 параметров, включая расчетные показатели красной крови и тромбоцитов, гистограммы распределения лейкоцитов, эритроцитов и тромбоцитов по объему, а также частичную дифференцировку лейкоцитов на три популяции; Проточная цитофлоуриметрия Электрофорез Движение заряженных частиц в растворе под действием электрического поля. Электрофоретический метод в клинической лабораторной диагностике – это способ пространственного разделения молекул, характера импульсов, возникающих при прохождении клеток через отверстие малого диаметра (апертуру), Каждое событие – прохождение клетки через канал, сопровождается появлением электрического импульса. Концентрацию клеток определяют по числу электрических импульсов. электрическому току в канале возрастает. Что фиксируется на специальных специальным регистрирующим устройством. В большинстве случаев представлен агарозным гелем, через который пропускается электрический ток. Исследуемых объект находится в спец. лунках На водяной бане или в лабораторной печи плавят смесь агарозы, буфера и воды. Затем ее охлаждают до 50-60 °C и заливают в форму. Лунки для нанесения делаются при помощи гребенки. Исследуемый образец II класс - развернутый анализ крови, в том числе полную дифференцировку лейкоцитов по 5-ти параметрам-нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты (5Dif), гистограммы распределения лейкоцитов, эритроцитов и тромбоцитов по объему; III класс – помимо всего + подсчет и анализ ретикулоцитов, некоторых субпопуляций лимфоцитов; В основе работы анализаторов 1-го класса лежит кондуктометрический метод. Анализаторы 2 и 3-го классов используют в своей работе комбинации разных методов. имеющих разный заряд и размеры, путем помещения их в электрическое поле. Зональный электрофорез ведется при постоянном (не изменяющемся) значении рН буферного раствора, заполняющего данный носитель (бумагу, гель, др.). Исследуемый образец наносится пятном или тонким слоем на носитель, по которому и перемещается в электрическом поле. При изоэлектрическом фокусировании в среде для электрофореза создается плавный градиент рН. Белок останавливается в зоне, где значение рН равно его изоэлектрической точке (pI). При изотахофорезе заряженные ионы сначала разделяются в соответствии с величинами их заряда и подвижности, а затем перемещаются в электрическом поле с одинаковыми и постоянными скоростями. Иммуноэлектрофорез сочетает в себе электрофоретическое наносят в лунку при помощи дозатора. Когда краситель, помещаемый в лунки в начале эксперимента, достигает конца геля, электрофорез останавливают. Затем гель окрашивают красителем, который связывается с исследуемыми молекулами. Интенсивность окраски полос красителя дает представление о концентрации молекул в образце. Хроматография разделение белков с иммунопреципитацией, основанной на реакции «антиген – антитело». Это достигается в новых разработках, в частности при использовании капиллярного электрофореза. Капиллярный электрофорез основан на разделении компонентов сложной смеси в кварцевом капилляре под действием приложенного электрического поля. Физико-химический метод Фильтрация разделения и анализа смесей, основанный на распределении их компонентов между двумя фазами – неподвижной и подвижной (элюент), протекающей через неподвижную. Возможность разделения близких по свойствам веществ. Основаны на цикличных актах сорбции-десорбции, происходящих между подвижной фазой (элюентом) с растворенной В соответствии с агрегатным состоянием элюента различают: - газовую хроматографию ГХ (GC); - жидкостную хроматографию ВЭЖХ (HPLC). Газовая хроматография применяется для газов разделения, определения примесей вредных веществ в воздухе, воде, определения состава продуктов Газообразные, жидкие, и твер-дые вещества с молекулярной массой от единиц до 106. Это могут быть неорганические вещества, например, ионы металлов, изотопы водорода, и органические – белки, синтетические полимеры и т.д. пробой и неподвижным сорбентом. Культуральный метод Микрочиповая технология основного органического синтеза, лекарственных препаратов. Жидкостная хроматография используется для анализа, разделения и очистки синтетических полимеров, лекарственных препаратов, детергентов, белков, гормонов и др. биологически важных соединений. Культивирование Элективные питательные Термостат, чашки Петри, возбудителя на питательных среды, предназначенные для инкубаторы, аэраторы, средах, в организме выделения конкретных видов лабораторные шейкеры, лабораторных животных или микроорганизмов биореакторы на культурах тканей с целью выделения его в чистой культуре и последующей идентификации В основе механизма действия биочипов лежит молекулярное распознавание анализируемых молекул молекулами биополимерами, нанесёнными на чип. При добавлении к микрочипу меченных флюоресцентными красителями фрагментов Биочип представляет собой нерастворимую стеклянную, пластиковую, гелевую или кремниевую матрицу с множеством иммобилизованных на ней биологических объектов, которые способны избирательно связывать Постановка этиологического диагноза, определение дополнительных свойств микроорганизмов (н-р, чувствительность к антибиотикам), определение количества антибиотиков, типирование микроорганизмов Основная доля Микрочиповые системы производимых в мире разрабатываются для биологических осуществления микрочипов приходится на биохимических, ДНК-чипы (90%), энзиматических, содержащие фрагменты иммуноферментных ДНК длиной от 10 до 1 000 реакций, реакций ДНКнуклеотидов. гибридизации, На подложку белковых полимеразно-цепной чипов, составляющих 7– реакции (ПЦР). ДНК, например, генома человека, происходит их высокоспецифичное взаимодействие. В случае комплементарного связывания пробы с фрагментом ДНК в соответствующем элементе чипа наблюдается свечение. Название Центрифугирование вещества, содержащиеся в анализируемом растворе. 10% всех производимых чипов, наносятся белковые молекулы: ферменты, антитела, антигены и др. Метод ПЦР: для диагностики таких заболеваний как туберкулез, вирусный гепатит, инфекций, передающихся половым путем, онкологических и генных заболеваний, а также для определения генома человека и идентификация личности, диагностика генетических заболеваний. Описание Центрифугированию подвергается различный материал, поэтому эта процедура должна быть строго стандартизована. Для биохимических исследований (сыворотка) практически приемлемым является интервал 2 ч между взятием крови и центрифугированием. Кровь должна находиться в закрытых пробирках, крышки с пробирок перед центрифугированием не снимают. Если количество крови в пробирках разное, то подбирают одинаковые пары пробирок и каждую из них устанавливают в симметричные противоположные гнезда ротора центрифуги. Объемы, которые можно центрифугировать, варьируют в зависимости от модели центрифуги и конструкции ее ротора. При выборе оптимальных условий центрифугирования необходимо ориентироваться на центробежную илу (g). Центрифугирование – разделение веществ в поле центробежной силы. Центрифугирование применяется для разделения мелкодисперсных многокомпонентных смесей, а также для фракционирования клеточных органелл и определения молекулярного веса высокомолекулярных органических соединений, например белков, нуклеиновых кислот. Разделение веществ с помощью центрифугирования основано на том, что в центробежном поле частицы, имеющие различные размеры, форму и плотность, осаждаются (седиментируют) с разной скоростью. В зависимости от задач, стоящих перед исследователем, центрифугирование можно условно разделить на препаративное и аналитическое (седиментационный анализ). Препаративное центрифугирование заключается в выделении биологического материала для последующих биохимических исследований. Аналитическое центрифугирование применяется главным образом для изучения чистых или практически чистых препаратов макромолекул или частиц, например, рибосом. В данном случае используется небольшое количество материала, а седиментация исследуемых частиц непрерывно регистрируется с помощью специальных оптических систем. Дозирование Точность дозирования напрямую влияет на точность получаемого результата. Практически все дозаторы, используют один из двух методов: 1. Метод прямого дозирования – сначала жидкость заполняет точно заданный объем, а затем она максимально полно извлекается из этого объема в пробирку. 2. Метод обратного дозирования – жидкость заполняет больший объем, а затем из устройства извлекается строго заданное количество жидкости. Обратным способом удобно пользоваться при дозировке легко пенящихся и вязких жидкостей. При использовании стеклянных пипеточных дозаторов нужно стараться, чтобы мениск точно совпал с градуировочной риской, нанесенной на пипетке. Основной недостаток этой технологии – большая зависимость точности дозирования от мастерства и внимательности лаборанта. При дозировании с помощью стеклянных пипеток требуется некий вспомогательный элемент, с помощью которого возможно изменить давление в дозирующем капилляре, например резиновая груша, резиновая трубка. Автоматические пипетки служат для скоростного манипулирования при отборе и дозировании жидкостей, представляют собой устройство с пневматическим механизмом, действие которого основано на вытеснении жидкости воздухом. По конструктивным особенностям автоматические пипетки можно характеризовать по следующим основным группам: механические и электронные, одноканальные и многоканальные, фиксированного и переменного объема. Механические автопипетки автопипетки нашли применение в лабораториях. Многоканальные автопипетки по производительности значительно превышают одноканальные, но область их применения ограничена рамками узкоспециальной аппаратуры (ИФА). Автопипетки не увеличивают точность дозирования, они облегчают и ускоряют работу. Имеются ограничения на величину дозирования, особенно при ручном исполнении. При работе с биологическим материалом с разной плотностью (кровь, плазма, сыворотка крови, моча, слюнная жидкость и т.д.) рекомендуется при ручном дозировании использовать объемы не менее 3-5 мкл. Наконечники для дозаторов рекомендовано использовать однократно, после работы утилизируя их. Если вы дозируете одну и ту же жидкость, то в ходе работы можно не менять наконечник, но при переходе к другим растворам, обязательно следует сменить наконечник. При аккуратной работе наконечники можно использовать повторно, предварительно промыв их и подвергнув стерилизации и сушки. Наконечники изготавливаются из полипропилена, который выдерживает автоклавирование при 121 гр.С. Наконечники для дозирования бывают двух основных видов: стерильные и нестерильные. Для полимеразной цепной реакции (ПЦР) и других медицинских анализов, которым важна чистота и исключение чужеродных ДНК и РНК, нужно, использовать стерильные наконечники. Для каждой фирмы и типа дозаторов существуют свои, уникальные наконечники, но есть также и универсальные.