Химическое равновесие
advertisement
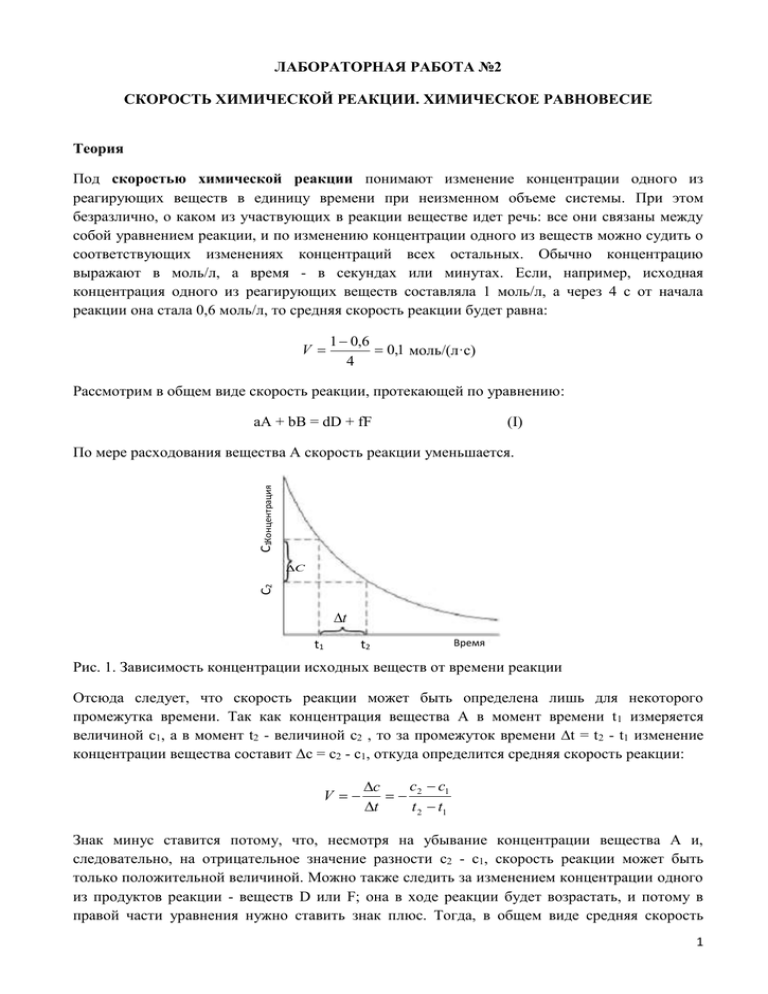
ЛАБОРАТОРНАЯ РАБОТА №2 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Теория Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объеме системы. При этом безразлично, о каком из участвующих в реакции веществе идет речь: все они связаны между собой уравнением реакции, и по изменению концентрации одного из веществ можно судить о соответствующих изменениях концентраций всех остальных. Обычно концентрацию выражают в моль/л, а время - в секундах или минутах. Если, например, исходная концентрация одного из реагирующих веществ составляла 1 моль/л, а через 4 с от начала реакции она стала 0,6 моль/л, то средняя скорость реакции будет равна: V 1 0,6 0,1 моль/(л·с) 4 Рассмотрим в общем виде скорость реакции, протекающей по уравнению: aА + bВ = dD + fF (I) C1Концентрация По мере расходования вещества А скорость реакции уменьшается. C2 C t t1 t2 Время Рис. 1. Зависимость концентрации исходных веществ от времени реакции Отсюда следует, что скорость реакции может быть определена лишь для некоторого промежутка времени. Так как концентрация вещества А в момент времени t 1 измеряется величиной c1, а в момент t2 - величиной c2 , то за промежуток времени ∆t = t2 - t1 изменение концентрации вещества составит Δc = c2 - c1, откуда определится средняя скорость реакции: V c c c 2 1 t t 2 t1 Знак минус ставится потому, что, несмотря на убывание концентрации вещества А и, следовательно, на отрицательное значение разности c2 - c1, скорость реакции может быть только положительной величиной. Можно также следить за изменением концентрации одного из продуктов реакции - веществ D или F; она в ходе реакции будет возрастать, и потому в правой части уравнения нужно ставить знак плюс. Тогда, в общем виде средняя скорость 1 реакции оределяется по уравнению: V c c c 2 1 t t 2 t1 Поскольку скорость реакции все время изменяется, то в химической кинетике рассматривают только истинную скорость реакции V, т.е. скорость в данный момент времени. Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации с, температуры t , присутствия катализаторов, а также от некоторых других факторов (например, от давления - для газовых реакций, от измельчения для твердых веществ, от радиоактивного облучения). Влияние концентраций реагирующих веществ Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики (закон действующих масс), устанавливающий зависимость скорости реакции от концентрации реагирующих веществ: cкорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Для реакции ( I ) этот закон выразится уравнением V k c A cB , a b (1) где сА и сВ - концентрации веществ А и В, моль/л; k - коэффициент пропорциональности, называемый константой скорости реакции. Основной закон химической кинетики часто называют законом действующих масс. Из уравнения (1) нетрудно установить физический смысл константы скорости k - она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или когда их произведение равно единице. Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций. Уравнение (1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислять скорости при других концентрациях тех же реагирующих веществ. Влияние температуры Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на каждые 10o скорость большинства реакций увеличивается в 2 - 4 раза. Эта зависимость выражается соотношением: 2 Vt2 Vt1 t2 t1 10 где Vt1 , Vt2 - скорости реакции соответственно при начальной ( t1 ) и конечной ( t2 ) температурах, а γ - температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10°. Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакций, протекающих при относительно низких температурах. Более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости. EA k k 0 e RT где k0 – предэкспоненциальный множитель; EA – энергия активации; R – универсальная газовая постоянная; T – абсолютная температура. Рис. 2. Графическая зависимость константы скорости от температуры При низких температурах химические реакции почти не протекают: k(T) 0. При очень высоких температурах константа скорости стремится к предельному значению: k(T) A. Это соответствует тому, что все молекулы являются химически активными и каждое столкновение приводит к реакции. Химическое равновесие Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия. Например, в реакции синтеза аммиака N2 + 3H2 <=> 2NH3 равновесие наступает тогда, когда в единицу времени образуется столько же молекул аммиака, сколько их распадается на азот и водород. Следовательно, химическое равновесие 3 можно определить как такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой. В состоянии равновесия прямая и обратная реакции не прекращаются. Поэтому такое равновесие называется подвижным или динамическим равновесием. И поскольку действие обеих реакций взаимно уничтожается, то в реагирующей смеси видимых изменений не происходит: концентрации всех реагирующих веществ – как исходных, так и образующихся – остаются строго постоянными. Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными. Они обычно обозначаются формулами реагирующих веществ, заключенными в квадратные скобки, например [Н2], [N2], [NH3], тогда как неравновесные концентрации обозначают так: CH2, CN2, CNH3. На состояние химического равновесия оказывают влияние концентрация реагирующих веществ, температура, а для газообразных веществ – и давление. При изменении одного из этих параметров равновесие нарушается и концентрация всех реагирующих веществ изменяется до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций. Подобный переход реакционной системы от одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия. Если при изменении условий увеличивается концентрация конечных веществ, то говорят о смещении равновесия в сторону продуктов реакции. Если же увеличивается концентрация исходных веществ, то равновесие смещается в сторону их образования. Направление смещения химического равновесия при изменениях концентрации реагирующих веществ, температуры и давления (в случае газовых реакций) определяется общим положением, известным под названием принципа подвижного равновесия или принципа Ле Шателье: если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменяется концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет воздействие. Влияние температуры В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое — эндотермическому. N2 + 3H2 ⇄ 2NH3 + Q Прямая реакция — экзотермическая, а обратная реакция — эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам: при повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. Влияние давления Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе. Влияние давления на положение равновесия подчиняется следующим правилам: при повышении давления равновесие сдвигается в направлении образования веществ (или 4 исходных продуктов) с меньшим объемом; при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом. Влияние концентрации Влияние концентрации на состояние равновесия подчиняется следующим правилам: при повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ. 5 Практическая часть ОПЫТ 1. Влияние концентрации реагирующих веществ на скорость химической реакции Реактивы: 1. Na2S2O3, раствор; 2. H2SO4, 1N раствор; 3. дистилированная вода. Посуда и принадлежности: 1. штатив с пробирками; 2. 6 стаканчиков на 50 мл; 3. секундомер. Реакция между тиосульфатом натрия и серной кислотой может быть выражена общим уравнением Na2S2O3 + H2SO4 Na2SO4 + SO2 + S + H2O Выделяющаяся сера делает раствор мутным. Проделайте предварительно опыт качественно. Для этого: 1. Внесите в пробирку 5-10 капель раствора тиосульфата натрия и 3-5 капель раствора серной кислоты. Наблюдайте появление мути. 2. Для проведения опыта возьмите шесть стаканчиков на 50 мл. 3. В три стаканчика налейте по 10 мл раствора серной кислоты. 4. В три других налейте раствор тиосульфата натрия Na2S2O3 и дистиллированной воды в следующем порядке: в первый – 10 мл раствора тиосульфата натрия и 20 мл воды, во второй – 20 мл раствора тиосульфата натрия и 10 мл воды, в третий – 30 мл раствора тиосульфата натрия, воду не добавляют. 5. Сгруппируйте стаканчики в три пары (тиосульфат-кислота). 6. В первый стаканчик с раствором тиосульфата натрия прилейте раствор серной кислоты (не наоборот!) и по секундомеру определите время с момента добавления кислоты до помутнения раствора. 7. Данные занесите в таблицу 1. Опыт повторите поочерёдно со второй и третьей парами стаканчиков. Таблица 1 Объём № раствора стаканчика Na2S2O3, мл 1 2 Объём воды, мл Объём Общий Условная раствора объём концентрация H2SO4, раствора, Na2S2O3 мл мл 10 20 10 40 10/40=с 20 10 10 40 20/40=2с - 10 40 30/40=3с 30 3 *у.е. – условные единицы Время течения реакции t, секунды Скорость реакции, у.е.* 1/t 6 Посторойте график зависимости скорости реакции от концентрации тиосульфата натрия. Для этого на оси абсцисс отложите в определённом масштабе относительные концентрации тиосульфата натрия, а на оси ординат – относительную скорость реакции (в условных единицах). Каким должен быть график при идеальном выполнении закона действующих масс? Сделайте вывод о зависимости скорости химической реакции от концентрации реагирующих веществ. ОПЫТ 2. Влияние температуры на скорость химической реакции Реактивы: 1. Na2S2O3, раствор; 2. H2SO4, 1M раствор; 3. дистилированная вода. Посуда и принадлежности: 1. 2. 3. 4. 5. штатив с пробирками; стакан на 500 мл; секундомер; термометр (0-50˚С) газовая горелка. 1. Налейте в три пробирки по 5 мл раствора тиосульфата натрия, а в другие три – по 5 мл раствора серной кислоты. 2. Сгруппируйте пробирки в три пары (кислота-тиосульфат). 3. Поместите все пробирки в стакан с водой, измерьте температуру воды в стакане и выдержите пробирки при этой температуре 5-7 минут. 4. Слейте вместе содержимое одной пары пробирок с серной кислотой и тиосульфатом. Отсчитайте время по секундомеру с момента сливания до появления мути. Данные наблюдения занесите в таблицу 2. 5. Стакан с оставшимися пробирками подогрейте на 10 градусов на электрической плитке. Выдержите растворы при этой температуре 5-7 минут. Слейте содержимое второй пары пробирок с серной кислотой и тиосульфатом. Отсчитайте время по секундомеру с момента сливания до появления мути. Данные наблюдения занесите в таблицу 2. 6. Проведите аналогичный опыт с последней парой пробирок. Для этого стакан с оставшимися пробирками подогрейте еще на 10 градусов (таким образом, температура в последнем опыте будет на 20 градусов выше первоначальной). Таблица 2 № опыта Температура 0 С Время течения реакции t, секунды Скорость реакции, у.е.* 1/t Во сколько раз изменяется скорость реакции при повышении температуры на 100 1 2 3 7 Сделайте вывод о зависимости скорости химической реакции от температуры. ОПЫТ 3. Влияние катализатора на скорость химической реакции Реактивы: 1. 2. 3. 4. 5. 6. Н2О2, 3% раствор; Н2О2, 30% раствор; PbO2; MnO2; FeCl3, раствор; индигокармин, раствор Посуда и принадлежности: 1. штатив с пробирками; 2. секундомер; 3. очки защитные. Опыт проводить в защитных очках! 3.1. Каталитическое действие диоксида свинца на разложение пероксида водорода 1. Налейте в пробирку 5-8 капель 3% раствора пероксида водорода Н2О2. Выделяется ли из раствора газ? 2. Внесите в раствор несколько крупинок диоксида свинца PbO2 и наблюдайте изменение скорости выделения газа. 3. Опишите наблюдения. 4. Напишите уравнение реакции разложения пероксида водорода. Сделайте вывод о влиянии катализатора на скорость химической реакции. 3.2. Сравнение каталитического действия различных катализаторов Проследите каталитическое действие нескольких катализаторов на реакцию разложения пероксида водорода по скорости обесцвечивания индигокармина вследствие окисления красителя выделяющимся кислородом. 1. Налейте в четыре пробирки по 4-5 капель раствора индигокармина. 2. В первую пробирку прибавьте в качестве катализатора несколько кристаллов диоксида марганца MnO2, во вторую – несколько кристаллов диоксида свинца PbO2, в третью 3-4 капли раствора хлорида железа (III) FeCl3, четвёртую оставьте в качестве примера. 3. Приготовьте в четырёх других пробирках по 4-5 капель 30%-ного раствора пероксида водорода. 4. Сгруппируйте пробирки (краситель с катализатором – пероксид водорода). 5. В первую пробирку с красителем прилейте раствор пероксида водорода и отсчитайте время в секундах по секундомеру с момента сливания растворов до изменения окраски красителя. 6. Данные наблюдения занесите в таблицу 3. 7. Проведите аналогичный опыт со второй и третьей парами пробирок. Таблица 3 8 № опыта Катализатор 1 MnO2 2 PbO2 3 FeCl3 Окраска индигокармина до начала реакции Окраска индигокрамина после окончания реакции Время изменения окраски индигокармина t, секунды Гомоили гетерогенный катализ 8. Сделайте вывод о каталитическом действии взятых катализаторов. Укажите, гомогенный или гетерогенный катализ имел место в каждом случае. ОПЫТ 4. Смещение реагирующих веществ химического равновесия при изменении концентрации Реактивы: 1. 2. 3. 4. 5. Fe(SCN)3, раствор FeCl3, 0,3М раствор; KSCN, 0,6М раствор; KCl, кристаллический; дистилированная вода. Посуда и принадлежности: 1. стаканчик на 50 мл; 2. штатив с пробирками. Влияние концентрации реагирующих веществ на химическое равновесие исследуется на примере реакции FeCl3 + 3KSCN Fe(SCN)3 + 3KCl Роданид железа Fe(SCN)3 сообщает раствору красную окраску. По изменению интенсивности окраски можно судить об изменении концентрации Fe(SCN)3, т.е. о смещении равновесия в ту или иную сторону. 9 1. Налейте в 4 пробирки по 2 мл Fe(SCN)3. 2. В первую пробирку добавьте 1 мл 0,3М раствора FeCl3, во вторую – 1 мл 0,6М раствора KSCN, в третью насыпьте 2-3 г кристаллического KCl, четвёртую пробирку оставьте для примера. 3. Сравните окраску растворов в трёх пробирках с окраской в контрольной пробирке. 4. Данные наблюдения занесите в таблицу 4. Таблица 4 № пробирки Добавленное вещество 1 FeCl3 Изменение интенсивности окраски (ослабление, усиление) Направление смещения равновесия (вправо, влево) KSCN 2 KCl 3 Напишите выражение для константы исследованного химического равновесия. Объясните происшедшие изменения, исходя из принципа Ле Шателье. Студент: …………………………………........................................ фамилия, имя Работа выполнена: ………………..... дата Работа защищена: Преподаватель: ………………....... подпись ……………………………………………………………. подпись преподавателя, дата 10 Контрольные вопросы 1. Объясните зависимость скорости химической реакции от природы реагирующих веществ на примере нижеприведенных реакций. а) 2Na + 2H2O = 2NaOH + H2↑ б) 2K + 2H2O = 2KOH + H2↑ 2. Как влияет концентрация исходных веществ на скорость реакции? Сформулируйте закон действующих масс и запишите его математическое выражение. 3. Какие вещества называются катализаторами? Как катализатор влияет на скорость реакции? Какие вещества называются ингибаторами? В каких случаях применяют ингибиторы? 4. Сформулируйте правило Вант-Гоффа и запишите его математическое выражение. 5. От чего зависит константа скорости реакции? 6. Какое состояние химической реакции называется равновесным? 7. Какие концентрации называются равновесными? 8. Как можно сместить равновесие химической реакции? 9. Как изменяется концентрация продуктов реакции при смещении равновесия в прямом направлении? 11 ОПЫТ 1. 1 шаг. 2 шаг. 3 шаг. 3 стаканчика : 10 мл H2SO4 3 стаканчика: 1) 10 мл Na2S2O3+ 20 мл H2O 2) 20 мл Na2S2O3+ 10 мл H2O 3) 30 мл Na2S2O3 сгруппировать в 3 пары (К-Т) К тиосульфату натрия прилить кислоту (НЕ НАОБОРОТ!!!) время по секундомеру до помутнения раствора ОПЫТ 2. сгруппировать в 3 пары (К-Т) 1 шаг. 3 пробирки – 5 мл Na2S2O3 3 пробирки – 5 мл H2SO4 2 шаг. все 6 пробирок в стакан с водой 3 шаг. взять пару К-Т 4 шаг. стакан с оставшими пробирками нагреть на 10оС 5 шаг. оставшиеся 2 пробирки нагреть еще на 10оС выдержить 5-7 мин при комнатной темп-ре к тиосульфату натрия прилить кислоту измерить темп-ру воды время по секундомеру с момента добавления К до помутнения раствора выдержить 5-7 мин и повторить шаг 3. выдержить 5-7 мин и повторить шаг 3. ОПЫТ 3, часть 3.2- Сравнение каталитического действия различных катализаторов! 1 пробирка + MnO2 2 пробирка + PbO2 3 пробирка +FeCl3 4 пробирка остается без изменений 1 шаг. в 4 пробирки налить 4-5 капель индигокармина + 2 шаг. 3 шаг. в 4 пробирки 4-5 капель 30% перекиси водорода H2O2 сгруппировать пробирки (индигокармин+катализатор – перекись водорода) 4 шаг. 1я пробирка с катализаторов + H2O2 5 шаг. ОПЫТ 4. проделать шаг 4 с остальными пробирками 1 шаг. 2 шаг. 4 пробирки – раствор Fe(CNS)3 1 пробирка + FeCl3 2 пробирка + KSCN 3 пробирка + KCl 4 пробирка – контрольная проба 3 шаг. сравнить окраску растворов в трех пробирках с контрольной пробой время по секундомеру с момента сливания до изменения окраски 12



