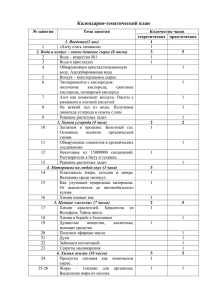
© Министерство образования Республики Беларусь Учреждение образования «Республиканский институт контроля знаний» РТ–2019/2020 гг. Этап I Тематическое консультирование по химии Вариант 2 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Структура периодической системы Д. И. Менделеева Содержание задания. Ответ А1. Щелочно-земельным металлом является химический элемент: 1) калий; 2) цинк; 3) бериллий; 4) натрий; 5) кальций. И Комментарий решение задания В группу IIA входят шесть металлов (бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba, радий Ra), четыре из них (Ca, Sr, Ba, Ra) получили название щелочно-земельных, так как образуют щелочи. Таким образом, из указанных элементов щелочно-земельным металлом является кальций Ответ: 5 Учебное издание Химия : учеб. для 8-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович, Е. И. Василевская, О. И. Сечко ; под ред. И. Е. Шимановича. – Минск : Нар. асвета, 2011. – § 8, 36; Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 53 РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии 1 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. А2. Электронную конфигурацию [Ne]3s23p4 в основном состоянии имеет атом химического элемента: Состояние электронов в атоме. Электронные конфигурации атомов 1) S; 2) Si; 3) C; 4) О; 5) Ne. Содержание задания. Ответ Ответ: 1 Неорганическая химия. А3. Суммарное число электронов и протонов в атоме кремния равно: Строение атома 1) 13; 2) 14; 3) 18; 4) 26; 5) 28. Неорганическая химия. Периодичность изменения свойств химических элементов Ответ: 5 А4. В пределах группы VIA в периодической системе с увеличением порядкового номера элемента наблюдается: 1) усиление неметаллических свойств; 2) уменьшение радиуса атома; 3) уменьшение электроотрицательности; 4) уменьшение заряда ядра; 5) увеличение числа электронов на внешнем уровне. Ответ: 3 РТ–2019/2020 гг. Этап I. Вариант 2 Комментарий и решение задания Учебное издание Распределение электронов по подуровням отображает электронная конфигурация атома, в которой цифрой слева записывается номер энергетического уровня, затем следует буква, обозначающая подуровень, цифра вверху справа указывает число электронов на этом подуровне. В указанной электронной конфигурации [Ne]3s23p4 внешнему уровню атома предшествует конфигурация неона. Так как неон расположен во втором периоде, восьмой группе, его внешний (второй) энергетический уровень полностью заполнен. Согласно конфигурации [Ne]3s23p4 электроны в атоме химического элемента расположены на трех уровнях, при этом на внешнем (третьем) находится шесть электронов. Исходя из физического смысла номера группы и номера периода элемент с представленной электронной конфигурацией расположен в шестой группе А, третьем периоде, это сера Атом состоит из положительно заряженного ядра (заряд определяется числом протонов) и отрицательно заряженных электронов. Число электронов и число протонов в атоме равны. Заряд ядра соответствует атомному (порядковому) номеру химического элемента. Порядковый номер кремния – 14. Следовательно, в атоме кремния находится по 14 протонов и электронов, их суммарное число равно 28 Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 13 Периодическая система является графическим выражением периодического закона, согласно которому свойства атомов химических элементов находятся в периодической зависимости от зарядов атомных ядер. В пределах группы с увеличением атомного номера элемента происходит увеличение заряда ядра, а также увеличение числа электронных слоев и, как следствие, радиуса атома. Вместе с этим уменьшается электроотрицательность атома элемента и ослабевают неметаллические свойства. Число электронов на внешнем энергетическом уровне не меняется. Значит, в пределах группы VIA в периодической системе с увеличением порядкового номера элемента наблюдается уменьшение электроотрицательности Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 15 Тематическое консультирование по химии Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 11 2 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Типы связи химической Содержание задания. Ответ А5. Все ковалентные связи являются НЕполярными в соединении: 1) хлорид калия; 2) моноклинная сера; 3) аммиак; 4) пропан; 5) углекислый газ. Ответ: 2 Комментарий и решение задания Учебное издание Ковалентная связь между атомами осуществляется за счет образования общих электронных пар. При соединении одинаковых атомов возникает ковалентная неполярная связь (S – S-связи в моноклинной сере), а при связывании разных атомов – ковалентная полярная связь (С – Н-связь в пропане, связи N – H в аммиаке и C = O в углекислом газе). В хлориде калия между ионами K+ и Cl– за счет электростатического взаимодействия противоположно заряженных ионов возникает ионная связь. Таким образом, все ковалентные связи являются неполярными в моноклинной сере Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 17– 18, 22 Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 21 Неорганическая химия. А6. В ряду соединений: Mn3N2, MnF4, K2MnO4, Ca(MnO4)2 степень окисления марганца: Определим степени окисления атомов марганца в указанных соединениях: Mn2 N3 , Mn4F1, K1 Mn6O2, Ca2(Mn7 O2 ) . Степень окисления атомов химических элементов 1) увеличивается; 2) уменьшается; 3) сначала уменьшается, затем увеличивается; 4) не изменяется; 5) сначала увеличивается, затем уменьшается. Как можно заметить, в предложенном ряду соединений степень окисления марганца увеличивается Неорганическая химия. Вычисление массы компонента по его массовой доле в смеси веществ Ответ: 1 А7. Образец минерала хромита массой 100 г состоит из соли, формула которой FeCr2O4, и не содержащих металлы примесей. Массовая доля примесей равна 3,85 %. Масса (г) железа в данном образце составляет: 1) 21; 2) 24; 3) 27; 4) 42; 5) 45. 3 2 4 2 4 4 2 1) Рассчитаем массу соли, формула которой FeCr2O4, в образце массой 100 г: m(FeCr2O4) = 100 г · (1 – 0,0385) = 96,15 г. 2) Найдем массу железа в данном образце: M(FeCr2O4) = 224 г/моль, M(Fe) = 56 г/моль; 96,15 г––––х г FeCr2O4 → Fe 224 г–––––56 г х = 24, m(Fe) = 24 г Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 6, 10 Ответ: 2 РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии 3 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Чистые вещества и смеси. Методы разделения смесей Неорганическая химия. Оксиды, их состав, классификация, получение Содержание задания. Ответ А8. Укажите рисунок, иллюстрирующий выделение твердого вещества из неоднородной смеси методом фильтрования: 1) 3) 2) 4) Ответ: 5 РТ–2019/2020 гг. Этап I. Вариант 2 Метод фильтрования направлен на разделение неоднородной смеси твердых и жидких веществ. Для этого разделяемую смесь переносят на фильтр – пористый материал, размер пор которого меньше размера твердых частиц, содержащихся в смеси. При этом твердые частицы остаются на поверхности, а жидкость легко проходит через фильтр. Установка для выделения твердого вещества из неоднородной смеси методом фильтрования изображена на рисунке 4 5) Ответ: 4 А9. Кислотный оксид является одним из продуктов реакции, схема которой: / кат ; 1) N2 + O2 t 2) CuS + HCl (разб) ; 3) NH4Cl + NaOH ; 4) Al(OH)3 t ; 5) SiН4 + O2 (изб) t . Комментарий и решение задания Оксиды – сложные вещества, состоящие из двух химических элементов, одним из которых является кислород в степени окисления –2. Оксиды делятся на солеобразующие (кислотные, основные, амфотерные) и несолеобразующие (NO, N2O, CO). Кислотному оксиду соответствует кислота. Составим уравнения реакций: , к ат 2NO↑; 1) N2 + O2 t 2) CuS + 2HCl (разб) ≠, реакция не протекает; 3) NH4Cl + NaOH NaCl + NH3 ↑ + H2О; t 4) 2Al(OH)3 Al2O3 + 3H2О; t SiO2↓ + 2H2О. 5) SiН4 + 2O2 (изб) Так как Al2O3 при образовании солей может давать как катион Al 3+, так и анион AlO 2–, он относится к амфотерным оксидам. NO не обладает кислотно-основными свойствами, поэтому указанный оксид несолеобразующий. H2О также не является кислотным оксидом. Оксиду SiO2, полученному в результате превращения 5, соответствует силикат-анион SiO32–, поэтому он относится к кислотным Тематическое консультирование по химии Учебное издание Химия : учеб. для 7-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Нар. асвета, 2012. – § 2; Химия : учеб. для 8-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович, Е. И. Василевская, О. И. Сечко ; под ред. И. Е. Шимановича. – Минск : Нар. асвета, 2011. – § 24 Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 1–2 4 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Основания, их состав, получение. Химические свойства щелочей Содержание задания. Ответ А10. Фенолфталеин приобретает малиновую окраску в растворе вещества, которое образуется в реакции соединения, протекающей между: 1) K и HBr; 2) Ca и H2O; 3) BaO и H2SO4; 4) SrO и H2O; 5) P2O5 и H2O. Ответ: 4 Неорганическая химия. А11. С разбавленной соляной кислотой в реакцию замещения вступает вещество: Кислоты, их состав, название. Общие химические свойства 1) кобальт; 2) оксид меди(II); 3) гидроксид кальция; 4) аммиак; 5) ртуть. Ответ: 1 РТ–2019/2020 гг. Этап I. Вариант 2 Комментарий и решение задания В реакцию соединения, в результате которой из нескольких реагентов образуется один продукт, вступают вещества пар SrO и H 2O, а также P2O5 и H2O. Уравнения реакций: SrO + H2O = Sr(ОН)2, гидроксид стронция; P2O5 + 3H2O (изб) = 2H3РO4, фосфорная кислота. Водный раствор фенолфталеина в нейтральной и кислой среде бесцветный, в щелочной фенолфталеин окрашивается в малиновый цвет. Значит, фенолфталеин приобретает малиновую окраску в водном растворе Sr(ОН)2, который образуется в результате реакции соединения между SrO и H2O Реакции замещения – это реакции между простым и сложным веществами, в ходе которых атомы простого вещества замещают атомы одного из элементов в сложном веществе. Водные растворы кислот вступают в реакции замещения с металлами, стоящими в ряду активности до водорода. В задании указано два металла – кобальт Со и ртуть Hg. В ряду активности до водорода расположен кобальт. Уравнение реакции: Со + 2HCl = СоCl2 + Н2↑ (реакция замещения); Hg + HCl ≠ . Проанализируем реакции соляной кислоты с веществами, указанными в других вариантах ответа: Ca(OH)2 + 2HCl = CaCl2 + 2H2O (реакция обмена); NH3 + HCl = NH4Cl (реакция соединения); СuO + 2HCl = CuCl2 + H2O (реакция обмена). Таким образом, с разбавленной соляной кислотой в реакцию замещения вступает кобальт Тематическое консультирование по химии Учебное издание Химия : учеб. для 7-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Нар. асвета, 2012. – § 17; Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 34, 53 Химия : учеб. для 7-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Нар. асвета, 2012. – § 17; Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 1–2, 50 5 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Соли, классификация, получение. Химические свойства Содержание задания. Ответ А12. Кислая соль образуется в результате взаимодействия (электролиты взяты в виде водных растворов): 1) H2SO4 и NH3 (изб); 2) HNО3 и MgO; 3) H2S (изб) и KOH; 4) Na2HPO4 и NaOH; 5) HBr и Ca(OH)2. Ответ: 3 Неорганическая химия. А13. Водород реагирует со всеми веществами, указанными в ряду: Водород как простое вещество 1) NH3, С3Н6, Li; 2) H2O, CO, Ba; 3) O2, PbO, Hg; 4) WO3, Cl2, Sr; 5) HСl, CO, Ba. Ответ: 4 РТ–2019/2020 гг. Этап I. Вариант 2 Комментарий и решение задания В зависимости от степени замещения атомов водорода в кислотах соли делятся на средние и кислые. Все кислые соли содержат в составе кислотного остатка атомы водорода. В реакции между избытком основания и кислотой образуются средние соли. Кислые соли образуются при взаимодействии избытка кислоты, содержащей в молекуле более одного атома водорода, с основанием. Кислые соли также образуются в реакциях средних солей с кислотами. Нейтрализовав кислую соль щелочью, можно получить среднюю соль. Составим уравнения возможных превращений: 1) H2SO4 + 2NH3 (изб) = (NH4)2SO4; 2) 2HNO3 + MgO = Mg(NO3)2 + H2O; 3) H2S (изб) + KOH = KHS + H2O; 4) Na2HPO4 + NaOH = Na3PO4 + H2O; 5) 2HBr + Ca(OH)2 = CaBr2 + 2H2O. Таким образом, кислая соль KHS образуется в результате взаимодействия веществ H2S (изб) и KOH Водород Н2 реагирует со многими неметаллами (азотом, бромом, иодом, фтором, хлором, серой, кислородом). Например: Cl2 + Н2 = 2НCl. При этом он не вступает в реакции с фосфором, кремнием, благородными газами. При нагревании со щелочными и щелочноземельными металлами водород образует гидриды, например: Sr + Н2 = SrН2. Кроме того, водород способен восстанавливать металлы из их оксидов. Уравнение реакции: WO3 + 3Н2 = W + 3Н2O. Из указанных в задании соединений Н2 не вступает в химическое взаимодействие с NH3, H2О, Hg, HCl. Водород реагирует со всеми веществами, представленными в ряду 4 Тематическое консультирование по химии Учебное издание Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 1–2, 44, 48 Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 36 6 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Галогены. Галогеноводородные кислоты. Химические свойства Содержание задания. Ответ А14. Выберите утверждения, верно характеризующие иодоводородную кислоту: а) относится к слабым кислотам; б) одноосновная бескислородная кислота; в) в реакциях с хлором и бромом проявляет восстановительные свойства; г) можно обнаружить с помощью фторида серебра(I); д) реагирует с раствором хлорида ртути(II). 1) б, в, г; 2) б, в; 3) а, г, д; 4) а, б, в; 5) б, в, г, д. Ответ: 5 А15. Методом вытеснения воды (см. рисунок) с наименьшими потерями можно собрать газ: Неорганическая химия. Получение кислорода лаборатории в 1) оксид углерода(IV); 2) аммиак; 3) кислород; 4) бромоводород; 5) сернистый газ. Комментарий и решение задания Учебное издание Характеризуя иодоводородную кислоту HI, следует заметить, что она является сильной одноосновной бескислородной (б). В реакциях с хлором и бромом проявляет восстановительные свойства (в). Уравнения реакций: 2HI + Сl2 = 2HCl + I2; 2HI + Br2 = 2HBr + I2. Иодоводородную кислоту можно обнаружить с помощью фторида серебра(I) (г): HI + AgF = AgI↓ + HF; Ag+ + I–= AgI↓. Кислота HI реагирует также с раствором хлорида ртути(II) (д): HgCl2 + 2HI = HgI2↓ + 2HCl; Hg2+ + 2I– = HgI2↓. Следовательно, правильный вариант ответа – 5 Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 37 В лабораторных условиях газообразные вещества в сосуд можно собирать вытеснением воздуха и вытеснением воды. Метод вытеснения воды нецелесообразно применять при собирании таких веществ, как оксид углерода(IV), аммиак, бромоводород, сернистый газ, так как эти газы растворяются в воде. С помощью прибора, изображенного на рисунке, методом вытеснения воды с наименьшими потерями можно собрать малорастворимый в воде газ кислород Химия : учеб. для 7-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Нар. асвета, 2012. – § 19 Ответ: 3 РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии 7 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Химические свойства азотной кислоты Содержание задания. Ответ А16. Концентрированная азотная кислота при комнатной температуре (20 ºС) полностью окисляет оба вещества пары: 1) KHCO3 и KHS; 2) Р и СО2; 3) Na2SiO3 и NH2CH3; 4) Fe и Al; 5) Cu и Mg. Ответ: 5 Неорганическая химия. А17. Накипь со стенок отопительного котла можно удалить, если в котел с водой: Соединения углерода 1) добавить муравьиную кислоту; 2) добавить угарный газ; 3) продуть азот; 4) добавить поташ; 5) добавить известковую воду. Ответ: 1 РТ–2019/2020 гг. Этап I. Вариант 2 Комментарий и решение задания Азотная кислота проявляет характерные свойства кислот: изменяет окраску индикаторов, вступает в реакции с основными оксидами, основаниями и солями. Кроме того, азотная кислота обладает специфическими окислительными свойствами. Сильным окислителем она является за счет атома азота в степени окисления +5. Например, при взаимодействии азотной кислоты с металлами образуются нитрат металла, продукт восстановления азотной кислоты и вода. При этом азотная кислота при комнатной температуре не взаимодействует с железом, хромом, алюминием, свинцом. По этой причине вариант 4 не подходит. Не может HNO3 окислить также KHCO3 (вариант 1), CO2 (вариант 2), Na2SiO3 (вариант 3). Следовательно, верным является вариант ответа 5. Уравнения реакций: Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2H2O; Mg + 4HNO3(конц) = Mg(NO3)2 + 2NO2 + 2H2O Накипь – минеральные нерастворимые отложения (СаСО3 и MgCO3), которые образуются в водонагревательных устройствах при кипячении воды с временной жесткостью (присутствуют ионы солей Са(НСО3)2 и Mg(НСО3)2). Удаление накипи сводится к растворению солей СаСО3 и MgCO3 в результате реакций, протекающих при добавлении определенных реактивов, например муравьиной кислоты: MgCO3 + 2НCООН = Mg(НСОО)2 + Н2О + CO2↑; СаCO3 + 2НCООН = Са(НСОО)2 + Н2О + CO2↑. Добавление поташа (K2CO3), известковой воды (Са(ОН)2), азота или угарного газа не приведет к растворению накипи, поскольку указанные вещества не взаимодействуют с карбонатами кальция и магния. Значит, накипь со стенок отопительного котла можно удалить, если в котел с водой добавить муравьиную кислоту Тематическое консультирование по химии Учебное издание Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 43 Химия : учеб. для 8-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович, Е. И. Василевская, О. И. Сечко ; под ред. И. Е. Шимановича. – Минск : Нар. асвета, 2011. – § 35 8 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Химические свойства металлов. Ряд активности. Способы получения Содержание задания. Ответ А18. Дана схема превращений Fe(NO3)2 Х … Y FeSO4. Реагентами Х и Y могут быть соответственно: а) олово, серная кислота (конц); б) цинк, серная кислота (разб); в) алюминий, серная кислота (разб); г) цинк, сульфат меди(II); д) серебро, серная кислота (конц); е) соляная кислота, серная кислота. 1) а, в, е; 2) а, б, в; 3) б, д; 4) б, в, г; 5) а, в, д. Ответ: 4 Неорганическая химия. Металлы группы IIA. Вычисление массы раствора и массовой доли растворенного вещества А19. Барий количеством 0,5 моль растворили в горячей воде массой 500 г. Для полученного раствора верными являются утверждения: а) его масса составляет 568,5 г; б) катионы бария можно обнаружить с помощью сульфата лития; в) массовая доля щелочи равна 15 %; г) количество анионов в 2 раза больше количества катионов. 1) б, в, г; 2) а, б, г; 3) а, в; 4) а, б, в, г; 5) а, б, в. Ответ: 1 РТ–2019/2020 гг. Этап I. Вариант 2 Комментарий и решение задания Проанализируем данные превращения. Олово (а) и серебро (д) не вытесняют железо из его нитрата, так как являются менее активными, чем железо, металлами (см. ряд активности металлов). Являясь более активными металлами, чем железо, в реакции с нитратом железа(II) вступают цинк (б, г) и алюминий (в). Составим уравнения реакций: Fe(NO3)2 + Zn = Zn(NO3)2 + Fe; 3Fe(NO3)2 + 2Al = 2Al(NO3)3 + 3Fe. С Fe(NO3)2 также не реагирует соляная кислота (е). Значит, веществом Х в схеме превращений может быть цинк или алюминий. Полученный в результате первого превращения продукт – железо – вступает в химическое взаимодействие с разбавленной серной кислотой (б, в) и сульфатом меди(II) (г). Уравнения реакций: Fe + H2SO4 = FeSO4 + H2↑; Fe + СuSO4 = FeSO4 + Сu↓. Значит, веществом Y может быть H2SO4 (разб) или СuSO4. Правильным является вариант ответа 4 Растворение бария в воде протекает по уравнению: Ва + 2Н2О = Ва(ОН)2 + Н2↑. 1) Вычислим массу полученного раствора: m(р-ра) = m(Ва) + m(Н2О) – m(Н2), M(Ва) = 137 г/моль; m(р-ра) = 0,5 моль · 137 г/моль + 500 г – 0,5 моль · 2 г/моль = 567,5 г. 2) Определим массовую долю щелочи в растворе: m(ВаОН ) 171 г/моль 0,5 моль 2 w(ВаОН ) 0,15, или 15 %. 2 m(р-ра) 567,5 г 3) Составим уравнение диссоциации гидроксида бария: Ва(ОН)2 → Ва2+ + 2ОН–. Количество ОН–-анионов в 2 раза больше количества катионов 2+ Ва . Качественным реактивом на катионы Ва2+ являются сульфатанионы SO 42–. При взаимодействии гидроксида бария с сульфатом лития образуется белый осадок, нерастворимый даже в сильных кислотах. Уравнение реакции: Ва(ОН)2 + Li2SO4 = 2LiОН + ВаSO4↓. Значит, для полученного раствора верными являются утверждения б, в, г Тематическое консультирование по химии Учебное издание Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 50, 56 Химия : учеб. для 8-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович, Е. И. Василевская, О. И. Сечко ; под ред. И. Е. Шимановича. – Минск : Нар. асвета, 2011. – § 28; Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 31 9 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Алюминий и соединения. его Вычисления по химическим уравнениям продуктов реакций по известной массе одного из вступивших в реакцию веществ Неорганическая химия. Обратимые реакции. Определение практического выхода продукта реакции Содержание задания. Ответ Комментарий и решение задания А20. Соль, полученную при сплавлении оксида алюминия массой 42,84 г с избытком оксида кальция, растворили в избытке разбавленной азотной кислоты. Масса (г) образовавшегося алюминийсодержащего продукта составляет: Составим уравнения протекающих реакций: t Са(AlO2)2 (1); Al2О3 + СаO Са(AlO2)2 + 8HNO3 = 2Al(NO3)3 + Са(NO3)2 + 4Н2О (2). 1) Найдем количество вступившего в реакцию оксида алюминия: 1) 119; 2) 179; 3) 181; 4) 186; 5) 194. 2 Ответ: 2 А21. В системе протекает обратимая гомогенная реакция 2O3 3О2. На рисунке изображены графики зависимости концентраций веществ O3 и О2 от времени. Определите практический выход (%) О2 на момент установления равновесия: 1) 67; 2) 60; 3) 50; 4) 40; 5) 33. n(Al O ) моль/дм3 6 5 4 3 2 1 0123456 O3 O2 мин 3 m 42,84 г M 0, 42 моль. 102 г / моль 2) Вычислим массу полученного алюминийсодержащего продукта в реакции 2: n(Са(AlO2)2) = n(Al2О3) = 0,42 моль; n(Al(NO3)3) = 2 · n(Са(AlO2)2) = 0,84 моль; M(Al(NO3)3) = 213 г/моль; m(Al(NO3)3) = 0,84 моль · 213 г/моль = 179 г Анализируя уравнение реакции, можно заметить, что O3 расходуется в 1,5 раза меньше, чем образуется О 2. Это значит, что если O3, начальная концентрация которого составляет 5 моль/дм 3 (см. график), прореагирует полностью, то концентрация О 2 станет равной: 5 · 1,5 = 7,5 моль/дм3. Согласно графику концентрация образовавшегося продукта равна 3 моль/дм3. Поэтому можем рассчитать практический выход О2 от теоретически возможного: η спракт стеор ; η (O2 ) 3 моль / дм3 7,5 моль / дм3 0, 4 , или 40 %. Учебное издание Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 10, 54 Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 28, 40 Таким образом, правильным является вариант ответа 4 Ответ: 4 РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии 10 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Обратимость химических реакций. Смещение химического равновесия под действием внешних факторов Содержание задания. Ответ А22. В равновесной системе СО2(г) + Н2(г) ⇄ СО(г) + Н2О(г) – Q смещению равновесия в сторону исходных веществ способствуют факторы: а) повышение давления; б) понижение давления; в) понижение температуры; г) повышение температуры; д) добавление СО; е) отвод Н2. 1) а, в, д; 2) в, д, е; 3) г, д, е; 4) б, в, е; 5) а, г, е. Ответ: 2 РТ–2019/2020 гг. Этап I. Вариант 2 Комментарий и решение задания Направление смещения химического равновесия при изменении внешних условий определяется принципом Ле Шателье: если на систему, находящуюся в состоянии равновесия, оказывается внешнее воздействие (изменяется температура, давление, концентрация веществ), то это равновесие смещается в сторону той реакции (прямой или обратной), которая ослабляет данное воздействие. Так, в случае эндотермической реакции при понижении температуры равновесие в системе смещается в сторону исходных веществ. При нагревании смещение равновесия происходит в сторону образования продуктов. Повышение давления способствует смещению химического равновесия в направлении реакции, сопровождающейся уменьшением количества газов, а его понижение стимулирует смещение равновесия в сторону увеличения количества газов. Поскольку в указанной равновесной системе количество газов слева и справа одинаково, изменение давления не оказывает влияния на смещение равновесия. Смещению равновесия в сторону обратной реакции также способствует уменьшение концентрации хотя бы одного из веществреагентов или повышение концентрации продуктов реакции. Следовательно, смещению равновесия в сторону исходных веществ способствуют факторы в, д, е Тематическое консультирование по химии Учебное издание Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 28 11 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Электролитическая диссоциация. Электролиты и неэлектролиты Содержание задания. Ответ А23. Лампочка прибора для определения электропроводности (см. рисунок) НЕ изменит яркость, если в разбавленный раствор серной кислоты добавить: 1) оксид углерода(II); 2) нитрат калия; 3) иодоводород; 4) оксид бария; 5) аммиак. Ответ: 1 Неорганическая химия. Сильные и слабые электролиты. Условия необратимого протекания реакций ионного обмена в растворах электролитов А24. В водном растворе в значительных концентрациях могут одновременно находиться ионы, указанные в ряду: 1) Ca2+, OH–, HCO3–; 2) OH–, NO3–, Cu2+; 3) Cl–, H2PO4–, NH 4+; 4) НS–, H+, SO42–; 5) Cl–, PO43–, Mg2+. Комментарий и решение задания Причина электропроводности водных растворов заключается в том, что в растворе электролиты диссоциируют на ионы, которые являются подвижными носителями электрических зарядов. Проанализируем, как зависит свечение лампочки от химических процессов, которые протекают в растворе. Лампочка изменит свою яркость, если в разбавленный раствор серной кислоты добавить каждое из веществ, указанных в вариантах ответа 2–3 и 5, поскольку изменится количество ионов – носителей электричества из-за диссоциации электролитов, добавленных в раствор или образовавшихся при растворении аммиака. При добавлении в раствор серной кислоты оксида бария ВаO (вариант 4) протекает реакция, продуктами которой являются труднорастворимое и малодиссоциирующее вещества: ВаO + H2SO4 = ВаSO4↓ + Н2О. Из-за минимального содержания ионов в растворе лампочка прибора для определения электропроводности может потухнуть. Лампочка прибора не изменит яркость, если в разбавленный раствор серной кислоты добавить оксид углерода(II), который не реагирует с компонентами раствора Слабый электролит H2S (вариант ответа 4), а также плохо растворимые электролиты Са(OH)2 (вариант ответа 1), Сu(OH)2 (вариант ответа 2), Mg3(PO4)2 (вариант ответа 5) в водном растворе не могут образовать значительную концентрацию ионов. В водном растворе в значительных концентрациях одновременно могут находиться ионы, соответствующие хорошо растворимым сильным электролитам NH4Cl и NH4H2PO4 (вариант ответа 3) Ответ: 3 РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии Учебное издание Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 32– 34 Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 32– 33 12 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Окислительновосстановительные реакции Содержание задания. Ответ Комментарий и решение задания А25. Разбавленная азотная кислота реагирует с марганцем по схеме Mn + HNO3 Mn(NO3)2 + N2 ↑ + H2O. 1) Обозначим степени окисления атомов марганца и азота: Mn + HNO3 Mn(NO3)2 + N2 ↑ + H2O, Mn 0 HN5O3 Mn 2 N5O3 N0 H 2O . Укажите массу (г) продукта окисления, если в результате реакции выделился азот объемом (н. у.) 1,48 дм 3: 2) Составим электронный баланс: 2е Mn0 Mn+2 2 · 5 (восстановитель), 5 10е 10 · 1 (окислитель). 2N N0 2 3) Запишем уравнение реакции и вычислим массу продукта окисления (Mn(NO3)2): M(Mn(NO3)2) = 179 г/моль; хг 1,48 дм3 5Mn + 12HNO3 = 5Mn(NO3)2 + N2↑ + 6H2O 5 · 179 г 22,4 дм3 х = 59, m(Mn(NO3)2) = 59 г Этиленгликоль относится к многоатомным спиртам. Его формула СН2ОН – СН2ОН. Этиленгликоль используется для синтеза полимерных материалов, синтетических волокон (например, лавсана), для получения антифризов, в лакокрасочной промышленности. Значит, верным является вариант ответа 2 1) 7; 2) 18; 3) 32; 4) 49; 5) 59. Ответ: 5 Органическая химия. А26. Этиленгликоль используется в промышленности для получения: Применение органических веществ 1) капрона; 2) лавсана; 3) ацетатного волокна; 4) каучука; 5) полистирола. 2 2 Учебное издание Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 29 Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 26 Ответ: 2 РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии 13 Раздел программы вступительных испытаний. Элемент содержания Органическая химия. А27. Модели молекул углеводородов, содержащих π-связи, изображены на рисунках Теория химического строения органических соединений а) в) д) б) г) е) Содержание задания. Ответ 1) а, б; 2) б, в, д; 3) а, г, е; 4) в, г; 5) а, б, д. Комментарий и решение задания Согласно теории химического строения атомы в молекулах соединяются друг с другом в соответствии с их валентностью. Валентность углерода в органических соединениях равна четырем, водорода – единице. Посчитав число атомов углерода в молекулах, модели которых представлены на рисунках, а также связанных с углеродом атомов водорода, составим структурные формулы указанных органических соединений: а) СН2 = СН – СН = СН2, бутадиен-1,3; б) СН3 – СН = СН – СН3, бутен-2; в) СН3 – СН(СН3) – СН2 – СН3, 2-метилбутан; г) СН3 – СН2 – СН3, пропан; д) СН2 = СН2, этен; е) СН3 – СН2 – СН2 – СН3, бутан. Все атомы в молекулах насыщенных углеводородов (в, г, е) связаны σ-связями. Модели молекул углеводородов, содержащих πсвязи, изображены на рисунках а, б, д Учебное издание Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 3, 5, 9, 14–15 Ответ: 5 РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии 14 Раздел программы вступительных испытаний. Элемент содержания Органическая химия. Содержание задания. Ответ Комментарий и решение задания А28. Изомерами вещества, формула которого CH2 = CH – (CH2)3 – CH = CH2, являются: Диены. Строение молекул. Изомерия а) Органическая химия. Ненасыщенные углеводороды: алкены и алкины. Особенности строения. Общая формула класса г) 2,3-диметилпентадиен-1,3; ; б) 2-метилгептадиен-2,4; д) в) 1) а, б, в; 2) б, в; 3) а, в, г; 4) б, г; 5) а, г. е) гексин-3. ; ; Ответ: 3 А29. Молекула этина присоединила одну молекулу водорода. В молекуле продукта реакции по сравнению с исходным веществом наблюдается: 1) увеличение валентного угла HCC; 2) увеличение массовой доли водорода; 3) уменьшение числа σ-связей; 4) увеличение числа π-связей; 5) уменьшение длины С–С-связи. Ответ: 2 Учебное издание Изомеры – вещества, молекулы которых имеют одинаковый качественный и количественный состав, но разное строение. Изомеры могут отличаться структурой углеродной цепи, положением в ней кратной связи (структурные изомеры). Соединение, структурная формула которого CH2 = CH – (CH2)3 – CH = CH2, имеет название гептадиен-1,6. Его состав можно выразить молекулярной формулой С7H12. Вещества, названия которых приведены в вариантах ответа б, д, е, не могут быть изомерными гептадиену-1,6, поскольку отличаются от него количественным составом молекул. Соединения, представленные буквами а, в, г, имеют одинаковый с веществом CH2 = CH – (CH2)3 – CH = CH2 качественный и количественный состав молекул, но различаются химическим строением, поэтому являются изомерами Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 14, 58 Этин НС ≡ СН – простейший углеводород, содержащий в составе молекулы одну тройную связь. Общая формула гомологического ряда этина – СnН2n – 2. Длина С≡С-связи в молекуле этина равна 0,120 нм, валентные углы НСС – 180 °. В результате реакции присоединения одной молекулы водорода к молекуле этина образуется этен – углеводород с одной двойной С=Ссвязью. Уравнение реакции: t, p, кат НС ≡ СН + Н2 Н2С = СН2. Длина С=С-связи в молекуле этена увеличивается до 0,133 нм, валентные углы НСС уменьшаются до 120 °. Найдем массовые доли углерода в этине С2Н2 и этене С2Н4: A (H) 2 2 w(H В С Н ) r 0, 077; 2 2 M (С Н ) 26 Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 7; r w(Hв С2 Н4 ) 2 2 A (H) 4 r M (С Н r 2 4 ) 4 28 0,143. Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 9, 14 Значит, в молекуле продукта реакции по сравнению с исходным веществом наблюдается увеличение массовой доли водорода РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии 15 Раздел программы вступительных испытаний. Элемент содержания Органическая химия. Арены. Химические свойства бензола Органическая химия. Спирты. Номенклатура. Химические свойства Органическая химия. Альдегиды. Номенклатура. Получение Содержание задания. Ответ А30. При полном сгорании бензола количеством 0,08 моль выделится углекислый газ объемом (н. у., дм3): 1) 53,76; 2) 33,60; 3) 13,44; 4) 11,46; 5) 10,75. х = 10,75, V(СО2) = 10,75 дм3 1) H2, HCl; 2) K, CH3COOH; 3) Na, NaCl; 4) C2H6, HBr; 5) Cu(OH)2, HСl. Ответ: 2 А32. Потемневшая при нагревании медная проволока после опускания в сосуд с органическим веществом Х снова заблестела. При этом в сосуде образовался масляный альдегид. Укажите вещество Х: Ответ: 3 РТ–2019/2020 гг. Этап I. Вариант 2 Составим уравнение реакции сгорания бензола и найдем объем выделившегося углекислого газа: 0,08 моль –––––––– х дм3 12СО2 + 6Н2 О. 2С6Н6 + 15О2 2 моль –––––––––– 12 · 22,4 дм3 Ответ: 5 А31. Как пропанол-1, так и глицерин вступает в химические реакции с каждым веществом ряда: 1) бутанол-2; 2) масляная кислота; 3) бутанол-1; 4) бутилметаноат; 5) пропанол-2. Комментарий и решение задания Учебное издание Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 17, 20 Структурная формула пропанола-1: СН3 – СН2 – СН2ОН, структурная формула глицерина: СН2ОН – СНОН – СН2ОН. Ни пропанол-1, ни глицерин не реагируют с веществами, формулы которых H2, NaCl, C2H6. В отличие от пропанола-1 глицерин как многоатомный спирт реагирует с Cu(OH)2. При этом как пропанол-1, так и глицерин вступают в химические реакции с K, CH3COOH Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 22– 23, 26 При длительном нагревании медной проволоки металл Cu окисляется и на его поверхности образуется оксид меди(II) CuO черного цвета. Уравнение реакции: t 2CuO. 2Cu + O2 После внесения потемневшей проволоки в сосуд со спиртом она снова приобретает металлический блеск, так как происходит восстановление CuO до меди, а спирт окисляется в альдегид. По условию задания образуется масляный альдегид (бутаналь). Значит, окисленным веществом должен быть первичный спирт, это бутанол-1. Уравнение реакции: t CH3CH2CH2CНO + Cu + H2O CH3CH2CH2CH2 OH + CuO Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 23, 31 Тематическое консультирование по химии 16 Раздел программы вступительных испытаний. Элемент содержания Органическая химия. Карбоновые кислоты. Химические свойства. Получение Органическая химия. Сложные эфиры. Получение. Химические свойства Содержание задания. Ответ А33. Молярная масса (г/моль) органического соединения Х2, полученного согласно схеме превращений О / Co2 , Mn2, t 2 C4H10 Х1 1) 75; 2) 88; 3) 90; 4) 91; 5) 112. 1) СН3СН2СН2ОН и С2Н5СООK; 2) СН3СН2СН2ОK и СН3СООK; 3) (СН3)2СНСН2ОН и НСООK; 4) С2Н5ОН и С2Н5СООН; 5) С2Н5ОK и С2Н5СООН. Углеводы. Номенклатура. Химические свойства А35. Гидролизу НЕ подвергается: 1) мальтоза; 2) сахароза; 3) амилопектин; 4) целлюлоза; 5) рибоза. Составим схемы реакций в соответствии с данными превращениями и найдем молярную массу органического соединения Х2: О / Co2 , Mn2 , t CH 2 СН СOOН (X ); 4 10 СН СOOН + NН СН 3 2 3 уксусная кислота 1 HO 3 2 СН 3СOONН 3СН 3 (X 2). ацетат метиламмония M(СН3СOONН3СН3) = 91 г/моль Ответ: 4 А34. Укажите продукты щелочного гидролиза сложного эфира, который является изомером пентановой кислоты: Ответ: 3 Органическая химия. NH CH 2 3 Х2, равна: Комментарий и решение задания Сложные эфиры образуются в реакциях карбоновых и кислородсодержащих минеральных кислот со спиртами в присутствии сильной неорганической кислоты (H2SO4), выполняющей роль катализатора. Важнейшее химическое свойство сложных эфиров – способность к гидролизу (кислотному и щелочному). При полном щелочном гидролизе сложных эфиров образуются спирт и соль карбоновой или минеральной кислоты. Молекулярная формула пентановой кислоты: С5Н10О2. Согласно представленной информации продуктами щелочного гидролиза сложного эфира, который является изомером пентановой кислоты, являются (СН3)2СНСН2ОН и НСООK Моносахариды не подвергаются гидролизу, дисахариды (сахароза, мальтоза) и полисахариды (целлюлоза, амилопектин) гидролизуются до моносахаридов. Из предложенных углеводов моносахаридом является рибоза. Значит, гидролизу не подвергается рибоза Учебное издание Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 34– 35 Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 39– 40 Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 44 Ответ: 5 РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии 17 Раздел программы вступительных испытаний. Элемент содержания Органическая химия. Амины. Особенности строения. Номенклатура. Классификация Органическая химия. Содержание задания. Ответ А36. Первичным амином является: Амины можно рассматривать как органические производные аммиака, в молекулах которого один или несколько атомов водорода замещены на углеводородную группу. При замещении одного атома водорода образуются первичные амины (– NH2), двух – 1) триметиламин; 2) дифениламин; 3) глицин; 4) 3-метилпентанамин-2; 5) метилэтиламин. вторичные (–NH –), трех – третичные ( Ответ: 4 А37. Число аминокислотных остатков в составе молекулы Аминокислоты. Химические свойства. Пептидная связь равно: 1) 1; 2) 2; 3) 3; 4) 4; 5) 5. Комментарий и решение задания N ). Из указанных соединений глицин относится к аминокислотам. Аминами являются триметиламин (СН3)3N, дифениламин C6H5NHC6H5, 3-метилпентанамин-2 CH3СH(NH2)СH(CН3)CН2CH3, метилэтиламин СН3NHC2H5. К первичным аминам относится 3-метилпентанамин-2 При определенных условиях аминокислоты вступают в химическое взаимодействие друг с другом. При этом карбоксильная группа одной молекулы аминокислоты реагирует с аминогруппой другой молекулы. В результате образуется соединение, в котором остатки аминокислот связаны пептидной связью – СO – NH–. При гидролизе пептидов пептидные связи разрушаются и снова образуются аминокислоты, из которых был синтезирован пептид. Остатки аминокислот в указанном пептиде связаны двумя пептидными связями. Следовательно, представленная молекула образована из трех аминокислотных остатков Учебное издание Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 51 Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 53 Ответ: 3 РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии 18 Раздел программы вступительных испытаний. Элемент содержания Органическая химия. Общие понятия о высокомолекулярных соединениях Содержание задания. Ответ Комментарий и решение задания А38. В реакциях поликонденсации мономерами могут быть соединения, формулы которых: а) ; в) COOH H2N ; д) FCH HCOO б) HO OH; г) CHF; COOH ; е) . 1) б, в, г; 2) а, в, е; 3) б, г, д; 4) а, д, е; 5) а, г. Органическая химия. Номенклатура. Классификация органических соединений Ответ: 1 В1. Установите соответствие между названием органического соединения и общей формулой гомологического ряда, к которому данное соединение относится. А) гептен-3 Б) пентаналь В) циклобутан Г) гексанол-2 1) CnH2n+2 2) CnH2n 3) CnH2nО 4) CnH2n–2 5) CnH2n+2О Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б2В5Г1. Помните, что некоторые данные правого столбца могут использоваться несколько раз. Учебное издание Полимеризацией называют последовательное соединение молекул низкомолекулярных соединений за счет разрыва π-связей с образованием высокомолекулярных соединений. Реакция поликонденсации протекает с образованием полимеров из мономеров с выделением побочных низкомолекулярных соединений, например воды. Соединения, формулы которых предложены в вариантах ответа б, в, г, образуют высокомолекулярные вещества в реакциях поликонденсации. Значит, правильный ответ – 1 Распределим данные соединения по гомологическим рядам. Название соединения А) гептен-3 Б) пентаналь В) циклобутан Г) гексанол-2 Гомологический ряд алкены насыщенные альдегиды циклоалканы насыщенные одноатомные спирты Общая формула 2) CnH2n 3) CnH2nО 2) CnH2n Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 12, 41, 59 Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 57 5) CnH2n+2О Приведем в соответствие левый и правый столбцы и получим: А2Б3В2Г5 Ответ: А2Б3В2Г5 РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии 19 Раздел программы вступительных испытаний. Элемент содержания Органическая химия. Изопрен как представитель диеновых углеводородов. Особенности строения. Химические свойства. Применение Содержание задания. Ответ В2. Выберите четыре утверждения, верно характеризующие изопрен. 1 является изомером пентина-1 2 имеет структурную формулу 3 4 качественный состав молекулы – углерод, водород и кислород вступает в реакции присоединения 5 в молекуле имеется одна π-связь 6 является мономером для натурального каучука Комментарий и решение задания Изопрен имеет молекулярную формулу С5Н8, его структурная формула: . Пентин-1 имеет такой же качественный и количественный состав, поэтому является изомером изопрена. Наличие двух π-связей в молекуле изопрена способствует протеканию реакций присоединения. Изопрен является мономером натурального каучука. Значит, верными являются утверждения 1, 2, 4, 6 Учебное издание Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 14 Ответ запишите цифрами (порядок записи цифр не имеет значения), например: 2456. Ответ: 1246 Органическая химия. Вычисление по химическим уравнениям массы полученного вещества по известной массе вступившего в реакцию вещества В3. Из карбида кальция массой 50,24 г получили альдегид НО Н О / Нg2 , Н по схеме СаС 2 ···2 . Образовавшийся 2 альдегид при нагревании окислили избытком аммиачного раствора оксида серебра(I). При этом практический выход на каждой стадии составил 70 %. Осадок отделили, высушили и взвесили. Вычислите массу (г) полученного осадка. Ответ: 58 1) Определим количество карбида кальция, израсходованного на протекание реакций: 50, 24 г n(СaC ) 0,785 моль. 2 64 г/моль 2) Составим уравнения реакций получения альдегида и найдем его количество: СаС2 + 2Н2О = С22 Н2 + Са(ОН)2; Нg , Н С Н + Н О СН СНО 2 2 2 3 n(СаС2) = n(С2H2) = n(СН3CHO) = 0,785 моль. 3) Составим схему реакции окисления альдегида аммиачным раствором оксида серебра(I) и вычислим массу полученного серебра: 0,785 моль хг NH / H О 3 2 СН3СНО + Ag2O СН3СОOH + 2Ag↓ 1 моль 2 моль· 108 г/моль х = 169,56; mтеорет(Ag) = 169,56 г; mпракт(Ag) = mтеорет(Ag) · η1 · η2 · η3; mпракт(Ag) = 169,56 г · 0,7 · 0,7 · 0,7 = 58 г РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 40; Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 15– 16 20 Раздел программы вступительных испытаний. Элемент содержания Органическая химия. Вывод формул органических веществ по общей формуле, отражающей их состав Органическая химия. Взаимосвязь между важнейшими классами органических соединений Содержание задания. Ответ Комментарий и решение задания Учебное издание В4. Некоторый пептид массой 77 г под действием фермента прореагировал с водой массой 12 г. При этом единственным продуктом реакции является аланин. Определите молярную массу (г/моль) пептида. 1) Рассчитаем количества прореагировавшей образовавшейся аминокислоты: 12 г n(H O) 0,667 моль; 2 18 г/моль Ответ: 231 m(аланина) 77 г + 12 г = 89 г; М аланина = 89 г/моль; 89 г n(аланина) 1 моль. 89 г/моль 2) Составим уравнение реакции и найдем число структурных звеньев в пептиде: 0,667 моль 1 моль Н–(– nNH2 СН(СН3)COOH NНСН(СН3)СОО–)n–OН + (n–1)H2O (n–1) моль n моль n = 3. 3) Определим молярную массу пептида: 1 1 n(пептида) n(аланина) моль; 3 3 m(пептида) 77 г М пептида = = 231 г/моль n(пептида) 1 /3 1) Запишем уравнения (схемы) протекающих реакций: H2SO4 (конц), t С Н + HNO С 6Н 5NO 2 (X 2) + H 2O (X 1); 6 6 3 H, t НCOOCH3 + H2O CН3ОН + НCOOH; CН3ОН + HI CН3I (A) + H2O; Fe/HCl (изб) С Н NO С Н NH Cl + H O; В5. Определите сумму молярных масс (г/моль) органических веществ А (НЕ изменяет окраску лакмуса) и Б, полученных в результате следующих превращений (Х 1 – НЕорганический продукт реакции): HCOOCH3 / H, t HI X1 … бензол (изб) HNO3 / H2SO4 (конц), А 6 AgF (р-р) Fe/HCl (изб) X2 … Б. 5 2 6 5 3 2 воды С6Н5NH3Cl + AgF = С6Н5NH3F (Б) + AgCl↓. 2) Найдем сумму молярных масс органических веществ А (М(CН3I) = 142 г/моль) и Б (М(С6Н5NH3F) = 113 г/моль): 142 + 113 = 255 и Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 53, 55 Химия : учеб. для 11-го кл. учреждений общ. сред. образования с рус. яз. обучения / А. П. Ельницкий, Е. И. Шарапа. – Минск : Нар. асвета, 2013. – § 17, 23, 40, 52 Ответ: 255 РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии 21 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Взаимосвязь между основными классами неорганических веществ на примере соединений алюминия Содержание задания. Ответ Комментарий и решение задания В6. Дана схема превращений, в которой каждая реакция обозначена буквой (А – Г): А Al Б В K3[Al(OH)6] Al(NO3)3 Г Al(OH)3 Ca(AlO2)2. Для осуществления превращений выберите четыре реагента из предложенных (электролиты взяты в виде разбавленных водных растворов): 1) H2O; 2) AgNO3; 3) KOH; 4) KI; 5) CaCO3; 6) HNO3; 7) CaSiO3. Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв, например: А1Б1В5Г2. Составим уравнения химических реакций в соответствии со схемой превращений: 2Al + 6KОН + 6H2O = 2K3[Al(OH)6] + 3H2↑, реагент А – KОН (3); K3[Al(OH)6] + 6HNO3 = 3KNO3 + Al(NO3)3 + 6H2O, реагент Б – HNO3 (6); Al(NO3)3+ 3KОН = Al(OH)3↓ + 3KNO3, реагент В – KОН (3). t 2Al(ОН)3 + CaCO3 Ca(AlO2)2 + 3H2O + СО2↑, реагент Г – CaCO3 (5). Приведем в соответствие превращения и реагенты и получим: А3Б6В3Г5 Учебное издание Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 33, 54 Ответ: А3Б6В3Г5 РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии 22 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Определение неорганических веществ с помощью качественных реакций Содержание задания. Ответ Комментарий и решение задания В7. Установите соответствие между парой веществ и реактивом, с помощью которого можно определить каждое вещество пары. Все реакции протекают в разбавленном водном растворе. А) (CH3COO)2Ba и Sr(NO3)2 Б) KBr и NaI В) Zn(NO3)2 и (CH3COO)2Cu Г) NH4F и K3PO4 1) NaOH 2) CaСl2 3) AgNO3 4) H2SO4 Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б2В3Г4. Ответ: А4Б3В1Г2 Неорганическая химия. Характеристика кремния как химического элемента и простого вещества В8. Выберите четыре утверждения, верно характеризующие кремний. 1 имеет молекулярное строение 2 входит в состав кварца 3 4 с углеродом при высоких температурах образует карборунд может проявлять степень окисления –4 5 в реакциях с металлами образует карбиды 6 является полупроводником А) Поскольку качественным реактивом на катионы Ва2+ и Sr2+ являются сульфат-ионы SO2 , для определения веществ (CH3COO)2Ba и 4 Sr(NO3)2 можно использовать H2SO4 (4). Уравнения реакций: (CH3COO)2Вa + H2SO4 = 2CH3COOH + ВaSO4↓; Sr(NO3)2 + H2SO4 = 2HNO3 + SrSO4↓. Б) Реактивом, определяющим галогенид-ионы (кроме F–), является раствор AgNO3 (3). Уравнения реакций: KBr + AgNO3 = KNO3 + AgBr↓; NaI + AgNO3 = NaNO3 + AgI↓. В) Zn(NO3)2 и (CH3COO)2Cu можно идентифицировать с помощью NaOH (1), с которым каждая из солей образует нерастворимое основание: Zn(NO3)2 (изб) + 2NaOH = 2NaNO3 + Zn(OH)2↓; (CH3COO)2Cu + 2NaOH = 2CH3COONa + Cu(OH)2↓. Г) Для качественного определения NH4F и K3PO4 наиболее подходящим реагентом является CaСl2 (2), так как с обоими веществами образуются труднорастворимые в воде соли (см. таблицу растворимости солей, оснований и кислот). Уравнения реакций: 2K3PO4 + 3CaСl2 = 6KCl + Сa3(PO4)2↓; 2NH4F + CaСl2 = 2NH4Cl + CaF2↓. Приведем в соответствие левый и правый столбцы таблицы и получим: А4Б3В1Г2 Простое вещество кремний имеет немолекулярное строение. Обладает полупроводниковыми свойствами. С активными металлами образует бинарные соединения – силициды, например, Mg2Si, в котором степень окисления кремния –4. C углеродом при высоких температурах образует карборунд SiС . Входит в состав кварца, формула которого SiО2. Таким образом, к утверждениям, верно характеризующим кремний, относятся 2, 3, 4, 6 Учебное издание Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 2, 33, 37, 39 Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 46 Ответ запишите цифрами (порядок записи цифр не имеет значения), например: 1356. Ответ: 2346 РТ–2019/2020 гг. Этап I. Вариант 2 Тематическое консультирование по химии 23 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Установление эмпирической и молекулярной (истинной) формул по массовым долям химических элементов, входящих в состав вещества Неорганическая химия. Массовая доля масса растворенного вещества. Растворимость и Содержание задания. Ответ В9. При недостатке марганца в почве количество сахарозы в сахарной свекле уменьшается. Для восполнения дефицита марганца используют кристаллогидрат соли, в котором: w(Mn) = 19,856 %; w(S) = 11,552 %; w(O) = 63,538 %; w(H) = 5,054 %. Вычислите массу (кг) безводной соли марганца, необходимой для подкормки свеклы на участке площадью 10 га, из расчета 2,56 кг марганца на 1 га. Ответ: 70 В10. Массовая доля сульфата железа(II) в насыщенном при 60 оС растворе равна 35,5 %. Насыщенный при 60 оС раствор сульфата железа(II) массой 80 г охладили до 0 оС. При этом из раствора выпал осадок железного купороса (FeSO4 · 7H2O) массой 42,5 г. Рассчитайте растворимость (г на 100 г воды) сульфата железа(II) при 0 оС. Ответ: 16 РТ–2019/2020 гг. Этап I. Вариант 2 Комментарий и решение задания Учебное издание 1) Определим формулу соли: n(Mn) : n(S) : n(O) : n(Н) 19,858 11, 552 63, 538 5, 054 : 55 : 32 : 16 1 ; n(Mn) : n(S) : n(O) : n(Н) 0,361: 0,361: 3,971: 5,054 1:1:11:14. Формула кристаллогидрата – MnSO4 · 7H2O, формула безводной соли – MnSO4. 2) Вычислим массу безводной соли марганца, необходимой для подкормки свеклы на участке площадью 10 га из расчета 2,56 кг марганца на 1 га: m(Mn) = 2,56 кг/га · 10 га = 25,6 кг; Mr(MnSO4) = 55 + 32 + 64 = 151; 151 кг MnSO4 ––––––––––––––––––– 55 кг Mn х кг MnSO4 ––––––––––––––––––––– 25,6 кг Mn х = 70, m(MnSO4) = 70 кг Растворимость – масса вещества, приходящаяся на 100 г воды в насыщенном при данной температуре растворе. 1) Найдем массу соли в насыщенном при 60 оС растворе: m60 (FeSO4) = m60 (р-ра)· w(FeSO4); m60 (FeSO4) = 80 г · 0,355 = 28,4 г. 2) Вычислим массу FeSO4 в составе кристаллогидрата FeSO4 · 7H2O, образовавшего осадок при охлаждении раствора сульфата железа(II) от 60 оС до 0 оС: M(FeSO4) = 152 г/моль, M(FeSO4 · 7H2O) = 152 + 126 = 278 г/моль 278 г FeSO4 · 7H2O –––––––––––– 152 г FeSO4 42,5 г –––––––––––– х г х = 23,237, m(FeSO4) = 23,237 г. 3) Определим массы соли и воды в насыщенном при 0 оС растворе: m0 (FeSO4) = m60 (FeSO4) – m в кр-те (FeSO4); m0 (FeSO4) = 28,4 г – 23,237 г = 5,163 г; m0 (Н2O) = 80 г – 42,5 г – 5,163 г = 32,337 г. 4) Рассчитаем растворимость сульфата железа(II) при 0 оС: в воде массой 32,337 г растворяется 5,163 г FeSO4 в воде массой 100 г растворяется х г FeSO4 х ≈ 16. Значит, растворимость сульфата железа(II) в 100 г воды при 0 оС составляет 16 г Тематическое консультирование по химии Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 7 Химия : учеб. для 8-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович, Е. И. Василевская, О. И. Сечко ; под ред. И. Е. Шимановича. – Минск : Нар. асвета, 2011. – § 26, 34; Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 30– 31 24 Раздел программы вступительных испытаний. Элемент содержания Неорганическая химия. Расчет объемных отношений газообразных веществ Неорганическая химия. Расчеты по химическим уравнениям, если одно из реагирующих веществ взято в избытке Содержание задания. Ответ В11. В герметичном сосуде, заполненном воздухом (объемная доля кислорода 21 %), полностью сожгли кусочек угля. В результате молярная масса газовой смеси в сосуде выросла до 29,84 г/моль. Вычислите объемную долю (%) кислорода в образовавшейся газовой смеси. Ответ: 14 В12. Самый легкоплавкий сплав (tпл = –78 ºС) массой 80 г, состоящий из натрия, калия и цезия, растворили в бромоводородной кислоте массой 900 г (массовая доля бромоводорода 18 %). После окончания реакции образовавшийся раствор выпарили. Масса твердого остатка составила 170 г. Вычислите объем (н. у.) водорода (дм3), выделившегося в результате растворения сплава. Ответ: 13 РТ–2019/2020 гг. Этап I. Вариант 2 Комментарий и решение задания 1) Пусть исходное количество воздуха, заполняющего закрытый сосуд, составляет 1 моль, количество кислорода в нем – 0,21 моль. Так как молярная масса воздуха 29 г/моль, значит, 1 моль воздуха имеет массу 29 г. Количество полученной газовой смеси также 1 моль, потому что в результате реакции С + О2 = СО2 количество газов не изменилось (n(О2) = n(СО2)). Увеличение массы газовой смеси на 0,84 г (29,84 – 29) произошло за счет углерода, входящего в состав угля. 2) Согласно уравнению n(О2) = n(С). Вычислим количество кислорода, израсходованного на сгорание угля: n(С) = m(С) / M(С) = 0,84 г / 12 г/моль = 0,07 моль; n(О2) = 0,07 моль. 3) Поскольку для газов объемные и мольные доли совпадают, определим объемную долю кислорода, оставшегося в сосуде: n(О2) = nисх(О2) – nизр(О2) = 0,21 моль – 0,07 моль = 0,14 моль; в смеси газов количеством 1 моль мольная доля кислорода равна: 0,14 моль 0,14, или 14 % 1 моль 1) Определим количество бромоводорода в растворе: m(р-ра) w 900 г 0,18 n(в-ва) , n(HBr) 2 моль. M (в-ва) 81 г/моль 2) Обозначив металлы как Ме, составим уравнение реакции между сплавом и бромоводородной кислотой и определим вещество, взятое в избытке. 2Ме + 2НBr = 2МеBr + Н2. Если бы весь НBr вступил в реакцию, то бром (Br –) массой 160 г (2 моль · 80 г/моль) полностью перешел бы в состав твердого остатка МеBr. Однако масса твердого остатка увеличилась на 90 г (170 – 80), значит, НBr в избытке. В реакцию вступил бром количеством, равным: n(Br–) = 90 г / 80 г/моль = 1,125 моль. 3) Вычислим объем выделившегося водорода: n(Н2) = n(Br–) / 2, n(Н2) = 1,125 моль / 2 = 0,563 моль; V = n · Vm, Vm = 22,4 дм3/моль; V(H2) = 0,563 моль · 22,4 дм3/моль = 12,6 ≈ 13 дм3 Тематическое консультирование по химии Учебное издание Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 8– 10 Химия : учеб. для 8-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович, Е. И. Василевская, О. И. Сечко ; под ред. И. Е. Шимановича. – Минск : Нар. асвета, 2011. – § 28, 34; Химия : учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И. Е. Шиманович [и др.] ; под ред. И. Е. Шимановича. – Минск : Адукацыя і выхаванне, 2013. – § 8–9, 31, 53 25