2. Распределение учебных занятий по семестрам
advertisement
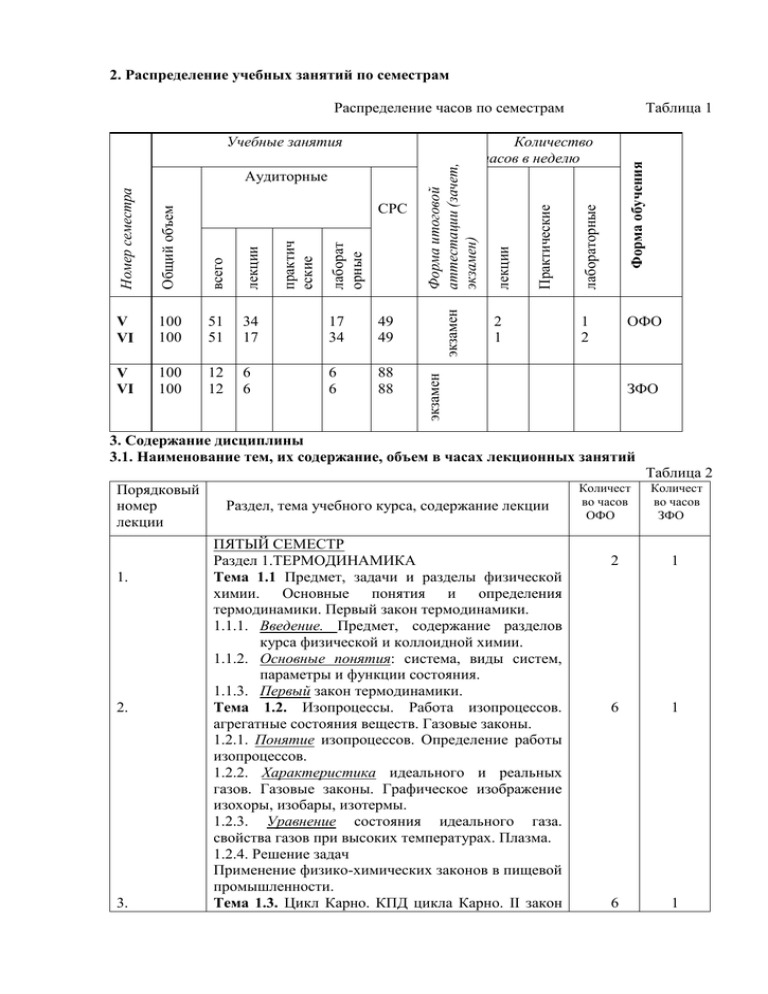
2. Распределение учебных занятий по семестрам Распределение часов по семестрам 49 49 V VI 100 100 12 12 6 6 6 6 88 88 2 1 лаборат орные практич еские Форма обучения 17 34 лабораторные 34 17 Практические лекции 51 51 лекции всего 100 100 экзамен Общий объем V VI СРС Количество часов в неделю ОФО 1 2 экзамен Номер семестра Аудиторные Форма итоговой аттестации (зачет, экзамен) Учебные занятия Таблица 1 ЗФО 3. Содержание дисциплины 3.1. Наименование тем, их содержание, объем в часах лекционных занятий Таблица 2 Порядковый номер лекции 1. 2. 3. Раздел, тема учебного курса, содержание лекции ПЯТЫЙ СЕМЕСТР Раздел 1.ТЕРМОДИНАМИКА Тема 1.1 Предмет, задачи и разделы физической химии. Основные понятия и определения термодинамики. Первый закон термодинамики. 1.1.1. Введение. Предмет, содержание разделов курса физической и коллоидной химии. 1.1.2. Основные понятия: система, виды систем, параметры и функции состояния. 1.1.3. Первый закон термодинамики. Тема 1.2. Изопроцессы. Работа изопроцессов. агрегатные состояния веществ. Газовые законы. 1.2.1. Понятие изопроцессов. Определение работы изопроцессов. 1.2.2. Характеристика идеального и реальных газов. Газовые законы. Графическое изображение изохоры, изобары, изотермы. 1.2.3. Уравнение состояния идеального газа. свойства газов при высоких температурах. Плазма. 1.2.4. Решение задач Применение физико-химических законов в пищевой промышленности. Тема 1.3. Цикл Карно. КПД цикла Карно. II закон Количест во часов ОФО Количест во часов ЗФО 2 1 6 1 6 1 4. 5. 6. 7. термодинамики. Энтропия. Закон Больцмана. 1.3.1. Этапы цикла Карно. Определение работы каждого из четырех этапов. (II закон термодинамики). 1.3.2. Определение эффективности работы паровых машин, работающих на водяном и ртутном паре. 1.3.3. Понятие энтропии. Статистический смысл II закона термодинамики (закон Больцмана). 1.3.4. решение задач Тема 1.4. Закон Гесса и его следствия. Энтальпия 1.4.1. Тепловой эффект химической реакции. Следствия закона Гесса (закон Лавуазье-Лапласа). 1.4.2. Расчет тепловых эффектов химических процессов. 1.4.3. Зависимость тепловых эффектов от температуры. 1.4.4. Химический потенциал. 1.4.5. решение задач Раздел 2. КИНЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ Тема 1.5. Закон действующих масс. Химическое равновесие. 1.5.1. Обратимые реакции. Закон действующих масс. 1.5.2. Определение скорости химической реакции 1.5.3. Гомогенное, гетерогенное равновесие (принцип Ле Шателье). 1.5.4. Правило фаз. 1.5.5. Понятия фаза, компонент, вариантность системы, число степеней свободы. 1.5.6. Диаграммы состояния воды и серы. 1.5.7. решение задач Раздел 3. МОЛЕКУЛЯРНЫЕ РАСТВОРЫ Тема 1.6. Идеальные и реальные растворы. Свойства разбавленных растворов. 1.6.1. Термодинамика идеальных и реальных растворов. Закон Рауля для растворов неэлектролитов. 1.6.2. I и II законы Коновалова. Осмос закон ВантГоффа. 1.6.3. Диаграммы Рпара – состав, Ткип – состав. Отклонения свойств растворов от законов Рауля и Вант Гоффа. 1.6.4. Понижение температуры замерзания, повышение температуры кипения разбавленных растворов. Криоскопия, эбуллиоскопия. ШЕСТОЙ СЕМЕСТР Раздел 4. РАСТВОРЫ ЭЛЕКТРОЛИТОВ Тема 1.7. Растворы электролитов. 1.7.1. Растворы электролитов. Изотонический коэффициент. Физико-химические свойства 6 6 1 1 8 1 4 1 8. 9. 10. 11. растворов и технология. 1.7.2. Основы теории электролитической диссоциации. Слабые и сильные электролиты. 1. 7.3. Отклонения от законов Вант-Гоффа и Рауля в растворах электролитов. 1.7.4. Электропроводность растворов. Удельная электропроводность. 1.7.5. Эквивалентная электропроводность. 1.7.6. Практическое применение электропроводности в технике и технологии. 1.7.7. решение задач Раздел 5. ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ Тема 1.8. Электродные процессы. Гальванические элементы. 1.8.1 Гальванический элемент и электролизер. 1.8.2. Равновесные электродные потенциалы. Двойной электрический слой. 1.8.3. Классификация электродов и электрохимических цепей. 1.8.4.. Электролиз. I и II законы Фарадея. 1.8.5. решение задач Раздел 6. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ Тема 1.9. Обшая характеристика дисперсных систем. Методы получения дисперсных систем. 1.9.1. Характеристика дисперсных систем. Классификация дисперсных систем по межфазному взаимодействию, дисперсности, по агрегатному состоянию дисперсной фазы и дисперсионной среде. 1.9.2. Методы получения дисперсных систем. Тема 2. Общие понятия о коагуляции и седиментации дисперсных систем. Устойчивость дисперсных систем. 2.1. Коагуляция коллоидных растворов электролитами. 2.2. Понятие кинетической и агрегативной устойчивости. Тема 2.1. Оптические явления в дисперсных системах. 2.1.1. Рассеяние, поглощение света в коллоидных системах. Эффект Тиндаля. Закон Бугера Ламберта – Бера. 2.1.2. Ультра – и электронная микроскопия, нефелометрия их значение для изучения коллоидных систем. Практическая роль в специальности. 3 4 1 2 2 4 1 1 3.2 Практические (семинарские) занятия, их наименование, содержание и объем в часах Семинарские занятия учебным планом не предусмотрены. 3.3 Лабораторные занятия, их наименование и объем в часах Номер лабор. работы 1 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. Наименование лабораторной работы 2 Пятый семестр Гомогенное, гетерогенное равновесие Раздел, тема Объем лекционного часов курса ОФО 3 4 Раздел тема 1.5 Определение порядка реакции методом Раздел начальных концентраций тема 1.5 Перегонка растворов из неограниченно Раздел смешивающихся жидкостей тема 1.6 Определение константы скорости Раздел химических реакций тема 1.5 Шестой семестр Ознакомление с рефрактометрическим Раздел методом установления строения молекул и тема 1.5 определения количественного состава смеси Электролиз Раздел тема 1.8 Вязкость Раздел тема 1.5 Электропроводность Раздел тема 1.7 Дисперсные и коллоидные системы. Раздел Коллоидные растворы. тема 1.9.1 Поверхностные явления. Адсорбция Раздел тема 1.9 Таблица 3 Объем часов ЗФО 1, 4 2 1, 4 2 3, 5 2, 4 6, 4 2 5, 2 6, 8 4, 8 2 6, 8 2 6, 6 3.4 Содержание и объем самостоятельной работы студентов Таблица 4 Разделы и темы рабочей программы самостоя тельного изучения 1 Перечень домашних заданий и других вопросов для самостоятельного изучения Сроки Объем выпол часов ОФО нения Раздел тема1.1 2 3 Пятый семестр 1, Предмет, задачи и разделы физической Сентя химии. Основные понятия и определения брь термодинамики. Первый закон термодинамики. Раздел тема1.2 1, Изопроцессы. Работа изопроцессов. Сентя агрегатные состояния веществ. Газовые брь Объем часов ЗФО 4 8 16 8 14 законы. Раздел тема1.3 Раздел тема1.4 Раздел тема1.5 Раздел тема1.6 Раздел тема1.7 Раздел тема1.8 1, Цикл Карно. КПД цикла Карно. II закон Октяб 8 термодинамики. Энтропия. Закон рь Больцмана. 1, Закон Гесса и его следствия. Энтальпия Октяб 10 рь 2, Закон действующих масс. Химическое ноябр 8 равновесие. ь 3, Идеальные и реальные растворы. Свойства декаб 7 разбавленных растворов. рь Шестой семестр 3, Растворы электролитов. февра 10 ль 5, Электродные процессы. Гальванические февра 10 элементы. ль Раздел 6, Поверхностные явления. тема 1.9 Раздел 6, Общие понятия о коагуляции и тема 2.1 седиментации дисперсных систем. Устойчивость дисперсных систем. Раздел 6, Оптические явления в дисперсных тема 2.1 системах. 16 4 4 8 30 20 март 12 20 март 5 20 Апре ль 12 24 3.5 курсовой проект (работа), его характеристика и трудоемкость, примерная тематика Курсовой проект учебным планом не предусмотрен. 4.учебно-методические материалы по дисциплине 4.1 Основная и дополнительная литература Основная литература 1. Физическая и коллоидная химия : учебник для студентов вузов / [А.П. Беляев и др.] ; под ред. А.П. Беляева. - М. : ГЭОТАР-Медиа, 2010. - 704 с. 2. Мягченков, В.А. Поверхностные явления и дисперсные системы : учеб. пособие для студентов вузов / В.А. Мягченков. - М. : КолосС, 2007. - 187 с. Дополнительная литература 1. Семенов, Н.Н. Избранные труды. В 4 т. Т. 2 : Горение и взрыв / Н.Н. Семенов. - М. : Наука, 2005. - 704 с. 2. Семенов, Н.Н. Избранные труды. В 4 т. Т. 1. Кн. 1 : Цепные реакции / Н.Н. Семенов. - М. : Наука, 2004. - 392 с. 5. Вопросов к экзамену 1. Предмет, задачи и разделы физической химии. 2. Основные понятия и определения термодинамики: термодинамическая система, виды систем, состояние системы, параметры, уравнения состояния, функции состояния. 3. I закон термодинамики. 4. Теплоемкость Сv и Сp. Калорические коэффициенты. 5. Изопроцессы. Законы идеальных газов. Работа изопроцессов. 6. Цикл Карно. КПД цикла Карно. Теоремы Карно-Клаузиуса. Основные законы термохимии: Закон Гесса и его следствия. Закон ЛавуазьеЛапласа. 9. Теплоты реакций Qp и Qv. 10. Стандартная энтальпия образования вещества. Закон Кирхгофа. 11. Второе начало термодинамики. 12. Энтропия. Физический смысл. Постулат Планка. 13. Методы вычисления энтропии в равновесных системах: 14. Статистический характер энтропии. Уравнение Больцмана. 15. Термодинамические потенциалы Гиббса и Гельмгольца. 16. Понятие равновесия. Смещение равновесия. Принцип Ле Шателье –Брауна. 17. Фазовые переходы I и I I рода. 18. Уравнение Клапейрона – Клаузиуса. 19. Константа равновесия. Реакция Бекетова. 20. Химический потенциал. Условия равновесия. 21. Химическая переменная. 22. Гетерогенное равновесие. Правило фаз Гиббса. Компоненты и независимые составляющие систем. 23. Диаграммы состояния веществ и правило фаз (вещества типа воды и типа серы). 24. Термодинамический вывод закона действующих масс. 25. Растворы. Идеальные и реальные растворы. 26. Растворимость газов в газах. 27. Растворимость жидкостей в жидкостях. 28. Давление насыщенного пара над растворами. Закон Рауля. Закон Рауля-Генри. 29. Диаграммы Pпара состав,tкип. Состав. 30. I закон Коновалова, I I закон Коновалова. 31. Отклонения от закона Рауля. Положительные и отрицательные отклонения от закона Рауля. Примеры систем. 32. Следствия закона Рауля. Эбулиоскопия и криоскопия. 33. Осмотическое давление в растворах. Закон Вант- Гоффа. 34. Отклонение свойств растворов электролитов от законов Рауля и Вант-Гоффа. 35. Теории электролитической диссоциации. 36. Изотонический коэффициент, степень диссоциации. 37. Электропроводность. 38. Подвижность ионов. Закон Кольрауша. 39. Классификация дисперсных систем. 40. Состав мицеллы. 41. Методы получения дисперсных систем. 42. Кинетика коагуляции. Коагуляция коллоидных растворов электролитами. 43. Дисперсный анализ. Оптические и молекулярно- кинетические свойства дисперсных систем. 44. Характеристика дисперсной фазы: численная, объемная и массовая концентрации. 45. Кинетическая и агрегативная устойчивость. 7. 8.



