ЛСМ -неорганикаx
advertisement
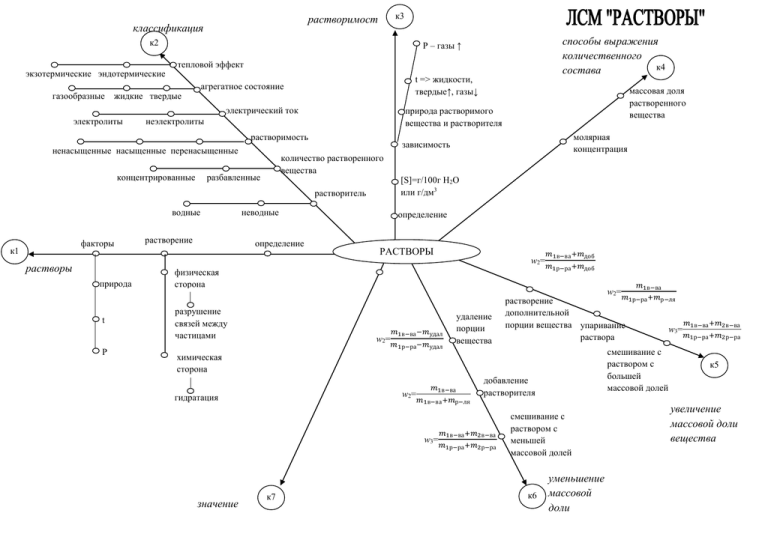
к2 1 экзотермические эндотермические газообразные к3 растворимост ь классификация 1 тепловой эффект t => жидкости, твердые↑, газы↓ агрегатное состояние жидкие твердые электрический ток электролиты ненасыщенные насыщенные перенасыщенные концентрированные растворитель водные факторы растворение неводные определение молярная концентрация зависимость количество растворенного вещества разбавленные массовая доля растворенного вещества природа растворимого вещества и растворителя неэлектролиты растворимость к1 способы выражения количественного к4 состава 1 Р – газы ↑ [S]=г/100г Н2О или г/дм3 определение РАСТВОРЫ w2= 1 растворы природа t P физическая сторона 𝑚1в−ва +𝑚доб 𝑚1р−ра +𝑚доб w2= разрушение связей между частицами w2= 𝑚1в−ва −𝑚удал 𝑚1р−ра −𝑚удал удаление порции вещества растворение дополнительной порции вещества упаривание раствора смешивание с раствором с большей массовой долей химическая сторона w2= гидратация 𝑚1в−ва 𝑚1в−ва +𝑚р−ля w3= значение добавление растворителя 𝑚1в−ва +𝑚2в−ва 𝑚1р−ра +𝑚2р−ра 𝑚1в−ва 𝑚1р−ра +𝑚р−ля смешивание с раствором с меньшей массовой долей к7 к6 1 1 уменьшение массовой доли вещества w3= 𝑚1в−ва +𝑚2в−ва 𝑚1р−ра +𝑚2р−ра к5 1 увеличение массовой доли вещества классификация по природе лигандов классификация по знаку электрического заряда к2 1 хелатные к3 1 номенклатура нейтральные к4 1 ацидокомплексы (n+L+Me)-название катионно-анионные гидрокомплексы амминкомплексы (аммиакаты) анионные [Me(L0)n1(L-)n2] аквакомплексы катионные к1 внешняя сфера 1 строение кардинационное комплексочисло лиганды образователь определение первичная (по типу сильных электролитов) КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ внутренняя сфера вторичная (диссоциация комплексного иона) диссоциация обменные реакции термическое разложение СМС витамины чистота получения Ме окислительнок5 восстановительные 1 реакции аналитическая химия в живых организмах – обмен веществ значение химические свойства пищевая промышленность ферменты медицина хлорофилл кислоты гемоглобин к7 к6 1 1 применение к2 1 физические свойства HNO3 химические свойства к3 HNO3 1 желтоватый цвет +белок→денатурация разлагается на свету обугливание органических веществ +Ме кроме Au, Pt, Pd жидкость с запахом разложение общие к1 N - IV N+5 формула NH4NO2→N2+2H2O левее 𝑀𝑔 АЗОТНАЯ КИСЛОТА И ЕЕ СОЛИ 1 строение HNO3 NH4NO3→N2O+2H2O → 𝑀𝑔 − 𝐶𝑢 Me(NO3)n→ → правее 𝐶𝑢 общие красители → лекарства фотопленка минеральные удобрения Me+NO2+O2 к4 в лаборатории 1 химические свойства нитратов вытеснением из солей H2SO4(конц) в промышленности N2→NH3→NO→NO2→HNO3 химические реактивы применение HNO3 MeO+NO2+O2 разложение взрывчатые вещества целлулоид Me(NO2)n+O2 к6 к5 1 1 получение HNO3 к3 молярный объем газов закон Авогадро к2 1 (следствие I закона Авогадро) 1 n= 𝑉 𝑉𝑚 1811 – Амадео Авогадро к4 Vm=22,4дм3моль 1 закон объемных отношений определение 1807 Гей-Люсак определение к1 1 газовые законы молярный объем газов закон Авогадро закон объемных отношений определение объединенный газовый закон ГАЗОВЫЕ ЗАКОНЫ И ПОНЯТИЯ относительная плотность газов закон БойляМариотта определение закон ГейЛюсака 𝑉 𝑇 закон Шарля 𝑝 𝑇 объединенный газовый закон 𝑝𝑉 𝑇 закон МенделееваКлапейрона объединенный газовый закон pV=const =const =const Дв= 𝑚(𝐴) 𝑚(𝐵) const=R 𝑚 pV= RT 𝑀 Дв= 𝑀(𝐴) 𝑀(𝐵) относительная плотность газов (следствие II закона Авогадро) к5 к6 1 1









![L 9 25 9 25 M U (VI) La (III) [HNO3], 0.77 M 0.03 0.10](http://s1.studylib.ru/store/data/002397862_1-60371852a55d648a7143d18544a1b0ab-300x300.png)









