Химия - Школа №53
advertisement
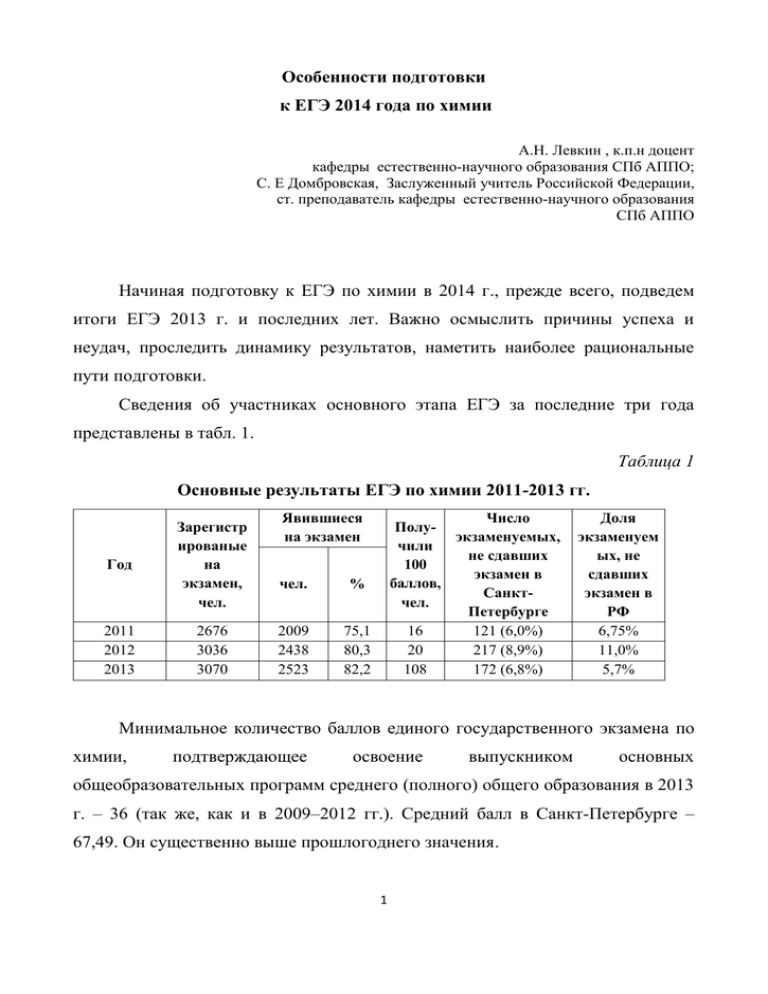
Особенности подготовки к ЕГЭ 2014 года по химии А.Н. Левкин , к.п.н доцент кафедры естественно-научного образования СПб АППО; С. Е Домбровская, Заслуженный учитель Российской Федерации, ст. преподаватель кафедры естественно-научного образования СПб АППО Начиная подготовку к ЕГЭ по химии в 2014 г., прежде всего, подведем итоги ЕГЭ 2013 г. и последних лет. Важно осмыслить причины успеха и неудач, проследить динамику результатов, наметить наиболее рациональные пути подготовки. Сведения об участниках основного этапа ЕГЭ за последние три года представлены в табл. 1. Таблица 1 Основные результаты ЕГЭ по химии 2011-2013 гг. Год 2011 2012 2013 Зарегистр ированые на экзамен, чел. 2676 3036 3070 Явившиеся на экзамен чел. % 2009 2438 2523 75,1 80,3 82,2 Число Полуэкзаменуемых, чили не сдавших 100 экзамен в баллов, Санктчел. Петербурге 16 121 (6,0%) 20 217 (8,9%) 108 172 (6,8%) Доля экзаменуем ых, не сдавших экзамен в РФ 6,75% 11,0% 5,7% Минимальное количество баллов единого государственного экзамена по химии, подтверждающее освоение выпускником основных общеобразовательных программ среднего (полного) общего образования в 2013 г. – 36 (так же, как и в 2009–2012 гг.). Средний балл в Санкт-Петербурге – 67,49. Он существенно выше прошлогоднего значения. 1 Сравнение результатов основного этапа ЕГЭ по предмету в 2012 г. с результатами 2009–2011 гг. приведено в табл. 2. Таблица 2 Сравнительные результаты ЕГЭ по химии в 2009-2013 годах Год Средний балл Доля участников, не сдавших экзамен 2009 50,7 10,3% 2010 56,4 5,7% 2011 59,13 6,0% 2012 58,58 8,9% 2013 67,49 5,7% Доля учащихся, не преодолевших нижнюю границу, и, таким образом, не сдавших экзамен, существенно сократилось, как по стране в целом, так и в Санкт-Петербурге. Приятно отметить, что в Санкт-Петербурге растёт число учащихся, получивших за экзамен 100 баллов. В 2009 г. таких было всего 2 человека, в 2010 – 8 человек, а в 2011 г. – 16, в 2012 г. – 20 человек, а в 2013 г. – 108. Среди всех предметов, по которым сдавали ЕГЭ, химия оказалась на первом месте по числу экзаменуемых, набравших 100 баллов! Методические рекомендации учителям химии Анализ результатов ЕГЭ 2013 г. показал, что выпускники с различным уровнем подготовки продемонстрировали наиболее высокий уровень овладения учебным материалом в основном при выполнении заданий базового уровня сложности. В первую очередь это относится к заданиям по следующим разделам и темам курса химии средней школы: «Периодический закон и Периодическая система химических элементов Д.И. Менделеева», «Характерные химические свойства неорганических и органических веществ 2 различных классов», «Свойства спиртов, альдегидов, карбоновых кислот», «Химические производства». На основе анализа полученных данных можно отметить, что одной из актуальных задач должна стать организация целенаправленной работы по формированию умений выделять в условии задания главное, устанавливать причинно-следственные связи между отдельными элементами содержания, в особенности взаимосвязь состава, строения и свойств веществ. Повышению эффективности усвоения материала об отдельных химических элементах и их соединениях будет способствовать опора на теоретические знания. Прежде всего, следует постоянно обращать внимание учащихся на то, что характерные свойства каждого конкретного вещества и различных классов веществ в полной мере зависят от их состава и строения. Именно поэтому при выполнении заданий о свойствах веществ (классов веществ) в первую очередь необходимо использовать знания о видах химической связи и способах ее образования, об электроотрицательности и степени окисления химических элементов в соединениях, о зависимости свойств веществ от типа кристаллической решетки, о поведении веществ с различным видом связи в растворах. На основании результатов ЕГЭ 2013 г. следует сделать выводы о совершенствовании отдельных аспектов преподавания химии в школе. Важным основанием для совершенствования учебного процесса является анализ затруднений выпускников в освоении отдельных элементов содержания курса химии. Анализ этих затруднений позволит в рамках учебного процесса организовать подготовку к ЕГЭ по следующим направлениям: 1. Большое значение имеет организация целенаправленной работы по систематизации и обобщению учебного материала, которая должна быть направлена на развитие умений выделять в нем главное, устанавливать причинно-следственные связи между отдельными элементами содержания, обращая особое внимание на взаимосвязь состава, строения и свойств веществ. 3 2. Для успешного формирования важнейших теоретических понятий в учебном процессе целесообразно использовать различные по форме упражнения и задания на применение этих понятий в различных ситуациях. Необходимо также добиваться понимания учащимися того, что успешное выполнение любого задания предполагает тщательный анализ его условия и выбор адекватной последовательности действий. Организация работы по подготовке к единому государственному экзамену предполагает серьезное изучение таких документов, как кодификатор и спецификация. Кодификатор – специальный документ, который дает представление о содержательной основе контрольно-измерительных материалов по химии. Он представляет собой перечень основных элементов содержания, выносимых на проверку, а потому является для учителя ориентиром в период подготовки учащихся к единому государственному экзамену. Особенности экзаменационной работы находят свое отражение в спецификации и демоверсии. В спецификации подробно описана структура работы, а также типы заданий, система оценивания. В состав спецификации включен план экзаменационной работы с указанием соответствия всех заданий элементам содержания, предполагаемое время на выполнение каждого задания той или иной части экзаменационной работы. Так, на выполнение каждого задания части А предполагается до 2 мин, задания части В – до 5 мин, задания части С – до 10 мин. Таким образом, предполагаемое общее время на выполнение заданий базового уровня сложности (часть А) – 60 мин (что составляет 30% от общего времени, отводимого на выполнение экзаменационной работы), заданий повышенного уровня сложности – 50 мин (что составляет около 31% от общего времени, отводимого на выполнение экзаменационной работы), заданий высокого уровня сложности – 50 мин (что составляет около 31% от общего времени, отводимого на 4 выполнение экзаменационной работы). Учет времени позволит более эффективно организовать выпускнику свою деятельность непосредственно на экзамене. Демоверсия – это демонстрационный вариант КИМ, представляющий собой возможный вариант (образец) экзаменационной работы. Он содержит инструкцию по выполнению работы, дает примеры типов заданий, критериев оценивания ответов экзаменуемых. Руководствоваться следует также инструкциями, предлагаемыми в экзаменационной работе по выполнению работы в целом, ее частей и отдельных заданий. Следует обратить внимание учащихся на необходимость внимательного ознакомления с инструкциями в экзаменационной работе и строгого следования им, особенно по выполнению заданий части В. Ознакомиться с документами, регламентирующими разработку ЕГЭ по химии 2014г., можно на портале информационной поддержки проекта «Единый государственный экзамен» http://ege.edu.ru, а также на сайте Федерального института педагогических измерений http://www.fipi.ru. В процессе подготовки учащихся к экзамену по материалам ЕГЭ особое значение имеет ознакомление с типичными ошибками, которые были выявлены по результатам предыдущего года. Анализ этих ошибок позволит выпускникам и абитуриентам их избежать. ЕГЭ по химии – экзамен по выбору выпускников. И те учащиеся, которые выбирают этот экзамен, должны пройти соответствующую подготовку. Прежде всего, обращаем внимание на вопросы базового уровня (блок А). Ежегодно затруднения у выпускников вызывают вопросы по теме «Классы неорганических веществ». Рекомендуем вопросов использовать учителям при повторении данных обобщающие таблицы, которые помогут учащимся систематизировать знания по этой теме. Примеры таблиц приведены ниже. Таблица 3 Оксиды и гидроксиды, их характер, свойства 5 Название оксида Формула оксида Характер оксида Формула гидроксида Реакция с водой Реакция с гидроксидом натрия Реакция с серной кислотой Оксид серы (VI) Оксид хрома(II) Оксид хрома(III) Оксид хрома(VI) Оксид железа (III) Оксид азота (V) Оксид азота (III) Оксид азота (IV) Таблица 4 Составление солей различного состава Название соли Формула соли Формула кислоты, образующей соль Формула основания, образующего соль Гидрофосфат бария Дигидрофосфат кальция Карбонат гидроксомеди (II) Сульфат гидроксожелеза (III) Cульфид аммония Гидросульфид аммония Учитель может предложить учащимся составить формулы большего количества оксидов и солей разного состава (средние, кислые, основные, двойные и т.д.) Работа с таблицами позволит выпускникам приобрести необходимую для сдачи экзамена химическую грамотность, неформальные знания по теме «Классы неорганических веществ», а также избежать многих ошибок, отвечая на вопросы экзаменационной работы. 6 Особое внимание в ходе подготовки учащихся к ЕГЭ следует обратить на выполнение части С. Часть С включает задания высокого уровня сложности, который достигается путем комбинирования проверяемых элементов содержания и видов деятельности. В аналитических материалах уже рассмотрены ошибки, которые были допущены при выполнении заданий части С. Здесь же будут предложены некоторые задания, которые вызвали наибольшую степень трудности как у выпускников, так и у абитуриентов. Задания С1 направлены на проверку усвоения сущности окислительновосстановительных процессов. Например: используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель: 1) KMnO4 + MnSO4 + H2O → MnO2 + … + … 2) I2 + K2SO3 + ...→ K2SO4 + …+ H2O 3) KNO2 + ... + H2O → MnO2 + ... + KOH 4) Cr2O3+ ... + KOH → KNO2 + K2CrO4 + ... Традиционно большинство учащихся хорошо справляются с выполнением задания С1. Но некоторые выпускники указывают окислители и восстановители не под формулой вещества или химического элемента в определенной степени окисления, а после указания процессов. Отсюда у эксперта возникает вопрос: знает ли учащийся, что является окислителем, а что является восстановителем в процессе? Поэтому настоятельно рекомендуем указывать окислители и восстановители под формулами веществ в уравнении реакции или выписывать эти формулы отдельно. Часто учащиеся, составляя уравнение окислительно-восстановительной реакции, в качестве окислителя в щелочной среде предлагают кислоту. Например: Cr2O3+ HNO3 + KOH → KNO2 + K2CrO4 + H2O 7 Тем самым, допускается серьезная ошибка: кислота и щелочь вступят в реакцию нейтрализации и окислителем в данном случае выступит нитрат калия. Задания С2 и С3 экзаменационной работы направлены на проверку усвоения знаний о генетической взаимосвязи веществ и умений составлять уравнения соответствующих реакций. Эти задания предусматривают проверку пяти элементов содержания. Задания С2 и С3 – цепочки превращений с участием соответственно неорганических и органических веществ. Задание С2 было предложено в новой форме, т.е. учащиеся должны были составить уравнения реакций четырех последовательных превращений. Такая форма задания для большинства учащихся оказывается более легкой, т.к. в пособиях для подготовки к ЕГЭ составители предлагают школьникам очень большое количество заданий для тренировки. Анализ выполнения данного задания показывает, что учащиеся неплохо освоили темы «Химия бинарных соединений», «Взаимное усиление гидролиза», «Переход хроматов в дихроматы». Все эти темы изучаются только в профильных классах. Таблица 5 Варианты заданий С2 № Задание 1. Газ, полученный при обработке нитрида кальция водой, пропустили над раскалённым порошком оксида меди(II). Полученное при этом твёрдое вещество растворили в концентрированной азотной кислоте, раствор выпарили, а полученный твёрдый остаток прокалили. Составьте уравнения четырёх описанных реакций. 2. Некоторое количество сульфида железа(II) разделили на две части. Одну из них обработали соляной кислотой, а другую подвергли обжигу на воздухе. При взаимодействии выделившихся газов образовалось простое вещество жёлтого цвета. Полученное вещество нагрели с концентрированной азотной кислотой, при этом выделился бурый газ. Напишите уравнения четырёх описанных реакций. 3. Кремний сожгли в атмосфере хлора. Полученный хлорид обработали водой. 8 Выделившийся при этом осадок прокалили. Затем сплавили с фосфатом кальция и углём. Составьте уравнения четырёх описанных реакций. 4. При взаимодействии оксида алюминия с азотной кислотой образовалась соль. Соль высушили и прокалили. Образовавшийся при прокаливании твёрдый остаток подвергли электролизу в расплавленном криолите. Полученный при электролизе металл нагрели с концентрированным раствором, содержащим нитрат калия и гидроксид калия, при этом выделился газ с резким запахом. Напишите уравнения четырёх описанных реакций. Приятно отметить, что к заданию С3 приступают практически все учащиеся, составляют уравнения реакций с участием органических веществ, используя структурные формулы. Большинство учащихся обладают навыками расстановки коэффициентов в уравнениях окислительно-восстановительных реакций с участием перманганата калия и бихромата калия, что говорит об их достаточно серьезной подготовке к итоговой аттестации. Таблица 6 Варианты заданий С3 № Задание NH 3 (изб.) t Br2 ,свет 2 X3 CuO, CH3Br X2 HNO X1 o 1. →H2CO 2. 2 SO4 KMnO 4 , H X4 o o CH3CHCl2→CH3CHO NH 3 ,300 , кат. t H2 ,кат., X1 СО2 Н 2О t →C2H5NH2 X2 o 3. KOH спиртов., t o X1 С2H4Br2 →CH3COOH Н 2 О ,Hg 2 X3 2 SO4 4 , H X2 KMnO Br2 ,свет X3→ H2NCH2COOH 9 4. Пропанол-1 H 2 SO4 ( конц.), 180o Н 2 О ,Hg 2 X1 X2→пропин →X3 Br2 2 , кат. H X4 Тем не менее, опыт показывает, что многие экзаменуемые испытывают большие трудности при выполнении этих заданий. Для выполнения таких заданий надо хорошо изучить химические свойства и методы получения веществ тех классов, которые изучаются на уроках. Для успешного выполнения таких заданий следует работать над закреплением учебного материала по данным темам, выполнять большое количество заданий, выявляющих генетическую связь между классами неорганических веществ. Можно использовать приведенные ниже схемы. Учащиеся должны обладать прочными знаниями как осуществить превращения перечисленных ниже веществ. 10 11 Задания С4 и С5 – это задачи. На ЕГЭ допускается решение задач нестандартным способом. При этом необходимо руководствоваться общим подходом: последовательность решения может быть различной, однако решение должно содержать совокупность действий, обеспечивающих получение правильного ответа, а именно: составление уравнения (уравнений) химической реакции, необходимого для выполнения стехиометрических расчетов, составление алгебраического уравнения для нахождения ответов на поставленные в условии задачи вопросы, формулирование логически обоснованного ответа на поставленные вопросы. Приведем несколько примеров задач С4, которые можно использовать для подготовки к экзамену. 12 Таблица 7 № Задание 1. Нитрит натрия массой 13,8 г внесли при нагревании в 220 г раствора хлорида аммония с массовой долей 10%. Какой объем (н.у.) азота выделится при этом и какова массовая доля хлорида аммония в получившемся растворе? 2. Нитрит калия массой 8,5 г внесли при нагревании в 270 г раствора бромида аммония с массовой долей 12%. Какой объем (н.у.) азота выделится при этом и какова массовая доля бромида аммония в получившемся растворе? 3. В 120 мл раствора азотной кислоты с массовой долей 7% (плотностью 1,03 г/мл) внесли 12,8 г карбида кальция. Какой объем 20%-ной соляной кислоты (плотностью 1,10 г/мл) следует добавить к полученной смеси для ее полной нейтрализации? 4. Смешали 300 мл раствора серной кислоты с массовой долей 10% (плотностью 1,05 г/мл) и 200 мл раствора гидроксида калия с массовой долей 20% (плотностью 1,10 г/мл). Какой объем воды следует добавить к полученной смеси, чтобы массовая доля соли в ней составила 7%? При выполнении задачи С4 учащихся часто подводит знание, а точнее незнание химических свойств классов неорганических веществ. Часто встречается некорректная запись единиц измерения. Педагогам рекомендуется в ходе подготовки к ЕГЭ обратить на это особое внимание. Задания С5 – это задачи на установление молекулярной формулы вещества. Поэтому, к вышеуказанным действиям добавляются: написание общей формулы вещества или определенного класса соединений, расчет молярной массы по относительной плотности газа, нахождение простейшей формулы соединения. Учащиеся продемонстрировали знание общих формул классов органических соединений, умение рассчитывать молярную массу и выводить формулу органического вещества по общей формуле и молярной массе. Тем не менее, учащиеся не смогли избежать ошибок (как и в прошлом году) в составлении уравнений реакций химических 13 процессов с участием органических веществ при использовании общих формул. Это не позволило многим учащихся получить максимальный балл за выполнение данного задания. Таблица 8 Варианты заданий С5 № Задание 1. Установите молекулярную формулу диена, относительная плотность паров которого по воздуху 1,862. 2. При сгорании 0,45 г газообразного органического вещества выделилось 0,448 л (н.у.) углекислого газа, 0,63 г воды и 0,112 л (н.у.) азота. Плотность исходного газообразного вещества по азоту 1,607. Установите молекулярную формулу этого вещества. 3. При полном сгорании углеводорода образовалось 27 г воды и 33,6 л СО2 (н.у.). Относительная плотность углеводорода по аргону равна 1,05. Установите его молекулярную формулу. Приведем пример двух задач С5, которые можно использовать для подготовки к ЕГЭ. Задача 1. Порцию органического вещества массой 1,45 г обработали избытком аммиачного раствора оксида серебра (реактивом Толленса). В результате реакции образовалось серебро массой 5,4 г. Определите, какое органическое вещество соответствует условию задачи. Решение Вещество, о котором идет речь в условии задачи, является альдегидом. Именно альдегиды восстанавливают серебро из аммиачного комплекса серебра. Допустим, что это предельный альдегид, в молекуле которого содержится одна карбонильная группа. Тогда его молекулярная формула может быть записана как CnH2nO. Реакция происходит по схеме: 14 R C O + H Ag2O àì ì èà÷í . ð-ð R C O + 2Ag OH Применяя эту схему к условиям нашей задачи, получим: CnH2nO + Ag2O = CnH2nO2 + 2Ag Вычислим количество вещества серебра, которое образуется в результате реакции: (Ag) = 5,4 г / 108 (г/моль) = 0,05 моль. По найденному значению количества вещества серебра найдем количество вещества альдегида, составив пропорцию: x моль альдегида – 0,05 моль серебра 1 моль альдегида – 2 моль серебра 2x = 1 • 0,05 x = 0,025 (моль). Итак, (CnH2nO) = 0,025 моль. Найдем молярную массу альдегида по значению массы (в условии задачи) и по найденному значению количества вещества: m M = M (CnH2nO) = 1,45 ã 0,025 ì î ëü = 58 ã/ì î ëü Теперь наша задача сводится к тому, чтобы найти n. Молярная масса соединения образуется как сумма молярных масс образующих соединение элементов с учетом индексов в его формуле: n M(C) + 2n M(H) + M(O) = M (CnH2nO) 12n + 2n + 16 = 58 n=3 Итак, формула молекулярная альдегида С3Н6О. Тогда, условию задачи соответствует пропионовый альдегид (пропаналь): H3C CH2 C 15 O H Задача 2. В результате присоединения брома к порции углеводорода массой 5,6 г образовался дигалогенид массой 21,6 г. Выведите молекулярную формулу органического вещества. Решение Присоединение брома характерно для алкенов, алкинов, циклоалканов с малым циклом, алкадиенов, то есть для непредельных углеводородов. Молекулярная формула искомого углеводорода, скорее всего, соответствует составу CnH2n или CnH2n–2. Предположим, что искомый углеводород – алкен, тогда его молекулярная формула может быть записана как CnH2n. Уравнение реакции бромирования выглядит следующим образом: CnH2n + Br2 = CnH2nBr2 Выразим значения молярных масс углеводорода и дигалогенида через n: M (CnH2n) = M(C) • n + M(H)• 2n = 12n + 1 • 2n = 14n. M (CnH2nBr2) = M(C) • n + M(H)• 2n + 2M(Br) = 12n + 1•2n + 2•80 = 14n+160. Выразим значение количества вещества алкена и дигалогенида через n: m M = (CnH2n) = m (CnH2n) M (CnH2n) (CnH2nBr2) = = 5,6 14n m (CnH2nBr2) M (CnH2nBr2) (ì î ëü) = 21,6 (ì î ëü) 14n + 160 В соответствии с уравнением реакции, из 1 моль алкена образуется 1 моль дигалогенида. Таким образом, (CnH2n) = (CnH2nBr2). Подставляем значения количества вещества, выраженные через n: 5,6 14n = Решаем полученное уравнение: 16 21,6 14n + 160 5,6 • (14n + 160) = 21,6 • 14n n = 4. Таким образом, искомый углеводород – C4H8. При выполнении заданий части С следует помнить: - запись краткого условия задачи не учитывается при оценивании, так как не рассматривается в качестве элемента ответа; - выполнение заданий этой части экзаменационной работы требует развернутого ответа; - написание второго возможного решения того или иного задания части С дополнительных баллов не дает, хотя времени потребует. В методической системе оценивания заданий с развернутым ответом для единого государственного экзамена сохраняется метод поэлементного оценивания. Универсальность этого подхода заключается в возможности выделить в каждом задании элементы содержания, которые являются составными частями ответа на задание с развернутым ответом. При подготовке к экзамену рекомендуется использовать: – учебники, имеющие гриф Министерства образования РФ; – пособия, включенные в перечень учебных изданий, допущенных Министерством образования РФ; – пособия, рекомендованные ФИПИ для подготовки к единому государственному экзамену. Изменения в экзаменационной работе 2014 по сравнению с 2013 г. Отметим главное, что содержание экзаменационной работы осталось неизменным. Но структура варианта КИМ имеет некоторые изменения. 1. Общее количество заданий в варианте КИМ 2014 года составляет 42 (в работе 2013 г. – 43) 17 2. Расчетные задачи блока В помещены в блок А. Таким образом, задания А26 – А28 варианта КИМ – это расчетные задачи оцениваемые 1 баллом каждая. 3. Тема «Гидролиз солей» осталась только в блоке В (В4). 4. Тема «Окислительно-восстановительные реакции» также исключена из блока А и будет проверяться только заданиями повышенного и высокого уровней сложности (В2 и С1) 5. В блок В включено новое задание, которое проверяет знание качественных реакций в неорганической и органической химии – В6. Теперь все задания блока В (9 заданий) оцениваются двумя баллами. Максимальный первичный балл за выполнение работы остался прежним – 65 баллов. Рекомендации районным методическим службам В целях совершенствования системы подготовки выпускников к сдаче ЕГЭ по химии рекомендуем районным методическим службам: 1. Ежегодно следует проводить семинары для учителей района с целью подведения итогов ЕГЭ за предыдущий учебный год и обсуждения перспектив на новый учебный год. 2. Два раза в учебном году, в первом и во втором полугодии рекомендуется проводить пробное тестирование учащихся 11-го класса в формате ЕГЭ c последующим анализом результатов и выявлением проблем в подготовке учащихся. Для проверки работ можно было бы привлекать экспертов ЕГЭ района. 3. Районным методистам необходимо изучать, обобщать и распространять опыт учителей, выпускники которых показывают наиболее высокие результаты на экзамене. Представление опыта можно реализовать через открытые уроки, мастер-классы и выступления успешных учителей на семинарах в районе. 18 4. Учителям, выпускники которых показали невысокие результаты на ЕГЭ, рекомендуется обучение на курсах повышения квалификации в СПб АППО или в РЦОКОиИТ. Обращаем внимание педагогов на то, что в мае 2013 г. прошел экспертизу новый элективный курс «Трудные вопросы курса химии». Элективный курс предназначен для учащихся 11 класса, изучающих химию на базовом уровне. Курс рассчитан на 34 (68) часов, т.е. 1 или 2 урока в неделю. Программа курса является дополнением к систематическому курсу химии и ставит своей задачей с одной стороны, углубление и расширение знаний старшеклассников по наиболее сложным вопросам курса химии средней школы, с другой стороны оказание помощи в подготовке учащихся к сдаче единого государственного экзамена по химии. Элективный курс содержит следующие разделы: 1) Классификация и номенклатура неорганических и органических веществ 2) Свойства и получение основных классов неорганических веществ 3) Гидролиз 4) Окислительно-восстановительные реакции в неорганической и органической химии. 5) Электролиз, электрохимические способы получения неорганических веществ 6) Особенности электронного строения и химических свойств электронного строения и химических свойств и химических свойств углеводородов. 7) Особенности кислородсодержащих органических веществ 8) Особенности электронного строения азотсодержащих органических веществ 9) Генетическая связь между классами органических веществ Перечисленные темы являются основными для выполнения заданий частей В и С КИМ ЕГЭ. 19