Государственное бюджетное образовательное учреждение среднего профессионального образования Московской области «Мытищинское
advertisement

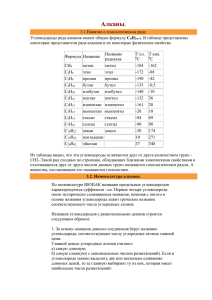
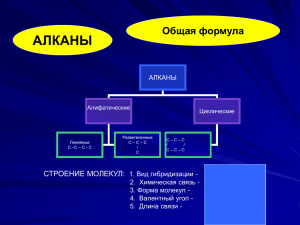
Государственное бюджетное образовательное учреждение среднего профессионального образования Московской области «Мытищинское медицинское училище (техникум)» Лекция по теме "Алканы" Преподаватель химии Кононова Г.В. Мытищи 2014 год Тема «Алканы» Цель урока: познакомить учащихся с алканами и выявить важную их роль в промышленности. Задачи урока: 1. Образовательная: рассмотреть гомологический ряд предельных углеводородов, строение, физические и химические свойства, способы их получения при переработке природного газа, возможности их получения из природных источников: природного и попутного нефтяного газов, нефти и каменного угля. 2. Развивающая: развить понятие о пространственном строении алканов; развитие познавательных интересов, творческих и интеллектуальных способностей, развитие самостоятельности в приобретении новых знаний с использованием новых технологий. 3. Воспитательная: показать единство материального мира на примере генетической связи углеводородов разных гомологических рядов, получаемых при переработки природного и попутного нефтяного газов, нефти и каменного угля. Оборудование: компьютер, мультимедиа проектор, экран, презентация. II. Изученние нового материала. План изучения алканов. 1. 2. 3. 4. 5. 6. 7. 8. Определение. Общая формула класса углеводородов. Гомологический ряд. Виды изомерии. Строение алканов. Физические свойства. Способы получения. Химические свойства. Применение. Контроль и самопроверка знаний. Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.) Алканы - углеводороды в молекулах которых все атомы углерода связаны одинарными связями (?-) и имеют общую формулу: CnH2n+2 - Что такое гомологи? Гомологический ряд метана СН4 метан С2H6 этан C3H8 пропан C4H10 бутан C5H12 пентан C6H14 гексан C7H16 гептан C8H18 октан C9H20 нонан C10H22 декан Структурная изомерия: Алгоритм. 1. Выбор главной цепи: 2. Нумерация атомов главной цепи: 3. Формирование названия: Строение алканов. Атом углерода во всех органических веществах находится в "возбуждённом" состоянии, т. е. Имеет на внешнем уровне четыре неспаренных электрона. Каждое электронное облако обладает запасом энергии: s- облако имеет менший запас энергии, чем р-облако, в атоме углерода они находятся в разных энергетических состояниях. Поэтому при образовании химической связи происходит гибридизация, т. е. выравнивание электронных облаков по запасу энергии. Это отображается наформе и направленности облаков, происходит перестройка (пространственная) электронных облаков. В результате sp3 - гибридизации все четыре валентных электронных облака гибридизованы: валентный угол между этими осями гибридизованных облаков 109° 28', поэтому молекулы имеют пространственную тетраэдрическую форму, форма углеродных цепей зигзагообразна; атомы углерода не находятся на одной прямой, т. к. при вращении атомов валентные углы остаются прежними. Все органические вещества построены в основном за счёт ковалентных связей. Углерод - углеродные и углерод - водородные связи относятся к сигма - связям - это связь, образующаяся при перекрывании атомных орбиталей по линии, проходящей через ядра атомов. Возможно вращение вокруг сигма - связей, поскольку эта связь имеет осевую симметрию. Физические свойства. СН4:C4Н10 – газы T кипения: -161,6:-0,5 °C T плавления: -182,5:-138,3 °C С5Н12:C15Н32 - жидкости T кипения: 36,1:270,5 °C T плавления: -129,8:10 °C С16Н34:и далее- твёрдые вещества T кипения: 287,5 °C T плавления: 20 °C С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления. Получение. В промышленности 1) крекинг нефтепродуктов: C16H34 -> C8H18 + C8H16 2) В лаборатории: а) Гидролиз карбидов: Al4C3 +12 H2O = 3 CH4 + 4 Al(OH)3 б) Реакция Вюрца: C2H5Cl + 2Na -> C4H10 + 2NaCl в) Декарбоксилирование натриевых солей карбоновых солей: СН3СООNa + 2NaОН -> СН4 + Nа2СО3 Химические свойства Для алканов характерны следующие типы химических реакций: Замещение атомов водорода; Дегидрирование; Крекинг; Окисление. 1) Замещение атомов водорода: А) Реакция галогенирования: CH4 +Cl2 -> CH3Cl + HCl Б) Реакция нитрования (Коновалова): CH4 + HNO3 -> CH3-NO2 + H2O + Q В) Реакция сульфирования: CH4 + H2SO4 -> CH3-SO3 H + H2O + Q 2) Реакция изомеризации: CH3-CH2-CH2-CH2-CH3 -> 3) Реакция с водяным паром: CH4 + H2O - CO + 3H2 4) Реакция дегидрирования: 2СН4 > НС=СН + 3Н2 + Q 5) Реакция окисления: CH4 + 2O2 -> Н-C + 2H2O + Q 6) Горение метана: CH4 + 2O2 > CO2 + 2H2O + Q Применение. (Возможно, заранее подготовленные выступления учащихся.) Широко используются в качестве топлива, в том числе для двигателей внутреннего сгорания, а также при производстве сажи: (1 - картрижи; 2 - резина; 3 - типографическая краска), при получение органических веществ (4 - растворителей; 5 - хладогентов, используемых в холодильных установках; 6 - метанол; 7 - ацетилен) III. Закрепление. Составьте все возможные изомеры для гептана и назовите их. Составьте 2 ближайших гомолога для пентана и назовите их. Определить предельный углеводород, плотность паров которого по воздуху равна 2. (C4H10). Учебник: & 3 (стр. 23). IV. Домашнее задание: Учебник О.С. Габриелян (10 класс базовый уровень): упр. 4, 7, 8 (стр. 32).;Чернобельская Г.М. стр.304-317.упр.4-8 (стр.309) Литература. 1. Габриелян О.С.Химия 10 класс Базовый уровень: учеб. для общеобразовательных учреждений. М. Дрофа,2008 год. 2.Чернобельская Г.М. стр.304-317.упр.4-8 (стр.309)