Сложные эфиры
advertisement
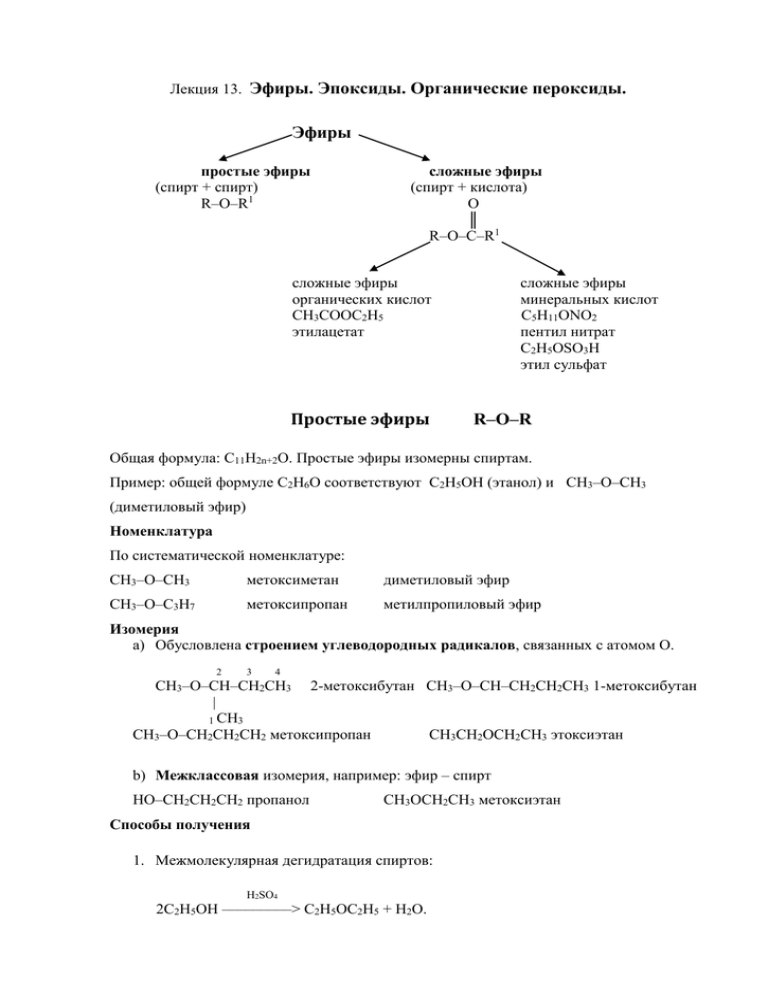
Лекция 13. Эфиры. Эпоксиды. Органические пероксиды. Эфиры простые эфиры (спирт + спирт) R–O–R1 сложные эфиры (спирт + кислота) O ║ R–O–C–R1 сложные эфиры органических кислот CH3COOC2H5 этилацетат Простые эфиры сложные эфиры минеральных кислот С5H11ONO2 пентил нитрат С2H5OSO3H этил сульфат R–O–R Общая формула: C11H2n+2O. Простые эфиры изомерны спиртам. Пример: общей формуле С2H6O соответствуют C2H5OH (этанол) и CH3–O–CH3 (диметиловый эфир) Номенклатура По систематической номенклатуре: CH3–O–CH3 метоксиметан диметиловый эфир CH3–O–C3H7 метоксипропан метилпропиловый эфир Изомерия a) Обусловлена строением углеводородных радикалов, связанных с атомом О. 2 3 4 СH3–O–CH–CH2CH3 2-метоксибутан СH3–O–CH–CH2CH2CH3 1-метоксибутан | 1 CH3 СH3–O–CH2CH2CH2 метоксипропан CH3CH2OCH2CH3 этоксиэтан b) Межклассовая изомерия, например: эфир – спирт НO–CH2CH2CH2 пропанол CH3OCH2CH3 метоксиэтан Способы получения 1. Межмолекулярная дегидратация спиртов: H2SO4 2С2H5OH –––––––––> C2H5OC2H5 + H2O. 2. Реакция Вильямсона (взаимодействие алкоголятов с галогеналкилами): С2H5ONa + J–C2H5 ––––>C2H5OC2H5 + Na J Физические свойства NB!Эфиры кипят при более низких температурах, чем соответствующие спирты, так как в их молекулах нет водородных связей. (СH3)2O tкип = –24oC С2H5OH tкип = +78.3oC Плохо растворяются в H2O. Например, растворимость диэтилового эфира в воде 6%. Все эфиры имеют характерный запах. Химические свойства Эфиры нейтральны и малоактивны. Поэтому (из-за инертности в химическом отношении) их используют в качестве растворителей в органическом синтезе. В отличие от сложных эфиров они не гидролизуются. Основные реакции, в которые они вступают: 1.Реакция ацидолиза. При нагревании концентрированные кислоты, такие как, H2SO4, HJ, а также FeCl3 в уксусном ангидриде расщепляют простые эфиры. С2H5OC2H5 + H2SO4 _t____ > C2H5– O O + Н2О \ // S / \\ C2H5–O O диэтилсульфат или С2H5OC2H5 + 2H2SO4 t__ >2C2H5OSO3H + H2O этилсульфат С2H5–OC2H5 + HJ ––––> C2H5OH + C2H5J Mexанизм реакции: SN1 – для расщепления эфиров третичных спиртов: HX <–––>H+ + XCH3 H3C C OR + H + (CH3)3C CH3 (CH3)3C+ + X- __быстро__>(CH3)3 С –X + OH R ìåäëåííî (CH3)3C + + ROH SN2 – для расщепления эфиров первичных спиртов: +H C2H5 O C2H5 + H - + +X X (C 2H5)2 OH CH 2 O C2H5 C2H5X + C2H5OH CH3 2. Реакция расщепления под действием металлического Na: С2H5OC2H5 + 2Na –––––> C2H5ONa + C2H5Na этилат Nа этил натрий 3. Образование оксониевых соединений типа [NH4]Cl-: + H3C H3C O + + O H Cl H Cl - H3C H3C промежуточные соединения в некоторых реакциях Присоединение протона происходит по одной из двух пар электронов у атома кислорода. Оксониевые соединения являются неустойчивыми соединениями. Основные представители простых эфиров Диэтиловый эфир (С2H5)2O Имеет toкип= 35,6оС, ρ = 0,7135г/см3 Диэтиловый эфир получают из этилового спирта. В 100 г H2O при 20оС растворяется 6,5 г эфира.Смешивается со спиртом в любых соотношениях. Легко испаряется и воспламеняется. Пары его в 2,5 раза тяжелее воздуха, поэтому он не сразу с ним смешивается. Отсюда увеличивается опасность пожара и взрыва. Окисляется при хранении с образованием перекисей R–O–O–R, которые являются проверять взрывчатыми веществами. Эфиры нужно всегда на присутствие.Это можно сделать следующим образом: побурение(J2) (да, перекиси присутствуют) Эфир +KJ –––>встряхиваем цвет не изменяется (нет, перекиси отсутствуют) Для очистки эфир необходимо встряхивать с раствором FeSO4, смесь разделить, затем перегнать. их Циклические простые эфиры (эпокси соединения) H2C α-окиси CH 2 окись этилена (ОЭ) O H2C CH 2 O CH3 окись пропилена CH 2 CH 2 β-окиси H2C окись триметилена O H2C CH 2 O CH 2 γ-окиси ОЭ –жидкость, имеющая CH 2 тетрагидрофуран tкип= 10,7оС , ρ = 0,807 г/см3 при 0оС. Смешивается с водой в любых соотношениях. Очень реакционноспособное в химическом отношении соединение. СH2–CH2 + H–X ––––>HOCH2–CH2X \ / | O <–––––– Химические свойства. 1. СH2–OH2 + H–OH–––>CH2 – CH2 1,2-этандиол \ / | | этиленгликоль (ЭГ) О ОН ОН 2. СH2–СH2 + H–Cl–––>CH2 – CH2Сl 2-хлорэтанол \ / __________ | О ↓ | ОН 1 2 3. СH2–СH2 + HOC2H5–––>HOCH2CH2OC2H5 этилцеллозольв или 2-этоксиэтанол \ / | О <––––– 4. СH2–СH2 + NH3–––>NH2CH2CH2OH этаноламин или 1-аминоэтанол \ / | О <–––––– NB!! Этаноламины используют для очистки газов от СО2 и H2S. H2C CH 2 O 5. __t=300 – 400 C__ Окись этилена > CH3–C = О \ H уксусный альдегид Условия проведения реакции: t=150 -300oC, kat Al2O3, H3PO4 Применение: 1. Путем оксиэтилирования фенолов получают моющую основу для технических моющих средств (ОП-7, ОП–10 и др.) 2. Полимеризацией окиси этилена и пропилена получают полимерные вещества, используемые в составе смеси. синтетических волокон, добавок в пластмассы и бетонные 3. Димеризация этиленоксида приводит к получению диоксана, используемого в O CH2 CH2 CH2 качестве растворителя при синтезе. CH2 O 4. Получение на их основе моноэтаноламина, диэтаноламина,триэтаноламина, служащих для очистки промышленных газовых выбросов от CO2, H2S Сложные эфиры O R C 1.Сложные эфиры органических кислот OR В образовании сложных эфиров могут принимать участие низшие и высшие, предельные и непредельные кислоты и спирты. Номенклатура O CH 3 O CH 3 C C OCH 3 OC 2H5 метилэтаноат (JUPAC) метилацетат этилэтаноат (JUPAC) этилацетат Способы получения 1. Реакцией этерификации (лат. аether – эфир) - путем взаимодействия кислот и спиртов: O H3C C OH + H 18 O H O + H3C C2 H 5 + H2O C O---C 2H5 Метод «меченого атома» (тяжелый изотоп О18) показывает, что Н2О при этерификации образуется за счёт H спирта и ОН кислоты: Механизм: I карбкатион HO OH H3C + C OH +H O H5C2 C2H5 -H 2O O + C OH CH3 O C CH3 H OH -H 2O O +H2O H5C2 + H3 O + + H 5C 2 O C CH3 Для смещения равновесия реакции в сторону образования целевого продукта нужно отводить H2O или образующийся сложный эфир. 2. Путем взаимодействия галогенангидридов или ангидридов кислот со спиртами: O O R + HOC 2H5 C C R O C 2 H5 Cl Физические свойства Летучие жидкости, имеющие специфический запах. Химические свойства 1. Гидролиз (омыление) - H3C + C + O kat OH , H O H2O OC 2H5 CH3 C OH + C2H5OH Обратимая реакция Для того, чтобы реакция гидролиза стала необратимой, её необходимо проводить в среде NaOH: O O H3C + NaOH C OC 2H5 CH3 C ONa + C2H5OH 2. Восстановление (получают один или два спирта в зависимости от радикала): O H 7 C3 C + OC 2H5 2H 2 C3H7CH 2OH + C2H5OH Этиловый эфир бутановой (масляной) кислоты этилбутаноат. 2. Сложные эфиры минеральных кислот Чаще всего это эфиры серной Н2SO4, азотной HNO3 и фосфорной H3PO4 кислот. a) CH3OH + HOSO3H ––––––> CH3OSO3H + H2O б) 2CH3OH + HOSO3H ––––>CH3OSO2OCH3 + 2H2O метилсульфат ( кислые эфиры) диметилсульфат (средние эфиры) Взрывчатые вещества являются сложными эфирами глицерина, этиленгликоля и азотной кислоты: СH2 –OH HONO2 CH2 – ONO2 | | СH2 –OH + HONO2 ––––> CH2 – ONO2 + 3H2O | | СH2 –OH HONO2 CH2 – ONO2 тринитрат глицерина СH2 –OH HO–NO2 CH2 – ONO2 | + –––––> | СH2 –OH HO–NO2 CH2 – ONO2 динитрат этиленгликоля (ЭГ) (этиленгликольдинитрат) Эфиры фосфорной кислоты H3PO4 обладают большой физиологической активностью. OCH3 HO P OCH3 O O Cl3C CH Диметилфосфат используют в качестве инсектицида. OCH 3 P OCH 3 хлорофос - инсектицид OH К эфирам H3PO4 относятся также нуклеиновые кислоты. Применение: 1. Отдушки мыл. Пищевая промышленность. Парфюмерия. 2. Нитроглицерин : медицина (1% раствор); тринитроглицерин –– желтая, вязкая жидкость - входит в состав динамитов и баллистических порохов. 3. Пентилнитрит С5H11ONO – cосудорасширяющее средство. 3. Сложные эфиры глицерина и высших кислот - жиры O ║ CH2 – O – C – R’’’ | триглицериды высших жирных кислот С12–С18 O ║ CH2 – O – C – R’’ | CH2 – O – C – R’ если R’= R’’= R’’’ – то триглицерид называют простым; если R’≠R’’≠R’’’ – смешанный триглицерид ║ O R – радикал предельных и непредельных кислот. Свиной жир содержит: С17H33COOH– олеиновая кислота 45% С17H31COOH– пальмитиновая кислота 27% С17H35COOH–стеариновая кислота 14% Коровье масло содержит : пальмитиновая кислота – 25%, олеиновая кислота – 34%, масляная кислота – до13%, стеариновая кислота –11%, линолевая кислота – 5%. Глицериды предельных кислот являются твёрдыми веществами, непредельных кислотжидкими (масла). Органические перекиси CH3–O–O–C2H5 R–O–O–R С2H5–O–O–C2H5 перекись метил-этила перекись этила Получение алкил или ацетил 2ROH+H–O–O–H–––>R–O–O–R+2H2O Органические перекиси - маслянистые жидкости с неприятным запахом, обжигающие кожу. Гидроперекись имеет формулу: R–O–O–H Взрывоопасны, при нагревании разлагаются. Плотность перекисей увеличивается в следующем ряду: Перекись Перекись Перекись третичного вторичного первичного алкила алкила алкила <––––––––––––––––––––––––––––– Химические свойства 1. При нагревании перекисные соединения разлагается с образованием свободных радикалов: (СH3)3C–O–O–H–t––>(CH3)3C–Oo + HOo ↓ гидроперекись (СH3)2C=O+CH3o CH3–C–O–O–C–CH3–––>2CH3COOo–––>2CO2+2CH3o ║ ║ O O перекись ацетила С2H5–O–O–C2H5––>2C2H5Oo Перекиси используются в качестве инициаторов полимеризации в промышленности. 2. Являясь хорошими окислителями вытесняют J из HJ (подкисление раствора KJ): R–O–O–H + 2HJ–––>J2 + H2O + R–OH Эта реакция является качественной реакций на присутствие перекисей в растворе эфиров или диоксана.


