Презентация 21 - Томский политехнический университет
advertisement

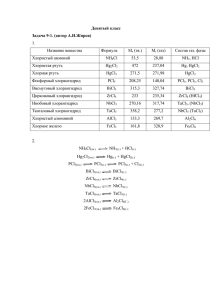
ТЕХНОЛОГИЯ ЦИРКОНИЯ И ГАФНИЯ Лекция 4. Получение металлических циркония и гафния Доцент кафедры химической технологии редких, рассеянных и радиоактивных элементов, к.х.н. Оствальд Р.В. Физико-механические и коррозионные свойства Zr и его обрабатываемость сильно зависят от содержания в нем растворенных N2, O2, H2 и C. Поэтому процессы получения металлических Zr и Hf проводят либо в вакууме, либо в атмосфере инертного газа. Известны 3 группы способов получения металлов Zr и Hf o Металлотермическое восстановление ZrCl4, K2ZrF6 и ZrF4 o Электролиз расплава K2ZrF6 o Термическая диссоциация ZrI4 Основные промышленные способы производства пластичного Zr – это магнийтермическое восстановление ZrCl4 и электролиз Технология циркония и гафния МЕТАЛЛОТЕРМИЧЕСКИЕ МЕТОДЫ Из всех возможных металлотермических процессов получения Zr (ZrO2, ZrF4, K2ZrF6, ZrCl4) наибольшее распространение получил магний термический процесс восстановления хлорида циркония Выделяющегося тепла достаточно для поддержания температуры в зоне реакции 780÷920 °С. Для получения чистого металлического циркония проводят предварительную отчистку технического ZrCl4 Для очистки наибольшую популярность получил метод возгонки. Основными примесями в ZrCl4 являются ZrОCl2, FeCl3, CrCl3, SiCl4 и др. Для очистки от FeCl3 и CrCl3 их предварительно восстанавливают в токе водорода до дихлоридов, имеющих более высокие температуры кипения. Процесс возгонки ведут при 500÷600 °С и давлении 0,11÷0,15 МПа. Производительность просышленных установок 2÷2,5 т продукта за 100÷120 ч После возгонки ZrCl4 содержит примеси: Fe<0,01%; Al<0,008%; Ti<0,003%; Si 0,006% После очистки ZrCl4 помещают в стакан из хромистой коррозионностойкой стали установленный над реакционной ретортой заполненной Mg. Реторты вакуумируют, заполняют аргоном и включают печь реакционной зоны. Для расплавления Mg температуру поднимают до 750 – 750 °С. Давление в реторте сохраняют в пределах 1,1÷1,8 Ат. Затем нагревают печь испарения ZrCl4 до 300÷360 °С. Пары ZrCl4 попадают в реакционный стакан, где реагируют с жидким Mg. Цикл восстановления ~ 48 часов Состав реакционного продукта: Zr губка + Mg + MgCl2. Показатели процесса восстановления: Выход Zr в реакционную массу – 98,5%. Степень использования Mg – 70%. . По окончании процесса восстановления проводят вакуумную отгонку Mg и MgCl2 при 920÷930 °С и остаточном давлении 1,3·10-2÷1,3·10-4 Па. После вакуумной сепарации губку охлаждают до 50 °С, впускают воздух на 20 минут (для пассивации окисной пленкой во избежание самовозгорания), затем воздух откачивают, заполняют Ar до окончательного охлаждения. После чего губка извлекается из реторты и измельчается на дробилке до 6 мм для последующей переплавки. Содержание примесей: Mg – 0,002 – 0,02%; Cl2 – 0,001 – 0,04%; О2 – 0,08 – 0,1%; Fe – 0,07 – 0,08%; Al – 0,005 – 0,006%; N2 – 0,002 – 0,004%. В том случае, когда к металлическому Zr порошку не предъявляются высокие требования, он может быть получен путем натрийтермическим восстановления K2ZrF6 по реакции K2ZrF6 + 4Na = Zr + 4NaF + 2KF + 409,5 кДж. Коэффициент термичности при 298 К для данной реакции g = 1092 Дж/г шихты, т.е. для развития реакции требуется дополнительный подвод тепла нагревом шихты в электропечи (g = 2000 Дж/г). Продукт восстановления выбивают из реакционной реторты, выщелачивают водой в реакторах с мешалками. Порошок Zr сушат при 60 °С осторожно, т.к. порошок склонен к самовоспламенению. Помимо рассмотренных методов цирконий может быть получен кальцийтермическим восстановлением хлорида При 700 – 750 °С протекает реакция ZrF4 + 2Са ↔ Zr + 2СаF2 + 938 кДж Zr получают в виде порошка, распределенного в шлаке, т.к. тепла, выделяющегося при реакции недостаточно для расплавления Zr. Практическое использование этого метода сдерживается трудностями получения ZrF4 Технология циркония и гафния ПОЛУЧЕНИЯ Zr ЭЛЕКТРОЛИЗОМ Большое практическое значение имеет хлоридно-фторидный электролиз. Наиболее оптимальным составом является смесь 70% КCl + 30% K2ZrF6, которая плавится при 730 °С. Это позволяет проводить электролиз при сравнительно низкой температуре 750÷800 °С. Предполагается следующий механизм электролиза На аноде разряжаются ионы Cl-, E0(Cl- /Cl0)= +3,39В, E0(F- /F0)= +3,5 По мере накопления КF в электролите, электролит меняют. Потенциал разложения K2ZrF6 при 840 °С составляет 1,226В. Напряжение разложения K2HfF6 выше, чем у K2ZrF6. Поэтому на катоде выделяется в первую очередь цирконий, а электролит обогащается гафнием. При содержании Hf в исходном материале 1,4% содержание его в электролите может увеличиваться до 2,6÷5,5%, а в порошке Zr снизится до 0,15÷0,45 %. Электролизом расплава КCl и NaCl, содержащего 30% K2ZrF6 при напряжении на ванне 2,5В и катодной плотности тока 400÷500 А/дм2 получены крупные и чистые кристаллы Zr. При более высокой плотности получаются кристаллы мельче. Предварительный электролиз расплава при напряжении 1,3÷1,5В позволяет получить более чистые кристаллы. Катодный осадок содержит около 30% порошка циркония размером частиц до 200 мкм. Остальное – соли электролита. Электролиз проводят в электролизере из нержавеющей стали с двойными стенками. Между стенками подают холодную воду или воздух. Внутри ванны образуется гарнисаж. Предварительный разогрев проводят переменным электрическим током, подаваемым на два специальных графитовых электрода. После расплавления электролита вводят 2 графитовых электрода, на которые подают постоянное напряжение для электролиза. На катоде нарастает «катодная» груша. После извлечения катодной груши, ее разрушают, промывают HCl, водой и осторожно сушат. Технология циркония и гафния ТЕРМИЧЕСКАЯ ДИССОЦИАЦИЯ ZrI4 В технологии получения особо чистых тугоплавких металлов особое место занимает способ термического разложения иодидов металлов (иодидное рафинирование). Способ иодидного рафинирования был предложен в 1925 году Ван Аркелем и де Буром. Металл может быть подвержен иодному рафинированию в том случае, если он отвечает следующим требованиям: o o o o 1. Металл может образовывать с йодом сравнительно летучие соединения (йодиды). 2. Йодиды легко получаются при сравнительно низкой температуре. 3. Образующиеся йодиды легко разлагаются при более высокой температуре, но ниже температуры плавления металла. 4. Скорость разложения соединения и отложения металла должна быть выше, чем скорость испарения металла с ними. Т.е. в одной части аппарата при 200300°С образуется ZrI4, который затем разлагается в другой части при температуре 1200-1400°С. Процесс йодидного рафинирования первоначально проводился в стеклянных аппаратурах, которые используются для небольших масштабов. В процессе рафинирования металл очищается от N2, O2, Н2, т.к. нитриды, оксиды и гидриды не взаимодействуют с I2 и остаются в губке. Происходит очистка и от элементов, не образующих летучих йодидов. В промышленных аппаратах на 1 кг. сырого циркония загрузка йода составляет примерно 50 г. Нить из Zr берется диаметром 2 ÷ 3 мм., длиной примерно 2 м в форме U образных петель. В крышке, герметично присоединяемой к корпусу аппарата, имеется гнездо для стеклянной ампулы с йодом и патрубок для присоединения к вакуумной системе. В конце процесса диаметр прутка составляет 25 ÷ 30 мм. и выше. Пруток диаметром 25 мм. наращивается за 30 ÷ 40 часов Технология циркония и гафния ПОЛУЧЕНИЕ КОМПАКТНОГО Zr Подавляющее большинство компактного пластичного Zr получают путем плавки в вакуумных дуговых печах с расходуемым электродом. С целью улучшения физико-механических и коррозионных свойств Zr для изготовления оболочек ТВЭЛов в циркониевую губку при прессовании расходуемых электродов вводят легирующие добавки (Nb, Sn). В современных вакуумных дуговых печах получают слитки Zr и сплав на его основе диаметром до 500 мм. и массой до 2,0 т. и более. Одним из эффективных методов плавки Zr , как и других тугоплавких металлов, является электроннолучевая плавка (ЭЛП). В данном методе сочетается плавка с рафинированием от летучих примесей в высоком вакууме (10-4 ÷10-5 мм.рт.ст.), достигаемом в электроннолучевой печи. ТЕХНОЛОГИЯ ЦИРКОНИЯ И ГАФНИЯ Лекция 4. Получение металлических циркония и гафния Доцент кафедры химической технологии редких, рассеянных и радиоактивных элементов, к.х.н. Оствальд Р.В.