Озон
advertisement

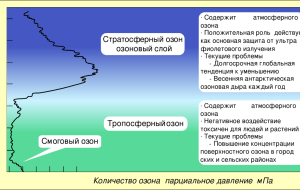
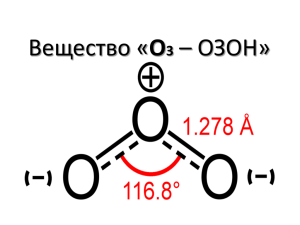
Халькогены Элементы 6 группы главной подгруппы: O, S, Se, Te, Po Нахождение в природе В виде соединений с металлами Самородная сера Свинцовый блеск PbS Магнитный колчедан FeS Строение атома Степень окисления халькогенов кислород Сера -2, 0, +2 , -1 -2, 0, +2, +4, +6 Получение кислорода 1. Разложение перманганата калия при нагревании: 2KMnO4 = K2MnO4 + MnO2 + O2 2.Разложение перекиси водорода: 2Н2О2 = 2Н2О + О2 3. Разложение нитрата калия: 2NaNO3 =2NaNO2 + О2 4.Разложение бертолетовой соли: 2KClO3 = 2KCl + 3О2 4.Из воздуха. Получение серы 1.Выплавление из породы. 2.Неполное окисление сероводорода: 2H2S + O2=2H2O + 2S 3.Подкисление тиосульфата натрия: Na2S2O3 + 2HCl = 2NaCl + SO2 + H2O + S Аллотроптая модификация кислорода Озон О3 - газ голубого цвета с резким запахом. Каждый, кто обратил внимание на то, как пахнет воздух после грозы или вблизи источника электрического разряда, знает запах этого газа очень хорошо. В природе озон образуется под действием ультрафиолетового излучения Солнца, а также получается при электрических разрядах в атмосфере: Люди впервые встретились с ощутимым количеством озона только после изобретения электрических машин. Впервые описал озон даже не химик, а физик - голландец Мартин ван Марум в 1785 году. Он посчитал, что под действием на кислород электрического разряда (искры) получается особая "электрическая материя". Название "озон" в переводе с греческого означает "пахучий". Озон - очень сильный окислитель. Поэтому его используют при обеззараживании питьевой воды. При контакте с озоном большинства веществ, способных окисляться, происходит взрыв. Озон образуется в атмосфере Земли на высоте 25 км под действием солнечной радиации. И здесь вредный газ превращается в защитника всего живого на Земле: он задерживает и поглощает опасное излучение Солнца. Однако в озоновом "зонтике" Земли, который имеет толщину всего-то около 30 метров, то и дело возникают "дыры". Особенно это стало заметно в последние десятилетия в связи с загрязнением окружающей среды. В воздух попадает все больше "вредных" для озона газов, вроде монооксида азота NO или тех веществ, которые используются для наполнения холодильных установок и аэрозольных баллончиков. Даже частичное исчезновение озонового слоя над Землей грозит всему живому гибелью... Н2О2 На свету и под действием катализаторов (MnO2) легко разлагается (при нагревании - со взрывом): 2H2O2 = 2H2O + O2↑ Известны производные H2O2: Na2O2 - пероксид натрия BaO2 - пероксид бария Пероксиды при нагревании выделяют кислород: 2BaO2 = 2BaO + O2 реагируют с углекислым газом: 2Na2O2 + 2CO2 = 2 Na2CO3 + O2 (реакция используется для регенерации воздуха). Свойства пероксидов Пероксиды проявляют сильные окислительные свойства (O−I → O−II): 4H2O2 + PbS(т) = 4H2O + PbSO4↓ Na2O2(т) + 2H2SO4 + 2KI = 2H2O + I2↓ + Na2SO4 + K2SO4 и умеренные восстановительные свойства (O−I → O0): 2H2O2 + Ca(ClO)2 = CaCl2 + 2H2O + 2O2↑ 5Na2O2(т) + 8H2SO4 + 2KMnO4 = 5O2↑ + 8H2O + 2MnSO4 + 5Na2SO4 + K2SO4 Получение и применение пероксидов Получение H2O2: BaO2 + 2HCl(конц., хол.)= BaCl2 + H2O2 Пероксиды применяются как отбеливатели текстиля, бумаги, кож, жиров и минеральных масел, окислители ракетного топлива, реагенты в органическом синтезе, при осветлении картин старых мастеров (красочный слой, потемневший из-за перехода белил (гидроксокарбоната свинца в черный PbS) осветляют переводом в белый PbSO4). Проверочная работа 1. Схема строения атома хлора 2. электронная формула фтора 3. Возможные степени окисления фтора и хлора 4. способ получения хлора из бертолетовой соли 5. Реакция взаимодействия хлора с горячим раствором гидроксида калия 6. Как получают соляную кислоту в промышленности