«Газовые законы» Урок физики в 10 классе Учитель: Добродумова Н.П.
advertisement

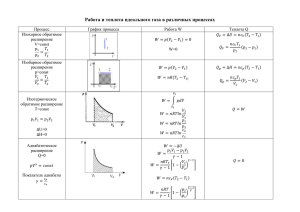
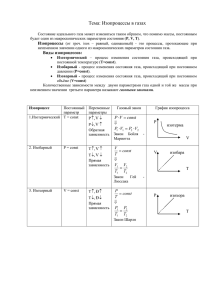
«Газовые законы» Урок физики в 10 классе Учитель: Добродумова Н.П. 1.Какие макропараметры характеризуют состояние газа? 2. Какой физический закон устанавливает зависимость между тремя макроскопическими параметрами — Р, V, T идеального газа? 3.Чем отличается уравнение состояния идеального газа от уравнения Менделеева - Клапейрона? Какое из них полнее по содержанию? Почему? 4.Каким уравнением удобно воспользоваться для установления количественной зависимости между параметрами одного и того же состояния газа при фиксированном третьем? Запишем уравнение состояния pV = m RT в виде M pV m = R M T Выберем газ с молярной массой М и рассмотрим два его состояния в закрытом сосуде (m = const) pV m = R M T p1V1 m = R M T1 p2V2 m = R M T2 p1V1 pV = 2 2 T1 T2 получил Б.Клапейрона Клапейрон уравнение m pV = RT M получилуравнение Д.И.Менделеев Менделеева - Клапейрона ppV p2V2 1V1 ==const TT1 T2 ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС Процесс изменения состояния газа при постоянной температуре называют ИЗОТЕРМИЧЕСКИМ pV = const T при Т = const pV = const Закон Бойля – Мариотта: для газа данной массы произведение давления на объем постоянно, если температура не меняется Пример: медленное расширение (сжатие) воздуха под поршнем в сосуде р1V1 = р2V2 p 2 V р изотермическое сжатие расширение 1 1/2 1/4 1/4 1/2 1 2 V ИЗОПРОЦЕССЫ В ГАЗАХ процесс m = const закон графики изотерми- Бойля ческий Мариотта изотермы Т = const р1V1 = р2V2 р р V T1<T2 р2 T2 р1 T1 V V T ВАЖНО: из двух изотерм в координатах pV выше расположена та, на которой температура больше. Из графиков видно, что при фиксированном значении V р1 < р2, что возможно лишь при T1<T2 T ИЗОБАРНЫЙ ПРОЦЕСС Процесс изменения состояния газа при постоянном давлении называют ИЗОБАРНЫМ pV = const T при р = const V = const T Закон Гей-Люссака: для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется V1 V2 = T1 T2 Пример: расширение газа при нагревании в сосуде с подвижным поршнем при ратм= const изобарное изобарное V V Т нагревание охлаждение V 3 V 2 V1 T1 T2 T3 T ИЗОПРОЦЕССЫ В ГАЗАХ процесс закон графики m = const изобарный Гей р = const Люссака V1 T1 = изобары V2 V T2 V2 p2 < p1 V1 р р р2 р1 T T V ВАЖНО: из двух изобар в координатах VТ выше расположена та, на которой давление меньше. Из графиков видно, что при фиксированном значении Т V1 < V2 , что возможно лишь при p1 > p2 T ИЗОХОРНЫЙ ПРОЦЕСС Процесс изменения состояния газа при постоянном объеме называют ИЗОХОРНЫМ pV = const T при V = const p = const T Закон Шарля: для газа данной массы отношение давления к температуре постоянно, если объем газа не меняется р1 р2 = T1 T2 Пример: нагревание газа в лампочке накаливания при ее включении V= const рТ р р3 р2 изохорное изохорное охлаждение нагревание р1 T1 T2 T3 T ИЗОПРОЦЕССЫ В ГАЗАХ процесс m = const закон изохорный V = const Шарля p1 T1 = p2 T2 графики Изохоры р V2 < V1 p2 p1 р V V2 V1 T T V ВАЖНО: из двух изохор в координатах pТ выше расположена та, на которой объем меньше. Из графиков видно, что при фиксированном значении Т р1 < р2 , что возможно лишь при V2 < V1 . T С помощью уравнения состояния можно исследовать процессы, в которых масса газа постоянна: m = const Количественные зависимости между двумя параметрами газа при неизменном значении третьего параметра называют газовыми законами. Процессы, протекающие при неизменном значении одного из параметров: p, V, T - называют изопроцессами. процесс m = const закон графики Расположите номера процессов в соответствующие колонки таблицы V р 1 T V 7 р 2 V 8 T р р р V 14 р изохорное 11 T р 6 T р V 12 T V 17 18 T T V изотермическое р V р 16 T T V р 10 T: 15 5 T V 9 V 4 T V 13 р 3 изобарное нагревание охлаждение расширение сжатие нагревание охлаждение 13, 14, 15 3, 5, 8 4, 6, 7 11, 12, 18 1, 2, 9 10, 16, 17 • В сосуде находится некоторое количество идеального газа. Как изменится температура газа, если он перейдет из состояния 1 в состояние 2 ? 1 балл 0 баллов 1 Т2 = 4 Т1 V 2 1 2 Т2 = ¼ Т1 3 Т2 = 4/3 Т1 4 Т2 = ¾ Т1 р • На рисунке показан график зависимости объема V одноатомного идеального газа от температуры. Найти отношение давлений газа р2 /р1 1 5 2 2 5 3 2 4 5 2 2 0 баллов 1 балл V0 1 Т0 • На рисунке представлены графики процессов, проводимых с постоянной массой идеального газа . Какой из процессов изображен на графике 1? 0 баллов 1 балл 0 баллов 1 3 адиабатный 2 изохорный 4 изотермический изобарный р Т 1 2 3 4 V Использованная литература • Физика : Учеб. для 10 кл. общеобразоват. учреждений / Г.Я.Мякишев, Б.Б. Буховцев, Н.Н.Сотский. – 12-е изд. – М. : Просвещение, 2009. • ЕГЭ 2011. Физика. Универсальные материалы для подготовки учащихся / ФИПИ – М. : Интеллект – Центр. 2011. • Самое полное издание типовых вариантов ЕГЭ: 2011, 2012 : Физика / авт. – сост. А.В.Берков, В.А.Грибов. – М.: АСТ: Астрель, 2011, 2012. • Портреты ученых – страницы свободного доступа сети интернет • Рекомендации по использованию триггеров в тестовых заданиях даны Г.Ф.Кузнецовым. • Материалы сайта http://bakhtinairina.narod2.ru/ege_po_fizike/