Ковалентная связь
advertisement

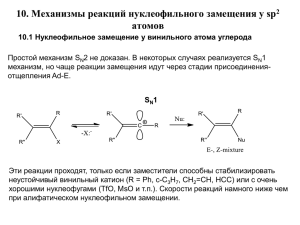
Лекция № 2 Реакционная способность органических веществ • Энергетика органических реакций • Интермедиаты органических реакций, • Устойчивость интермедиатов • Индукционный эффект Реакционная способность органических молекул Реакционная способность характеризует активность молекулы в том или ином химическом процессе ? Как оценить реакционную способность? Экспериментально Константа скорости Теоретически Энергия активации Одним из основных факторов, влияющих на реакционную способность, является строение молекулы Реакционный центр – участок молекулы (атом или группа атомов) – принимающий участие в химическом процессе. Оставшаяся часть молекулы либо способствует протеканию реакции (повышает реакционную способность), либо препятствует процессу – понижает реакционную способность Почему и как ? это происходит? Движущей силой химической реакции является стремление реагирующих молекул занять наиболее устойчивое состояние, т.е. состояние с наименьшей свободной энергией ∆ G<0 ∆ G= ∆ H - T ∆ S lnКр=-∆G/RT Изменение энергии системы Возможно ли протекание химической реакции? Отрицательное значение ∆G является необходимым, но недостаточным условием протекания химической реакции H + Br+ 1 1,2,3 – элементарные стадии химической реакции Br Br Br+ + H+ 2 3 Лимитирующая стадия Энергия A + B [1] [интермедиат] [2] X 1 в квадратных скобках помещают неустойчивые переходные состояния или интермедиаты 2 1 молекулярность стадии - число взаимодействующих частиц, принимающих участие в стадии * акт. A+ B интермедиат C+D Координата реакции k=A∙e - Еакт / RT Уравнение Аррениуса переходное состояние (#) – промежуточное состояние, когда старые связи еще не разорвались, а новые еще не образовались. интермедиат – промежуточное соединение, образующееся на одной элементарной стадии Принцип Хэммонда: если реакция проходит как через переходное состояние, так и интермедиат, энергия которых почти равна, то взаимное превращение обоих сопровождается лишь малым изменением структуры. При экзотермических реакциях переходное состояние похоже на исходные субстраты; при эндотермических реакциях – на продукты. Разрыв ковалентной связи Гетеролитическией Гомолитический Катионы и анионы Радикалы Интермедиаты Карбокатион Радикал Карбоанион Метильный катион трет-Бутильный радикал Бензильный анион Е (изменение внутренней энергии) Устойчивость интермедиатов Электронодонор Электроноакцептор R-? 0 Система всегда стремится к минимуму внутренней энергии!!!! Электронодоноры стабилизируют карбокатионы, алифатические радикалы Электроноакцепторы стабилизируют карбоанионы Электронные эффекты заместителей Электронные эффекты заместителей могут осуществляться по двум механизмам: индукционному (I) и мезомерному (M), или резонансному. Индукционный эффект Индукционный эффект на схемах демонстрируется с помощью стрелки: +I - заместитель, повышает электронную плотность на реакционном центре -I - заместитель понижает электронную плотность на реакционном центре Особенности проявлений индукционных эффектов 1. Сила индукционного эффекта быстро убывает с расстоянием: + H3C + - CH2 Cl H3C - + CH2 Li 2. Все ненасыщенные углеводородные группировки проявляют -I-эффект 3. Индукционный эффект передается через пространство вдоль σ-связей Стабильность интермедиатов 1 2 1 * Энергия акт. A+ B интермедиат C+D Координата реакции Суммируем: 1. Любая химическая реакция должна рассматриваться с позиций термодинамики и кинетики. 2. Термодинамика указывает на возможность протекания процесса в данных условиях, выражаемую, например, через ∆G или константу равновесия. Термодинамическое описание ничего не говорит о скорости протекания реакции, времени достижения равновесия. 3. Скорость же реакции определяется энергией ее переходного состояния, которая описывается в терминах кинетики. 4. Механизм реакции - совокупность и последовательность элементарных стадий. Механизм реакции определяет: • последовательность стадий; • тип интермедиатов; • лимитирующую стадию. 6. Строение и энергия интермедиатов близки к строению и энергии переходных состояний. 7. Факторы, стабилизирующие/дестабилизирующие интермедиат, будут стабилизировать/дестабилизировать переходное состояние.