Инертные газы
advertisement

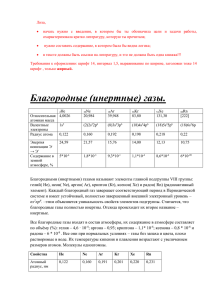
Выберите раздел, который вас интересует или нажмите на элемент, чтобы узнать о нём больше ... • в металлургии в качестве защитного инертного газа для выплавки чистых металлов; • в пищевой промышленности зарегистрирован в качестве пищевой добавки E939, в качестве пропеллента и упаковочного газа; Пропелленты инертные хим. в-ва, с помощью к-рых в аэрозольных баллонах создается избыточное давление. • используется в качестве хладагента для получения сверхнизких температур; • для наполнения воздухоплавающих судов (дирижабли и аэростаты) — при незначительной по сравнению с водородом потере в подъемной силе гелий в силу негорючести абсолютно безопасен; • для наполнения воздушных шариков и оболочек метеорологических зондов; • для заполнения газоразрядных трубок. • жидкий неон используют в качестве охладителя в криогенных установках. Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном; • наполняют газоразрядные лампы, сигнальные лампы в радиотехнической аппаратуре, фотоэлементы, выпрямители; • неоновые лампы используют для сигнальных целей на маяках и аэродромах, так как их красный цвет очень слабо рассеивается туманом и мглой. • в аргоновых лазерах; • в качестве защитной среды при сварке (дуговой, лазерной, контактной и т. п.) как металлов (например, титана), так и неметаллов; • в качестве плазмаобразователя в плазматронах при сварке и резке; в качестве огнетушащего вещества в газовых установках пожаротушения; • в медицине во время операций для очистки воздуха и разрезов, так как аргон почти не образует химических соединений • производство сверхмощных эксимерных лазеров; • криптон используют в энергосберегающих лампочках. Он помогает лампам меньше отдавать тепла и больше светить; • фториды криптона предложены в качестве окислителей ракетного топлива и в качестве компонента для накачки боевых лазеров; • используется в качестве заполнения пространства между стёклами в стеклопакете для придания стеклопакету повышенных теплофизических (он обладает пониженной теплопроводностью) и звукоизоляционных свойств. • Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света • Радиоактивные изотопы применяют в качестве источников излучения в радиографии и для диагностики в медицине, для обнаружения течи в вакуумных установках; • Фториды ксенона используют для пассивации металлов; • Ксенон является высокоэффективным рабочим телом для электрореактивных двигателей космических аппаратов. • В наши дни ксенон проходит апробацию в лечении зависимых состояний. Ксеноновая лампа-вышка • Радон используют в медицине для приготовления радоновых ванн; • Радон используется в сельском хозяйстве для активации кормов домашних животных; • В металлургии в качестве индикатора при определении скорости газовых потоков в доменных печах, газопроводах.; • В геологии измерение содержания радона в воздухе и воде применяется для поиска месторождений урана и тория, в гидрологии — для исследования взаимодействия грунтовых и речных вод. Динамика концентрации радона в подземных водах может применяться для прогноза землетрясений. Первый благородный газ, аргон, был открыт в 1894 году. В это время возник горячий научный спор между двумя британскими учеными - лордом Рэлеем и Вильямом Рамзаем. Релею пришло в голову, что азот, полученный из воздуха после удаления кислорода, имел плотность несколько большую, чем азот, полученный химическим путем. Рамзай удалил из воздуха кислород обычным способом - использовав его для сжигания, и связал азот, пропуская его над раскаленным магнием. Применив оставшийся газ для дальнейших спектральных исследований, изумленный ученый увидел невиданный раньше спектр с красными и зелеными линиями. Д. У. Рэлей У. Рамзай Инертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определённых условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления. Радон тоже имеет высокую химическую активность, но он сильно радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона. Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов. Ге́лий - второй порядковый элемент периодической системы химических элементов Д. И. Менделеева, с атомным номером 2. Возглавляет группу инертных газов в периодической таблице. Обозначается символом He (лат. Helium). Гелий один из наиболее распространённых элементов во Вселенной, он занимает второе место после водорода. Также гелий является вторым по лёгкости (после водорода) химическим элементом. В промышленности гелий получают из природного и нефтяного газов. Спектральные линии гелия При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску. По мере уменьшения давления происходит смена цветов — розового, оранжевого, жёлтого, яркожёлтого, жёлто-зелёного и зелёного. Название: От греч. ἥλιος — «Солнце» Нео́ н — элемент главной подгруппы восьмой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 10. Пятый по распространённости элемент во Вселенной Получают совместно с гелием в качестве побочного продукта в процессе сжижения и разделения воздуха на крупных промышленных установках. Эмиссионный спектр неона Все благородные газы имеют завершенную электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Название происходит от греч. νέος — новый Арго́ н — элемент главной подгруппы восьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 18.Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. Качественно аргон обнаруживают с помощью эмиссионного спектрального анализа. При количественном определении сопутствующие газы (O2, N2, H2, CO2) связываются специфичными реагентами (Ca, Cu, MnO, CuO, NaOH) или отделяются с помощью поглотителей (например, водных растворов органических и неорганических сульфатов). Рэлей и Рамзай дали новому газу имя «аргон» (от др.греч. ἀργός — ленивый, медленный, неактивный) Крипто́ н — элемент главной подгруппы восьмой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 36. Получается как побочный продукт в виде криптоноксеноновой смеси в процессе разделения воздуха на промышленных установках.. Большое количество вдыхаемого криптона при недостаточном количестве кислорода может привести к удушью. При вдыхании газовых смесей, содержащих криптон, при давлении более 3,5 атмосфер наблюдается наркотический эффект. При давлении 6 атмосфер криптон приобретает острый запах, похожий на запах хлороформа От греч. κρυπτός — скрытый. Ксено́ н — элемент главной подгруппы восьмой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 54 Получается как побочный продукт в виде криптоноксеноновой смеси в процессе разделения воздуха на промышленных установках.. Ксенон относительно редок в атмосфере Солнца, на Земле, в составе астероидов и комет. Весьма редкий элемент. При нормальных условиях 1000 м3 воздуха содержат около 87 см3 ксенона. От греч. ξένος — чужой. Открыт в 1898 английскими исследователями Уильямом Рамзаем и Морисом Траверсом, которые подвергли медленному испарению жидкий воздух и спектроскопическим методом исследовали его наиболее труднолетучие фракции. Радо́ н — элемент 18-й группы периодической системы химических элементов Д. И. Менделеева (по старой классификации — главной подгруппы 8-й группы, 6-го периода), с атомным номером 86. Через водный раствор любой соли радия продувают воздух, который уносит с собой образующийся при радиоактивном распаде радия радон. Далее воздух тщательно фильтруют для отделения микрокапель раствора. Открытие радиоактивности и радона совпало с повышением интереса к биологическим эффектам радиации. Было установлено, что вода многих источников минеральных вод богата эманацией радия. Попадая в организм человека, радон способствует процессам, приводящим к раку лёгких. Распад ядер радона и его дочерних изотопов в легочной ткани вызывает микроожог. Впервые радон выделили в чистом виде Рамзай и Грей в 1908 году, они же предложили назвать газ нитон (от лат. nitens, светящийся). В 1923 году газ получил окончательное название радон и символ Em был сменён на Rn. • Гелий — вещество с самой низкой температурой кипения. Гелий кипит при температуре −269 °C. • Гелий способен заполнять абсолютно любые пустоты и трещины, оставаясь при этом крайне инертным газом, т.е. не вступая ни в какие реакции со средой. Существует даже особая наука, гелиеметрия, которая изучает прохождение гелия через разнообразные среды. • Под действием электрического тока аргон начинает испускать приятное ровное сине-голубое свечение. • Низкая теплопроводность аргона была отмечена и использована при производстве верхней одежды. Слой аргона в 4,5 мм позволяет с успехом заменить 14 мм твердых изоляторов. Закачивая газ в куртку, человек способен самостоятельно регулировать ее теплопроводность, увеличивая или уменьшая количество введенного вещества. • Неон и криптон были случайно открыты Рамзаем и Траверсом, когда те пытались выделить из воздуха гелий. • «Неоновые огни» оправдывают своё название только в случае свечения красного цвета. Для получения других цветов используют электрический разряд в парах ртути в газоразрядных трубках, изнутри покрытых люминофором нужного цвета свечения, преобразующих ультрафиолетовое излучение разряда в видимый свет, или разряд в смеси других благородных газов. • Неон своим именем (в переводе с греческого новый), был обязан двенадцатилетнему сыну Рамзая, когда тот вошел в лабораторию отца и увидел необычное ярко-красное свечение только что полученного газа.