Химический эксперимент при проведении ГИА по химии
advertisement

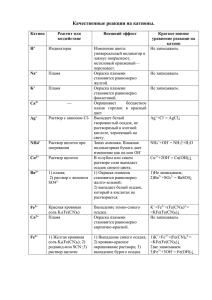
Подготовлено учителем химии МБОУ СОШ №11 города Красногорска Дадоновой И.Н. В 2014 г. на выбор органов управления образованием субъектов РФ предлагается две модели экзаменационной работы по химии: экзаменационная модель 1 по своей структуре и содержанию включаемых в нее заданий аналогична экзаменационной работе 2013 г.; экзаменационная модель 2 предусматривает выполнение реального химического эксперимента. Данная экспериментальная составляющая представлена заданиями С3 и С4. . организация ГИА по химии в соответствии с экзаменационной моделью 2 предполагает проведение большой подготовительной работы, как с точки зрения подготовки специалистов, принимающих участие в проведении экспериментальной части экзамена, так и с позиции обеспечения аудиторийлабораторий в ППЭ необходимым лабораторным оборудованием и реактивами Несмотря на указанные различия, структура каждой из этих моделей остается прежней. Каждый вариант экзаменационной работы состоит из 3 частей. Одинаковые по форме представления и уровню сложности задания сгруппированы в определенной части работы. Часть 1 содержит 15 заданий с выбором ответа (базового уровня сложности). Их обозначение в работе: А1, А2, А3, … А15. Часть 2 содержит 4 задания с кратким ответом (повышенного уровня сложности). Их обозначение в работе: В1, В2, В3, В4. Часть 3 содержит 3 или 4 задания с развернутым ответом (высокого уровня сложности). Их обозначения в экзаменационной работе 1: С1–С3; в работе 2: С1–С4. Задания расположены по принципу постепенного нарастания уровня их сложности. Доля заданий базового, повышенного и высокого уровней сложности составила в работе 68, 18 и 14% соответственно. - Задание С3 - мысленный эксперимент: для заданного набора веществ спланировать двухстадийный синтез нового вещества, написав уравнения реакций, указать признаки их протекания. Написать ионное уравнение одной из реакций. Оценивается в пять первичных баллов. Даны вещества: FeCl3, H2SO4(конц), Fe, Cu, NaOH, CuSO4. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа(II). Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции. Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) Составлены два уравнения реакции: 1) Fe + CuSO4 = FeSO4 + Cu 2) FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4 Описаны признаки протекания реакций: 3) для первой реакции: выделение красного осадка металлической меди; 4) для второй реакции: выпадение серо-зелёного осадка. Составлено сокращённое ионное уравнение второй реакции: 5) Fe2+ + 2OH– = Fe(OH)2 Ответ правильный и полный, содержит все названные элементы 5 Правильно записаны четыре элемента ответа 4 Правильно записаны три элемента ответа 3 Правильно записаны два элемента ответа 2 Правильно записан один элемент ответа 1 Все элементы ответа записаны неверно 0 Максимальный балл 5 Демовесия-2: усилена практикоориентированная составляющая, в связи с чем в экзаменационную работу включено задание для выполнения реального химического эксперимента (С4). Задание С4 является продолжением задания С3, которое оценивается в данном случае в 4 балла, максимальная оценка задания С4 - 5 баллов, общая оценка части С - 15 баллов. Приступайте к выполнению заданий С3 и С4 после выполнения всех предыдущих заданий. Прочитайте текст и выполните задания С3 и С4. Задание С4 выполняйте только под наблюдением эксперта-экзаменатора Для проведения эксперимента предложены следующие реактивы: железо, медь и растворы хлорида железа(III), гидроксида натрия и сульфата меди(II). Вам также предоставлен комплект лабораторного оборудования, необходимого для проведения химических реакций. Требуется получить гидроксид железа(II) в результате проведения двух последовательных реакций. Выберите необходимые для этого реактивы из числа тех, которые вам предложены. Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для реакции ионного обмена составьте сокращённое ионное уравнение. Подготовьте лабораторное оборудование, необходимое для проведения эксперимента. Проведите реакции в соответствии с составленной схемой превращений. Опишите изменения, происходящие с веществами в ходе проведённых реакций. Сделайте вывод о химических свойствах веществ (кислотно оснόвных,окислительно-восстановительных), участвующих в реакции и классификационных признаках реакций. Вы приступаете к выполнению эксперимента. Для этого инструкция по выполнению задания С4. 1.Получите лоток с лабораторным оборудованием и реактивами у дежурного-организатора в аудитории. 2. Прочтите ещё раз текст к заданиям С3 и С4 и убедитесь, что на выданном лотке находится пять перечисленных в условии задания реактивов. 3. Перед началом выполнения эксперимента осмотрите ёмкости с реактивами и определите способ работы с ними. При этом обратите внимание на рекомендации, которым Вы должны следовать. В склянке находится пипетка. Это означает, что отбор жидкости и переливание её в пробирку для проведения реакции необходимо проводить только с помощью пипетки. Для проведения опытов отбирают 7–10 капель реактива. Пипетка в ёмкости с жидкостью отсутствует. В этом случае переливание раствора осуществляют через край склянки, которую располагают так, чтобы при её наклоне этикетка оказывалась сверху(«этикетку — в ладонь!»). Склянку медленно наклоняют над пробиркой ,пока нужный объём раствора не перельётся в неё. Объём перелитого раствора должен составлять 1–2 мл (1–2 см). Для проведения опыта требуется порошкообразное вещество (сыпучее вещество). Отбор порошкообразного вещества из ёмкости осуществляют только с помощью ложечки или шпателя. При отборе исходного реактива взят его излишек. Возврат излишка реактива в исходную ёмкость категорически запрещён. Его помещают в отдельную, резервную пробирку. Сосуд с исходным реактивом (жидкостью или порошком) обязательно закрывается крышкой (пробкой) от этой же ёмкости. При растворении в воде порошкообразного вещества или при перемешивании реактивов следует слегка ударять пальцем по дну пробирки. Для определения запаха вещества взмахом руки над горлышком сосуда с веществом направляют пары этого вещества на себя. Для проведения нагревания пробирки с реактивами на пламени спиртовке необходимо: 1) снять колпачок спиртовки и поднести зажжённую спичку к её фитилю; 2) закрепить пробирку в пробиркодержателе на расстоянии 1–2 см от горлышка пробирки; 3) внести пробирку в пламя спиртовки и передвигать её в пламени вверх и вниз так, чтобы пробирка с жидкостью равномерно прогрелась; 4) далее следует нагревать только ту часть пробирки, где находятся вещества, при этом пробирку удерживать в слегка наклонном положении; 5) открытый конец пробирки следует отводить от себя и других лиц; 6) после нагревания жидкости пробиркодержатель с пробиркой поместить в штатив для пробирок; 7) фитиль спиртовки закрыть колпачком. Если реактивы попали на рабочий стол, их удаляют с поверхности стола с помощью салфетки. Если реактив попал на кожу или одежду, необходимо незамедлительно обратиться за помощью к эксперту-экзаменатору. Вы готовы к выполнению эксперимента. Поднимите руку и пригласите организатора в аудиторию, который пригласит экспертаэкзаменатора для оценивания проводимого Вами эксперимента. Записывайте в черновике свои наблюдения за изменениями, происходящими с веществами в ходе реакций. Внимание: в случае ухудшения самочувствия перед началом опытов или во время их выполнения обязательно сообщите об этом организатору в аудитории. Вы завершили эксперимент. Подробно опишите наблюдаемые изменения, которые происходили с веществами в каждой из двух проведённых Вами реакций. Сделайте вывод о химических свойствах веществ (кислотно-оснόвных,окислительновосстановительных), участвующих в реакции и классификационных признаках реакций. Проведение химического эксперимента осуществляется в специальном помещении – химической лаборатории (список оборудования и реактивов приводится в спецификации). Для наблюдения за проведением химического эксперимента должны обязательно приглашаться специалисты-химики, которые являются одновременно и экспертами по оценке его выполнения На химический эксперимент дополнительно выделяется 20 минут. В 2011 году в комплект заданий для Государственной Итоговой Аттестации учащихся 9 класса по химии включен новый тип заданий с развернутым ответом. Как отмечается в спецификации ГИА-2011, третье задание предусматривает проверку умения учащихся составлять уравнение реакции по описанным в условии признакам протекания химических реакций. Химические свойства простых веществ Химические свойства сложных веществ. Качественные реакции на ионы в растворе (хлорид-, сульфат-, карбонат-ионы, ион аммония). Получение газообразных веществ. Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак). Задание С3 оценивается в 3 балла и в На занятиях химического кружка учащиеся исследовали кристаллическое вещество белого цвета. В результате добавления к нему гидроксида калия и последующего нагревания полученной смеси выделился газ с резким специфическим запахом, при горении которого образовался азот. Определите состав исследуемого вещества и запишите его название. Составьте 2 уравнения реакций, которые были проведены учащимися в процессе его распознавания. Предлагаются следующие критерии для проверки и оценивания выполнения этого задания: элементы ответа (допускаются иные формулировки ответа, не искажающие его смысл) 1)Определен состав вещества и записано его название: NH4Cl – хлорид аммония. Составлены 2 уравнения реакций, проведенных учащимися в процессе исследования неизвестного вещества: 2) NH4Cl + КOH => КCl + NH3 + H2O 3) 4NH3 + 3O2 = 2N2 + 6H2O Баллы: Ответ правильный и полный, включает все названные элементы. 3 Правильно записаны 2 элемента из названных выше. 2 Правильно записан 1 из названных выше элементов. 1 Все элементы ответа записаны неверно. 0 Фраза "допускаются иные формулировки ответа, не искажающие его смысл" очень здесь к месту, поскольку представленная в задаче информация позволяет определить только катион соли. А значит правильным ответом следует признать в пункте 1 и любую другую соль аммония. Нестандартность условия задачи, наличие в нем некоторой неопределенности может испугать ученика привыкшего к стандартным формулировкам. Решить эту проблему может расширение круга подобных проблемных задач, использование их для подготовки учащихся с использованием как индивидуальных, так и групповых форм работы. Далее предлагается еще несколько вариантов задач предложенного типа, составленных автором. Сразу отметим, что они сложнее рассмотренного задания, поскольку предполагают написание трех уравнений реакций. Если Вы учитель химии, Вы можете облегчить задачу, или из одной задачи сделать несколько, убирая описание одной из реакций. На занятиях химического кружка учащиеся исследовали простое вещество желтого цвета, нерастворимое в воде.При сжигании этого вещества в кислороде образовался газ с резким запахом. Когда газ растворяли в воде, получался раствор, в котором окраска лакмуса становилась красной. Если же в колбу с газом наливали раствор гидроксида натрия, то запах газа быстро исчезал. Определите состав исследуемого вещества и запишите его название. Составьте 3 уравнения реакций, которые были проведены учащимися в процессе его распознавания. На занятиях химического кружка учащиеся исследовали кристаллическое вещество синего цвета, которое легко растворялось в воде с образованием голубого раствора. При добавлении к этому раствору раствора хлорида бария образовался осадок белого цвета, не растворимый в кислотах. Если же к голубому раствору приливали раствор гидроксида натрия, то выпадал синий осадок. Этот осадок легко растворялся в соляной кислоте. Определите состав исследуемого вещества и запишите его название. Составьте 3 уравнения реакций, которые были проведены учащимися в процессе его распознавания. На занятиях химического кружка школьники под руководством учителя исследовали металл, который хранился в лаборатории под слоем керосина. Небольшой кусочек этого металла опустили в стакан с водой. При этом прошла энергичная реакция с выделением газа, и металл полностью растворился. Получился раствор, в котором окраска фенолфталеина Задача 4. стала малиновой. К одной порции этого раствора добавили немного раствора сульфата меди - выпал осадок синего цвета. К другой порции добавили соляной кислоты до исчезновения окраски фенолфталеина и затем раствор выпарили. Полученные белые кристаллы по составу и свойствам ничем не отличались от обычной поваренной соли. Определите состав исследуемого вещества и запишите его название. Составьте 3 уравнения реакций, которые были проведены учащимися в процессе его распознавания Катион Реагент или воздействие Внешний эффект КИУ реакции на катион Н+ Индикаторы Изменение цвета: универсальный индикатор и лакмус покраснеют, метиловый оранжевый—порозовеет. Не записываем. Na+ Пламя Окраска пламени становится равномерно желтой Не записываем K+ Пламя Окраска пламени становится равномерно фиолетовой Не записываем Ag+ Раствор с анионом Cl- Выпадает белый творожистый осадок, не растворимый в азотной кислоте, чернеющий на свету. Ag++Cl- = AgCl↓ NH4+ Раствор щелочи при нагревании Запах аммиака. Влажная индикаторная бумага дает изменение как на ион ОН NH4++OH- = NH3↑+H2O Cu2+ Раствор щелочи В голубом или синем растворе соли выпадает осадок синего цвета. Cu2++2OH- = Cu(OH)2↓ Катион Реагент или воздействие Внешний эффект КИУ реакции на катион Ba2+ 1) пламя; 2) раствор с анионом SO42- ) Окраска пламени становится равномерно желтозеленой; 2) выпадает белый осадок, который в кислотах не растворяется. 1)Не записываем; 2)Ba2++SO42- = BaSO4↓ Fe2+ Красная кровяная соль K3(Fe(CN)6) Выпадение темносинего осадка. K++Fe2++(Fe(CN)6)3-= =KFe(Fe(CN)6)↓ Ca2+ Пламя Окраска пламени становится равномерно кирпично-красной. Не записываем. Fe3+ ) Желтая кровяная соль K4(Fe(CN)6); 2) роданид-ион SCN-;3) раствор щелочи ) Выпадение синего осадка; 2) кровавокрасное окрашивание раствора; 3) выпадение бурого осадка 1)K++Fe3++(Fe(CN)64-= =KFe(Fe(CN)6)↓ 2)не записываем 3)Fe3++3OH- = Fe(OH)3↓ Анион Реагент Внешний эффект КИУ реакции на катион ОН- Индикаторы Изменение цвета: универсальный индикатор и лакмус посинеют, метиловый оранжевый—пожелтеет. Не записываем Cl- Раствор с катионом Ag+ Выпадает белый творожистый осадок, не растворимый в азотной кислоте, чернеющий на свету. Cl-+Ag+ = AgCl↓ Br- Раствор с катионом Ag+ J- Раствор с катионом Ag+ Выпадение светлоBr-+Ag+ = AgBr↓ желтого осадка, который растворяется в азотной кислоте и темнеет на свету. Выпадение желтого осадка, J-+Ag+ = AgJ который растворяется в азотной кислоте и темнеет на свету. Реагент Внешний эффект КИУ реакции на катион S2- Раствор с катионом Pb2+ Выпадение черного осадка. S2-+Pb2+ = PbS↓ SO42- Раствор с катионом Ba2+ Выпадает белый осадок, который в кислотах не растворяется. SO42-+Ba2+ = BaSO4 SO32- Раствор с катионом H+ Выделяется газ, имеющий запах жженой спички SO32-+2H+ = H2O+SO2↑ CO32- Раствор с катионом Ca2+ Выпадает белый осадок, который в кислотах растворяется с выделением газа без цвета и запаха. CO32-+Ca2+ = CaCO3↓ PO43- Раствор с катионом Ag+ Выпадение желтого осадка, который растворяется в азотной кислоте. PO43-+3Ag+ = Ag3PO4↓ Анион В целях повышения качества подготовки по химии выпускников основной школы рекомендуются следующие меры. • Тщательнее отрабатывать материал: практико-ориентированного направления, в том числе, имеющий непосредственное отношения к реальным жизненным ситуациям; содержащий сведения о роли веществ в различных отраслях промышленности, сельском хозяйстве, быту, их грамотном хранении и применении. • При выполнении реального химического ученического эксперимента больше внимания уделять формированию следующих умений: наблюдать, описывать свойства веществ, фиксировать результаты опытов и формулировать выводы. •