Неметаллы
advertisement
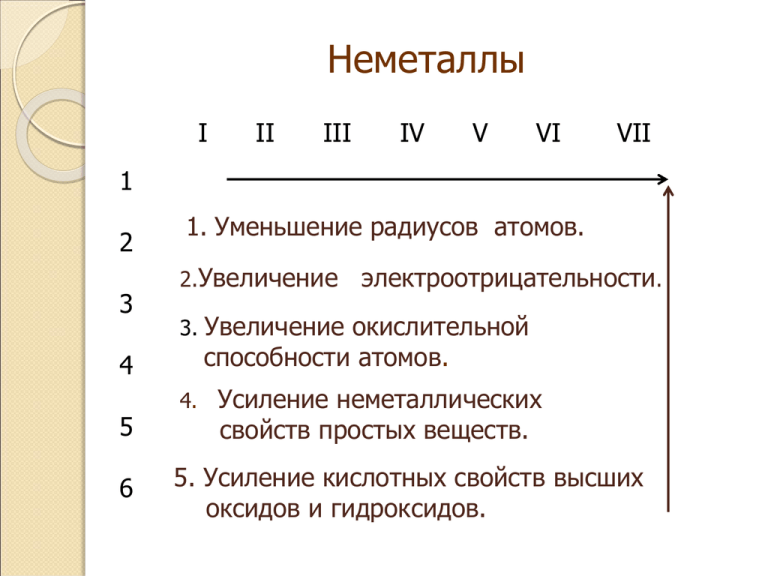
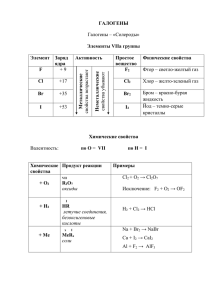
Неметаллы I II III IV V VI VII 1 2 3 4 5 6 1. Уменьшение радиусов атомов. 2.Увеличение электроотрицательности. 3. Увеличение окислительной способности атомов. 4. Усиление неметаллических свойств простых веществ. 5. Усиление кислотных свойств высших оксидов и гидроксидов. VII A группа (галогены) элемент Порядковый номер Номер периода Группа подгруппа Ar F 9 2 VIIA 19 Cl 17 3 VIIA 35,5 Br 35 4 VIIA 80 5 VIIA 127 I 53 VII A группа (галогены) I F II III IV V VI VII 1 2 Cl 3 Br 4 I 5 6 1. Сходство: 7 валентных электронов на внешнем слое. 2. Валентность: а) у фтора – только I б) у Cl, Br, I – I, III, V, VII Строение атомов фтора и хлора -распределение электронов F по энергетическим уровням +9 2 , 7 Cl + 17 2 , 8 , 7 Соединения хлора 0 -1 Низшая степень окисления HCL Только вос-ль CL2 +1 +3 +5 CL2O CL2O3 CL2O5 HCLO HCLO2 HCLO3 И восстановитель, и окислитель +7 Высшая степень окисления CL2O7 HCLO4 Только ок-ль CL2O7 - высший оксид – оксид хлора (VII) HCLO4 – высший гидроксид – хлорная кислота HCL – летучее водородное соединение - хлороводород Простые вещества - галогены Галоген F2 CL2 Br2 I2 Агрегатное состояние цвет запах газ Светложёлтый резкий газ Жёлтозелёный Резкий удушающий Жидкость Краснобурый Сильный зловонный Твёрдое Тёмносерый резкий Домашнее задание § 29 № 9.5; № 9.7; № 9.19* (Хомченко) Галогеноводородные кислоты HF р-р HCL р-р HBr р-р HI р-р Фтороводородная (плавиковая Хлороводородная (соляная) Бромоводородная Йодоводородная Соли: фториды Соли: хлориды Соли: бромиды Соли: иодиды Увеличение длины связи, усиление кислотных св-в; HIр-р – самая сильная из всех известных к-т Кислородсодержащие кислоты хлора +1 +3 +5 +7 HClO HClO2 HClO3 HClO4 хлорноватиста я хлористая хлорноватая хлорная Соли: Соли: Соли: Соли: гипохлориты хлориты хлораты перхлораты Усиление кислотных свойств Химические свойства хлора 1. Взаимодействие с неметаллами: o o +1 -1 H2 + Cl2 = 2HCl -é вос-ль +é ок-ль O2 + Cl2 =хлор не горит в кислороде 2. Взаимодействие с металлами: o o +2 -1 Cu + Cl2 = CuCl2 -é вос-ль +é ок-ль Химические свойства хлора 3. Взаимодействие с водой: Cl2 + H2O = HCl + HClO 4. Взаимодействие с солями: Cl2 + 2NaBr = Br2 + 2NaCl Получение брома Br2 + NaCl = реакция не идёт Более активный галоген может вытеснить менее активный из его соли 5. Взаимодействие сo щёлочами: +1 -1 0 Cl2 + 2NaOH = NaCl + NaClO + H2O хол. р-р -1 0 +5 3Cl2 + 6NaOH = 5NaCl+NaClO3 +3H2O гор. р-р Реакция самоокисления и самовосстановлениядиспропорционирования Домашнее задание § 29 № 9.6; № 9.14 (Хомченко)