6_Биологическое окисление. Энергетический обмен
advertisement

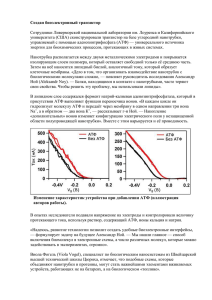
Окислитель ное фосфорилирование создает условия для АТФ -универсальная формой энергии в живых организмах БИОЛОГИЧЕСКОЕ НИЕ Хемиосмотическая теория • Предложена Питером Митчелом в 1960 (Нобелевская премия, 1978) • Хемиосмотическая теория: т ранспорт элект ронов и синт ез АТФ объеденены прот онным градиент ом через внут реннюю мембрану мит охондрий + + + - - - + + + - 1. Необходима интактная митохондриальная мембрана 2. Транспорт электронов через ЭТЦ генерирует прот онный градиент 3. AТФ синт аза катализирует фосфорилирование АДФ в реакции, которая обеспечивается прохождение Н+ через внутреннюю мембрану в матрикс АТФ синтаза Две субъединицы, Fo и F1 F1 содержит каталитические субъединицы, г е АДФ и Pи связываются. F0 пронизывает мембрану и служит как протонный канал. Энергия, которая освобождаетсяться при “падении” протонов используется для синтеза АТФ. Активный транспорт ATФ, AДФ и Pн через внутреннюю митохондриальную мембрану • АТФ должен транспортироваться в цитозоль, а АДФ и Pн - в матрикс • AДФ/ATФ переносчик меняет митохондриальное ATФ на цитозольное АДФ • Фосфат (H2PO4-) транспортируется в матрикс за механизмом симпорта з H+. • Переносчик фосфата снижает pH. РЕГУЛЯЦИЯ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ Сопряжение тканевого дихания с окислительным фосфорилированием Транспорт электронов тесно связан с фосфорилированием. АТФ не может быть синтезирован путем окислительного фосфорилирования если нет энергии освобожденной при электронном транспорте. РЕГУЛЯЦИЯ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ Электроны не проходят через электронтранспортную цепь если АДФ не фосфорилируется до АТФ. Основные регуляторы: НАДН, O2, AДФ Внутримитохондриальное соотношение АТФ/АДФ является контрольным механизмом Высокое соотношение ингибирует так как АТФ аллостерически связывается с комлексом IV Дыхательный контроль Регуляция скорости окислительного фосфорилирования с помощью уровня АДФ называется дыхательным конт ролем Разобщение тканевого дыхания и окислительного фосфорилирования Внутрення митохондриальная мембрана содержит белокразобщения. Белок-разобщения образует канал для перехода протонов из цитозоля в матрикс. Разобщители • Разобщителями являются жирорастворимые слабые кислоты • Разобщители снижают протонный градиент транспортируя протоны через мембрану 2,4-Динитрофенол – эффективный разобщитель Выход АТФ 10 протонов выкачиваются из матрикса во время транспорта двух электронов от НАДН к O2 (комплекс I, III и IV). 3 4 4 2 Перенос 3H+ необходим для синтеза одной молекулы АТФ АТФ-синтазой 1 H+ необходим для транспорта Pн. 4 H+ используется для каждой синтезированной АTФ Для НАДН: 10 H+/ 4H+ = 2.5 АТФ Для ФАДН2: 6 H+/ 4 H+ = 1.5 ATФ Вступление в обмен веществ. Специфические и общие пути превращения углеводов, липидов и белков (окислительное декарбоксилирование ПВК, цикл трикарбоновых кислот). • Метаболизм – химические реакции, которые проходят в организме • Метаболиты – маленькие промежуточные молекулы, которые образуются в процессе деградации и синтеза полимеров Последовательность реакций, которые имеют цель (например, расщепление глюкозы, синтез жирных кислот) называется метаболическимм путем Метаболические пути могут быть: (a) Линейными (b) Циклическими (c) Спиральными (синтез жирных кислот) Метаболизм разделяется на – катаболизм и анаболизм Катаболические реакции – деградация больших молекул с образованиемм меньших и энергии Анаболические реакции – синтез макромолекул для жизнедеятельности клеток, роста и репродукции Катаболизм характеризируется реакциями окисления и освобождения энергии, которая трансформируется в АТФ Анаболизм характеризируется реакциями восстановления и утилизацией энергии, аккумулированной в АТФ Регуляция метаболических путей Уровни регуляции метаболизма 1.Нервная система 2.Эндокринная система 3.Взаимодействие между органами 4.Клеточный (мембранный) уровень 5.Молекулярный уровень Стадии метаболизма Катаболизм Стадия I (специфическая). Деградация макромолекул (белков, углеводов, липидов) до мономеров Стадия II (специфическая). Аминокислоты, жирные кислоты и глюкоза окисляются к общему метаболиту – ацетил коэнзиму А Стадия III (неспецифическая). Ацетл СoA окисляется в цикле лимонной кислоты до CO2 и воды ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПИРУВАТА Глюкоза Гликолиз Аминокислоты Пируват Ацетил CoA Глицерол Транспорт пирувата в митохондрию Превращение пирувата в ацетил СоА • Пируват дегидрогеназный комплекс - полиферментный комплкс, который состоит из 3 ферментов, 5 коферментов Пируватдегидрогеназный комплекс - молекулярная масса от 4 до 10 млн дальтон Электронная микрофотография пируватдегидрогеназного комплекса E. coli. Ферменты: E1 = пируват дегидрогеназа E2 = дигидролипоилацет илт рансфераза E3 = дигидролипоилдегидрогеназа Коферменты: ТПФ (т иамин пирофосфат ), липоамид, HS-КoA, ФАД, НАД+. ТПФ является производным витамина B1 (тиамин); НАД –B5 (никотинамид); ФАД –B2 (рибофлавин), HS-CoA –B3 (пантотеновая кислота), липоамид – липоевая кислота Общая реакция пируватдегидрогеназного комплекса Цикл трикарбоновых кислот Названия: Цикл трикарбоновых кислот Цикл лимонной кислоты Цикл Кребса У эукариот все реакции цикла Кребса проходят в матриксе митохондрий Ганс Адольф Кребс Биохимик; родился в Германии. Работал в Британии. Его открытие в 1937 р, цикл Кребса, было критическим для понимания клеточного метаболизма. Нобелевская премия в 1953 г. Общие представления о цикле Кребса Цикл лимонной кислоты. Ферменты: 1 — цитратсинтаза; 2 — аконитаза; 3 — изоцитратдегидрогеназа; 4 — а-кетоглутаратдегидрогеназный комплекс; 5 — сукцинаттиокиназа; 6 — сукцинатдегидрогеназа; 7 — фумаратгидратаза; 8 — малатдегидрогеназа. Функции цикла трикарбоновых кислот • Интеграция метаболизму. Цикл является амфиболичным (катаболичным и анаболичным одновременно). • Образование энергии в форме ГТФ (ATФ). • Образование восстановительных эквивалентов в форме НАДН и ФАДH2 Регуляция цикла трикарбоновых кислот - NADH, ATP, succinyl CoA, citrate Цикл Кребса как источник биосинтетических предшественников Glucose Phosphoenolpyruvate The citric acid cycle provides intermediates for biosyntheses