Обобщение и систематизация знаний по теме "Неметаллы"
advertisement

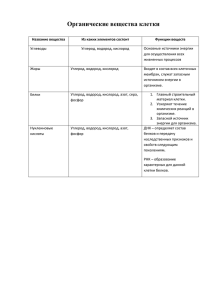
Тема урока: Обобщение и систематизация знаний по теме “ Неметаллы “ “ Не в количестве знаний заключается образование, но в полном понимании _________ и искусном применении __________ всего того, что знаешь” А.Дистервег Неметаллы Всего 23 из 117 известных на сегодняшний день. К ним относятся: - Наиболее типичные неметаллы ( 10 элементов ) Водород – Н2 Кислород – О2 Углерод - с Азот - N2 Фосфор - Р Сера - S Галогены Фтор - F2 Хлор - Cl2 Бром – Br2 Иод – J2 ( 7 элементов – благородные газы ) Гелий - Не Неон – Ne Аргон - Аr Криптон – Kr Ксенон – Xe Радон - Rn И элемент № 118 c условным обозначением Uuo 6 неметаллов проявляют определённую двойственность, к ним относятся: Бор – B Кремний – Si Мышьяк - As Селен – Se Теллур – Te Астат - At Вопрос: Почему они проявляют определённую двойственность ? Неметаллы Галогены F2, Cl2, Br2, J2 Кислород и сера О2, S Азот и Фосфор N2,P Углерод и Кремний С, Si План работы 1. 2. 3. Внешние отличия, агрегатное состояние, физические свойства. Строение атомов, окислительновосстановительные свойства. Получение и применение. Галогены “ Рождающие соли “ Молекула двухатомна – F , Cl , Br , J , образована ковалентной неполярной связью. At – неустойчив, мало изучен! F , Cl - газы; Br - жидкость; J - твёрдое кристаллическое вещество. Имеют резкий запах и являются токсичными веществами. Атомы галогенов имеют на внешнем электронном слое - 7 электронов. В соединениях с другими элементами галогены проявляют степени окисления -1, +1, +3, +5, +7. Самый электроотрицательный элемент - фтор - в соединениях с другими элементами проявляет постоянную степень окисления -1. Галогены являются окислителями по отношению к большинству металлов, неметаллов и многих сложных веществ. Окислительная способность простых веществ галогенов уменьшается от фтора к йоду. 2 2 2 2 2 2 2 2 Кислород и сера. Халькогены “ рождающие руды ” Простые вещества кислорода и серы существуют в виде нескольких аллотропных модификаций : Кислород О2 Кислород О3 Озон Сера Кристаллическая S8 Пластическая S∞ Атомы элементов VIA- группы имеют на внешнем электронном слое по 6 электронов. В соединениях с другими элементами кислород чаще всего проявляет степень окисления -2, остальные халькогены в соединениях с металлами и водородом - -2, а в соединениях с более электроотрицательными элементами - +4 и +6. Практически во всех реакциях кислород выступает в качестве окислителя. Сера при взаимодействии с металлами, водородом и некоторыми неметаллами ведет себя как окислитель. В реакциях с кислородом и галогенами сера является восстановителем. Горение серы в кислороде S + O2= SO2 Азот и фосфор Молекула азота двухатомна- N (газ) Фосфор образует аллотропные модификации: - Белый фосфор (ядовитое вещество) - Красный фосфор - Чёрный фосфор На внешнем электронном слое - по 5 электронов. Обычно проявляют степень окисления = -3. Максимальная положительная степень окисления = +5. 2 N и P проявляют восстановительные свойства в реакции с О ; Окислительные свойства – в реакциях с активными металлами. 2 2 Углерод и кремний Углерод существует в виде нескольких аллотропных модификаций : - Графит - Алмаз - Карбин - Фуллерен Кристаллическая решётка кремния аналогична кристаллической решётке алмаза. У атомов С и Si на внешнем слое находится по 4 электрона. В соединениях с Me и H проявляют степень окисления = -4. В соединениях с более электроотрицательными элементами C и Si проявляют степень окисления = +4 и +2. 2 При взаимодействии с другими веществами C и Si могут проявлять как восстановительные, так и окислительные свойства. “ Семейка из колбы “ Na2SiO3 F2 MgF2 BaSO4 CaCO3 Тест Правильные ответы В) В) В) А);В);Г) В) В) А) Б);В) Г) Б) Домашнее задание. Повторить §3 – 21, подготовиться к КР №1 по теме “ Неметаллы ”. Используя “ Эстафету знаний “, каждый ученик выбирает задание определенного уровня сложности. Я → мы → дело - Оценка себя - Оценка тебя группой. Спасибо за внимание!