ОК Уравнение состояния идеального газа 10классx
advertisement

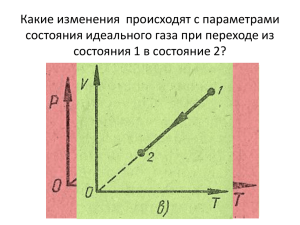
ГЛАВА III. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ГАЗОВЫЕ ЗАКОНЫ. I. Уравнение состояния идеального газа . Газ, потенциальной энергией молекул которого можно пренебречь, называется идеальным. P,V,T – макроскопические параметры, характеризующие состояние данной массы газа . N 1 m 1 m P nkT kT N A kT RT , где V V M V M Äæ универсальная R N A k 6,02 10 23 ìîëü 1 1,38 10 23 Äæ 8,31 – газовая постоянная Ê ìîëü Ê PV P1V1 m R T1 M P2V2 m R T2 M m RT M P1V1 P2V2 T1 T2 – уравнение Менделеева-Клайперона – уравнение Клайперона II. Газовые законы. Процессы, протекающие при неизменном значении одного из параметров, называются изопроцессами. 1. Изотермический процесс – процесс изменения состояния термодинамической системы при постоянной температуре. T, m, M – const P↓ P~ 1 V m RT M – закон Бойля-Мариотта P1V1 P2V2 PV const m (Англия-Франция) P2V2 RT M Произведение P данной массы газа на его V постоянно , если T газа не меняется . P1V1 Изотермы: 2 1 1 2 T1>T2 2. Изобарный процесс – процесс изменения состояния термодинамической системы при постоянном давлении. fтр→0 P, m, M – const PV1 = m/M · RT1 const m P V1 RT1 V1 T1 V1 V2 M V или const - закон Гей-Люссака (Франция) m V T T T 2 2 1 2 T P V2 RT 2 M V данной массы газа, при постоянном давлении, пропорционален T. Изобары: P2>P1 3. Изохорный процесс – процесс изменения состояния термодинамической системы при постоянном объёме. V, m, M, - const P↑ m RT1 M m P2 V RT 2 M P1 V P1 T1 P2 T2 P1 P2 P T1 T2 или T const - закон Шарля (Франция) P данной массы газа при постоянном V пропорционально T. Изохоры: 1 V2>V1 2 1 2