ролевая игра_углерод
advertisement

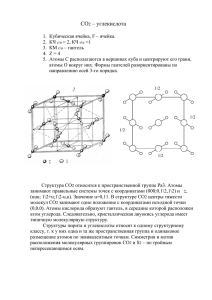
МОУ Чухломская средняя общеобразовательная школа имени А.А. Яковлева Суд над Углеродом и его соединениями (урок-ролевая игра,9класс) Учитель химии Сергеева Н.Ю. 2005-2006 уч.год Цели урока: • Систематизировать и расширить знания учащихся по данной теме; • Рассмотреть значение углерода, его круговорот в природе,антропогенное влияние на биохимический цикл углерода и меры по его сохранению; • Научить видеть и выделять главное, составлять конспект. План урока: 1. 2. 3. 4. 5. 6. 7. Положение углерода в периодической системе, строение атома . Аллотропные модификации углерода, их физические свойства и значение. Химические свойства углерода. Оксид углерода(II),состав, строение, свойства, значение. Оксид углерода(IV),состав, строение, свойства, значение. Круговорот углерода в природе. Экологические проблемы, связанные с соединениями углерода (кислотные дожди, парниковый эффект), и пути их решения. Судебное разбирательство «Углерод и его соединения» 1 Секретарь суда- учитель Сергеева Н. Ю. 2. Судья-Севастьянов Павел 3. Прокурор-Фёдоров Владимир 4. Защитник-Вишнякова Кристина 5. Свидетель-Большакова Наталья 6. Углерод-Макаров Сергей 7. Угарный газ-Лебедев Дмитрий 8. Углекислый газ-Крылов Артём 9. Германий-Смирнова Ксения 10. Кремний- Федотова Ольга 11. Химик-Соколова Елена 12. Эколог-Исаева Роза 13. Судмедэксперт-Конева Наталия 14. Пострадавшая- Беляева Анна 15. Представитель паспортной службыШмелёва Ольга Аллотропные модификации углерода -алмаз Кристаллическая решётка алмаза Аллотропные модификации углерода- графит Кристаллическая решётка графита Открытие Н. Д. Зелинского 1861-1953 Фильтрующая коробка Помутнение известковой воды СаСО3 НСl Раствор Са(ОН)2 Применение углерода Химические свойства углерода Окислитель С+2Н2 СН4 2С+Са СаС2 Восстановитель С+О2 СО2 С+СuО 2Сu+СО2 Угарный газ Строение молекулы С==О Mr (CО)=28 Mr(возд.)=29 Свойства Получение 2СО+О 2=2СО 2+572 кДж 2СО+О2 СО+CuО СО 2+С Сu +СО2 СО 2СО Углекислый газ Строение молекулы О С О Свойства СО 2+Н 2О Н 2СО3 СО2+СаО СаСО3 СО2+2NаОН Nа2CО3+Н2О Качественная реакция на СО2 Са(ОН)2+СО2 СаСО3+Н2О Кислотные дожди в Европе «Парниковый эффект» СО2 Круговорот углерода в природе Зелёные растения 1 2 4 Атмосфера и гидросфера 33 5 животные 8 7 Минералы 6 1-фотосинтез; 2-пищеварение животных и человека; 3-гниение, дыхание,брожение, горение; 4- гниение, горение; 5, 6-разложение без доступа воздуха остатков древних животных и растений; 7-обмен СО2 между атмосферой и Мировым океаном; 8разложение известняка Выводы: • Благодаря Углероду существует многообразие растений и животных. • Углекислый газ- основной реагент при фотосинтезе. • Биосфера загрязняется Углекислым газом. Неразумная человеческая деятельность может привести к непоправимым последствиям.